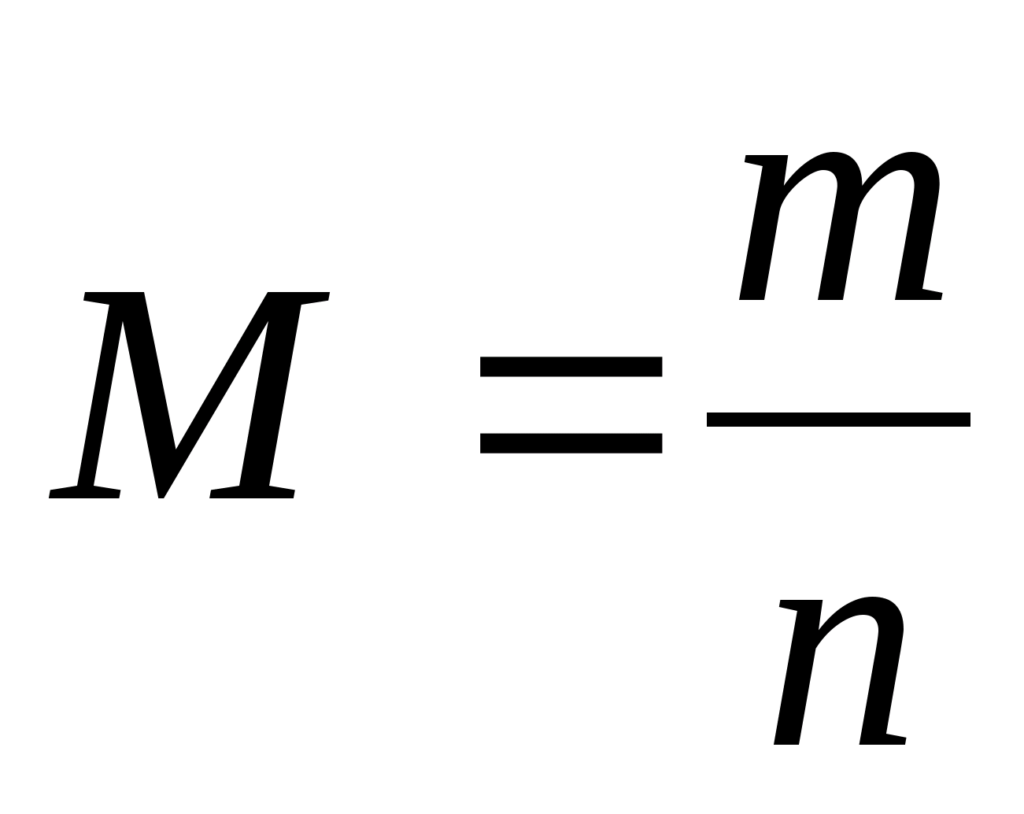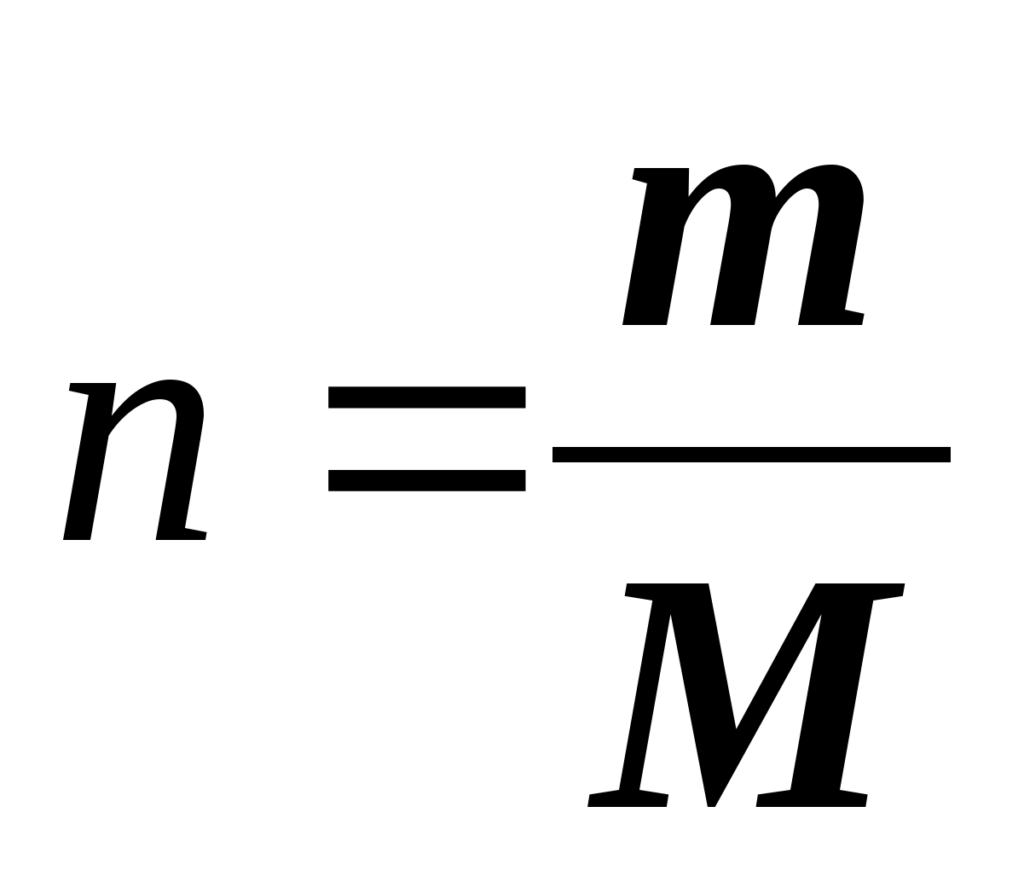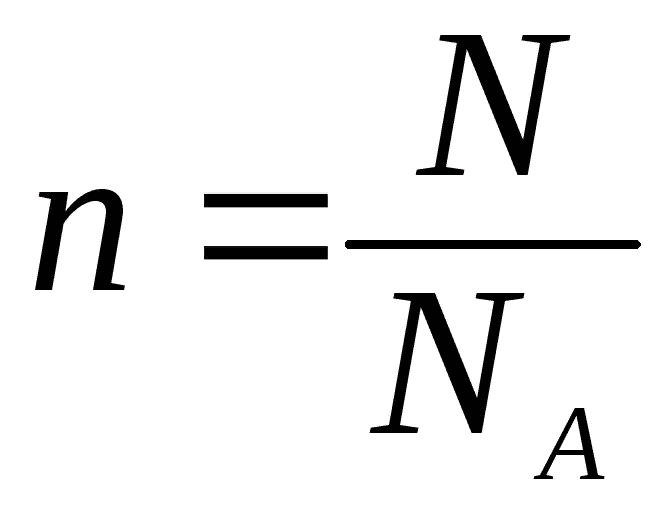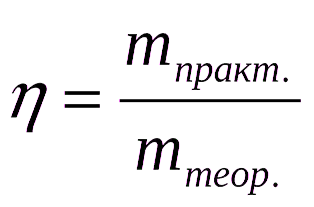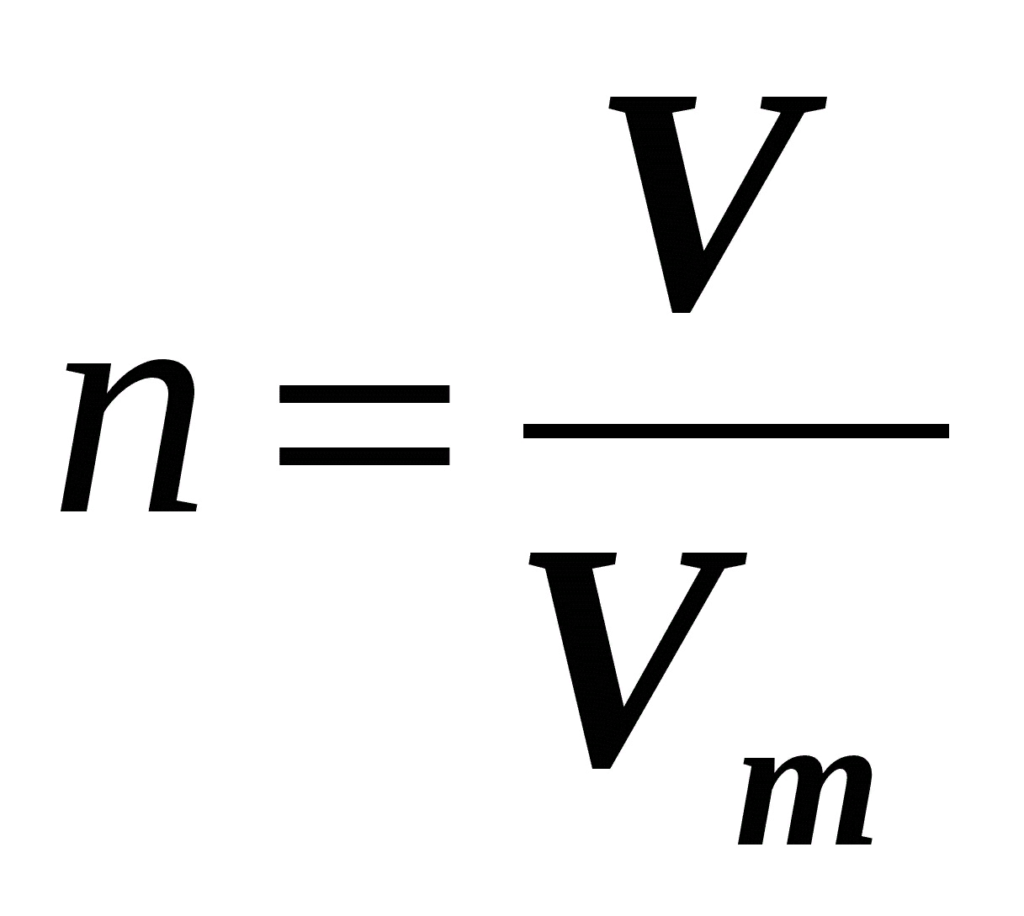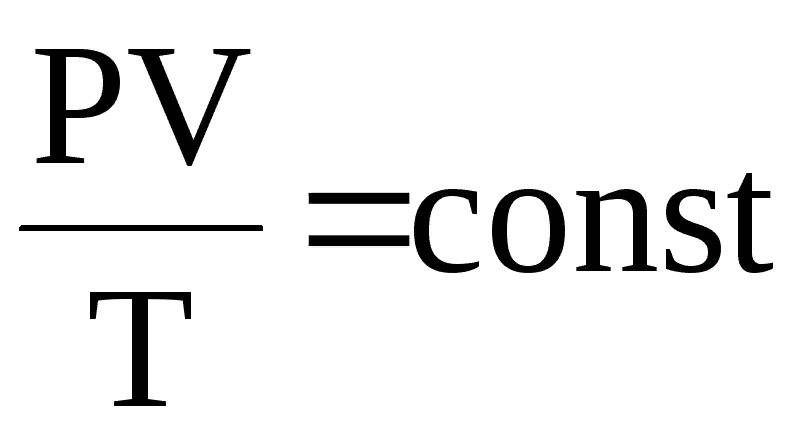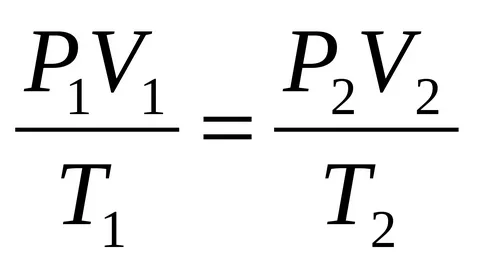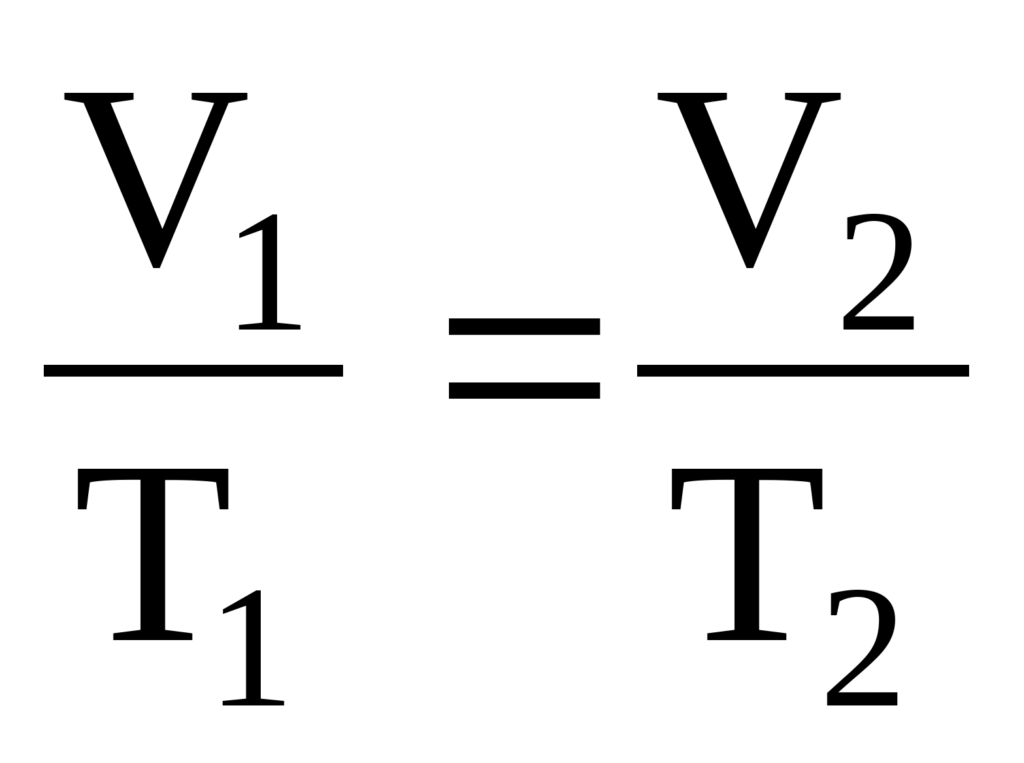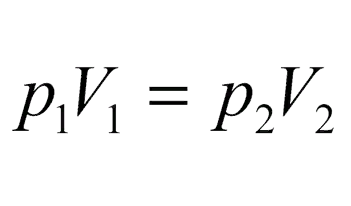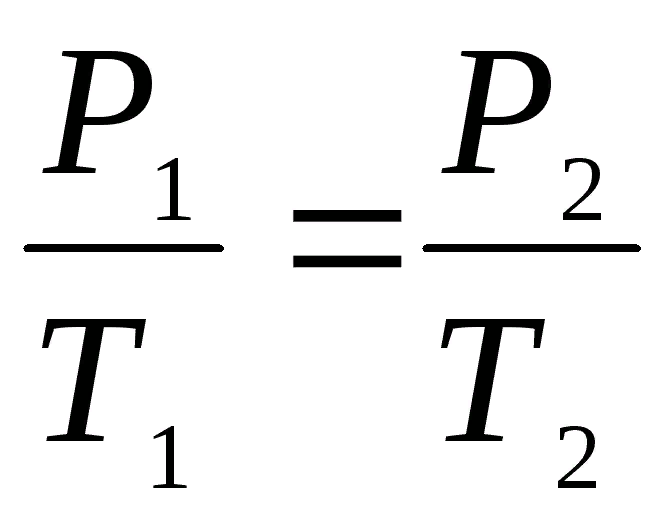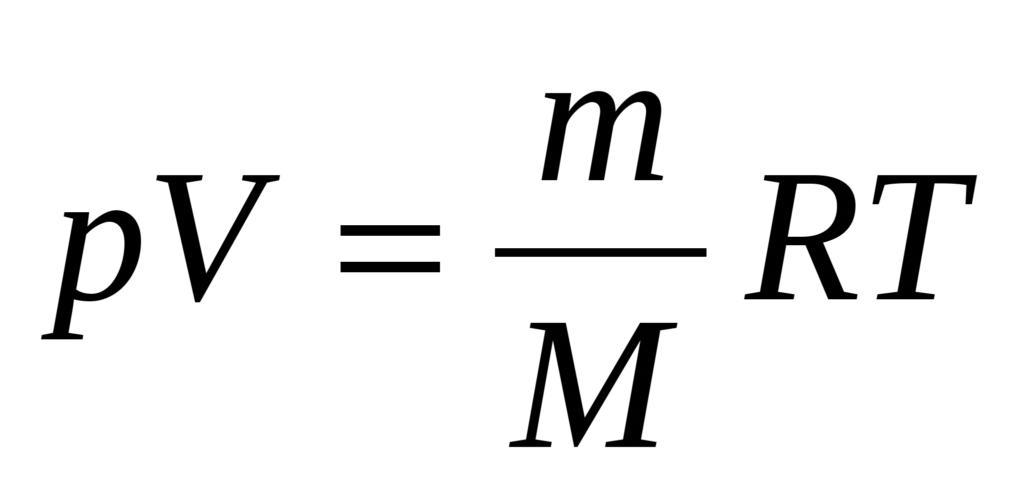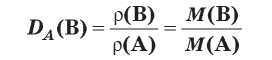Основные понятия и законы химии
Химия — наука о веществах, физических и химических свойствах, закономерностях превращений и применении.
Химические явления — это процессы, при которых одни вещества превращаются в другие, отличающиеся от исходных составом и свойствами, при этом состав ядер атомов не изменяется.
Физические явления — это процессы, сопровождающиеся изменением физического состояния веществ (парообразование, плавление, электропроводность, выделение тепла и света, ковкость и др.) или при этом образуются новые вещества с изменением состава ядер атомов.
Атомно — молекулярное учение.
- Все вещества состоят из молекул.
- Молекулы состоят из атомов.
- Молекулы и атомы находятся в непрерывном движении; между ними существуют силы притяжения и отталкивания.
Молекула — наименьшая частица вещества, обладающая его химическими свойствами.
Атом — наименьшая частица химического элемента, сохраняющая все его химические свойства. Различным элементам соответствуют различные атомы.
Химический элемент — это вид атомов, характеризующийся определенными зарядами ядер и строением электронных оболочек.
В настоящее время известно 117 элементов: 89 из них найдены в природе (на Земле), остальные получены искусственным путем. Атомы существуют в свободном состоянии, в соединениях с атомами того же или других элементов, образуя молекулы. Способность атомов вступать во взаимодействие с другими атомами и образовывать химические соединения определяется его строением. Атомы состоят из положительно заряженного ядра и отрицательно заряженных электронов, движущихся вокруг него, образуя электронейтральную систему, которая подчиняется законам, характерным для микросистем.
Атомное ядро — центральная часть атома, состоящая из Z протонов и N нейтронов, в которой сосредоточена основная масса атома.
Массовое число — сумма протонов и нейтронов атомного ядра A = Z + N.
Заряд ядра — положительный, по величине равен количеству протонов в ядре или электронов в нейтральном атоме и совпадает с порядковым номером элемента в периодической системе.
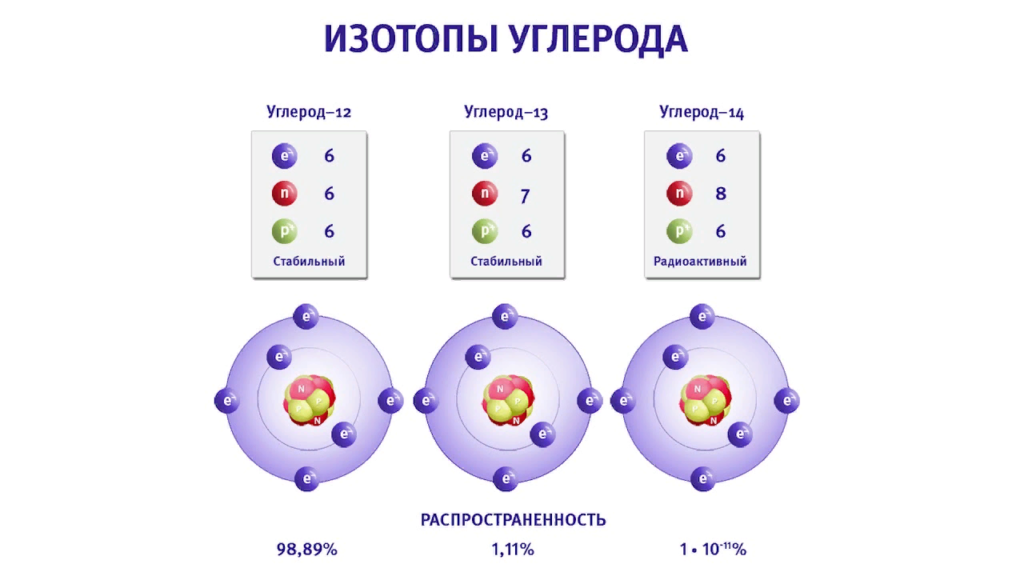
Изотопы — химические элементы с одинаковыми зарядами ядер, но различными массовыми числами за счет разного числа нейтронов в ядре.
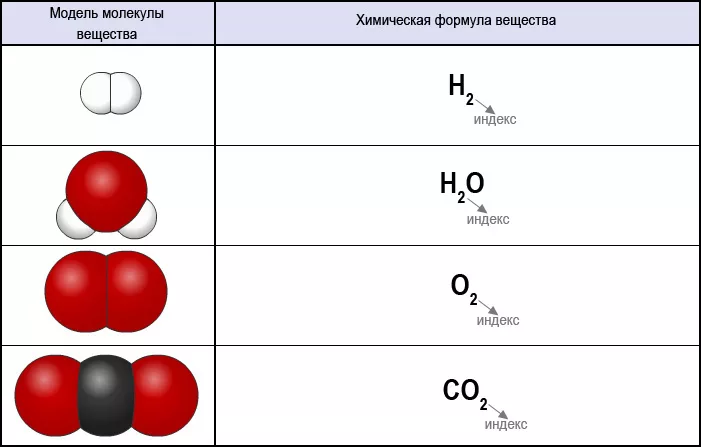
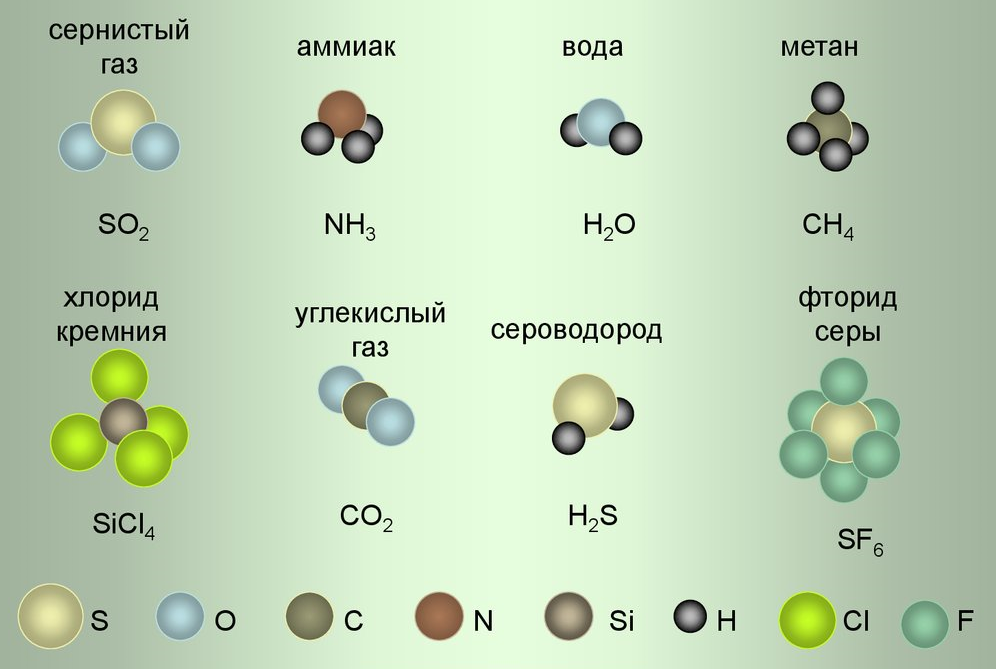
Химическая формула — это условная запись состава вещества с помощью химических знаков (предложены в 1814 г. Й. Берцелиусом) и индексов (индекс — цифра, стоящая справа внизу от символа. Обозначает число атомов в молекуле).
Химическая формула показывает, атомы каких элементов и в каком отношении соединены между собой в молекуле.
Простые вещества — это вещества, молекулы которых состоят из атомов одного и того же элемента.
Cложные вещества – это вещества, молекулы которых состоят из атомов различных химических элементов.
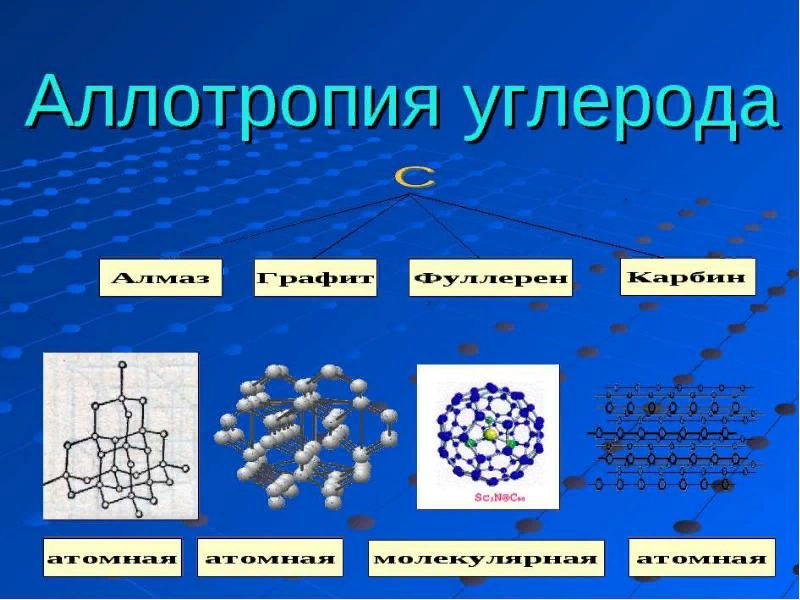
Аллотропия — явление образования химическим элементом нескольких простых веществ, различающихся по строению и свойствам.
Международная единица атомных масс равна 1 /12 массы изотопа 12 C — основного изотопа природного углерода.
1 а.е.м = 1 /12 • m ( 12 C) = 1,66057 • 10 -24 г
Относительная атомная масса (Ar) — безразмерная величина, равная отношению средней массы атома элемента (с учетом процентного содержания изотопов в природе) к 1 /12 массы атома 12 C.
Средняя абсолютная масса атома (m) равна относительной атомной массе, умноженной на а.е.м.
m (Mg) = 24,312 • 1,66057 • 10 -24 = 4,037 •10 -23 г
Относительная молекулярная масса (Mr) — безразмерная величина, показывающая, во сколько раз масса молекулы данного вещества больше 1 /12 массы атома углерода 12 C.
mr — масса молекулы данного вещества;
mа( 12 C) — масса атома углерода 12 C.
Относительная молекулярная масса вещества равна сумме относительных атомных масс всех элементов с учетом индексов.
Mг(KAl(SO4)2) = 1 • Ar(K) + 1 • Ar(Al) + 1 • 2 • Ar(S) + 2 • 4 • Ar(O) =
= 1 • 39 + 1 • 27 + 1 • 2 • 32 + 2 • 4 •16 = 258
Абсолютная масса молекулы равна относительной молекулярной массе, умноженной на а.е.м.
Число атомов и молекул в обычных образцах веществ очень велико, поэтому при характеристике количества вещества используют специальную единицу измерения — моль.
Количество вещества, моль. Означает определенное число структурных элементов (молекул, атомов, ионов). Обозначается n, измеряется в моль. Моль — количество вещества, содержащее столько же частиц, сколько содержится атомов в 12 г углерода.
Число Авогадро (NA). Количество частиц в 1 моль любого вещества одно и то же и равно 6,02 • 10 23 . (Постоянная Авогадро имеет размерность — моль -1 ).
Молярная масса показывает массу 1 моля вещества (обозначается M).
Теперь определим формулу, которая очень часто используется в химии для определения количества вещества:
Молярная масса вещества равна отношению массы вещества к соответствующему количеству вещества.
Молярная масса вещества численно равна его относительной молекулярной массе, однако первая величина имеет размерность г/моль, а вторая — безразмерная.
Вторая формула определения количества вещества в зависимости от количества атомов или молекул, содержащееся в веществе
Закон сохранения массы веществ
Масса всех веществ, вступивших в химическую реакцию, равна массе всех продуктов реакции.
Атомно-молекулярное учение этот закон объясняет следующим образом: в результате химических реакций атомы не исчезают и не возникают, а происходит их перегруппировка (т.е. химическое превращение- это процесс разрыва одних связей между атомами и образование других, в результате чего из молекул исходных веществ получаются молекулы продуктов реакции). Поскольку число атомов до и после реакции остается неизменным, то их общая масса также изменяться не должна. Под массой понимали величину, характеризующую количество материи.
Исходя из закона сохранения массы, можно составлять уравнения химических реакций и по ним производить расчеты. Он является основой количественного химического анализа.
Составление химических уравнений
- Запись формул веществ, вступивших в реакцию (слева) и продуктов реакции (справа), соединив их по смыслу знаками «+» и «=» :
2. Подбор коэффициентов для каждого вещества так, чтобы количество атомов каждого элемента в левой и правой части уравнения было одинаково:
3. Проверка числа атомов каждого элемента в левой и правой частях уравнения.
Расчеты по химическим уравнениям
Расчеты по химическим уравнениям (стехиометрические расчеты) основаны на законе сохранения массы веществ. В реальных химических процессах из-за неполного протекания реакций и потерь масса продуктов обычно меньше теоретически рассчитанной. Выходом реакции (h) называют отношение реальной массы продукта (mp) к теоретически возможной (mт), выраженное в долях единицы или в процентах.
Если в условиях задач выход продуктов реакции не указан, его в расчетах принимают за 100% (количественный выход).
Сколько г меди образуется при восстановлении 8 г оксида меди водородом, если выход реакции составил 82%?
Решение
- Рассчитаем теоретический выход меди по уравнению реакции: 80 г (1 моль) CuO при восстановлении может образовать 64 г (1 моль) Cu; 8 г CuO при восстановлении может образовать Х г Cu
- Определим, сколько граммов меди образуется при 82% выходе продукта:
6,4 г –– 100% выход (теоретический)
Закон постоянства состава вещества
Впервые сформулировал Ж.Пруст (1808 г).
Все индивидуальные химические вещества имеют постоянный качественный и количественный состав и определенное химическое строение, независимо от способа получения.
Из закона постоянства состава следует, что при образовании сложного вещества элементы соединяются друг с другом в определенных массовых соотношениях.
Закон кратных отношений
Если два химических элемента дают несколько соединений, то весовые доли одного и того же элемента в этих соединениях, приходящиеся на одну и ту же весовую долю второго элемента, относятся между собой как небольшие целые числа.
Число атомов кислорода в молекулах этих соединений, приходящиеся на два атома азота, относятся между собой как 1 : 3 : 4 : 5.
Закон объемных отношений
«Объемы газов, вступающих в химические реакции, и объемы газов, образующихся в результате реакции, относятся между собой как небольшие целые числа».
Следствие. Стехиометрические коэффициенты в уравнениях химических реакций для молекул газообразных веществ показывают, в каких объемных отношениях реагируют или получаются газообразные вещества.
Закон Авогадро
В равных объемах различных газов при одинаковых условиях (температура, давление и т.д.) содержится одинаковое число молекул.
Закон справедлив только для газообразных веществ.
- Одно и то же число молекул различных газов при одинаковых условиях занимает одинаковые объемы.
- При нормальных условиях (0°C = 273°К , 1 атм = 101,3 кПа) 1 моль любого газа занимает объем 22,4 л.
Какой объем водорода при н.у. выделится при взаимодействии 4,8 г магния с избытком соляной кислоты?
При растворении 24 г (1 моль) магния в HCl выделилось 22,4 л (1 моль) водорода; при растворении 4,8 г магния –– Х л водорода.
X = (4,8 • 22,4) / 24 = 4,48 л водорода
Объединенный газовый закон
Объединенный газовый закон — объединение трех независимых частных газовых законов: Гей-Люссака, Шарля, Бойля-Мариотта, уравнение, которое можно записать так:
И наоборот, из объединенного газового закона
при P = const (P1 = P2) можно получить
Уравнение Клапейрона-Менделеева
Если записать объединенный газовый закон для любой массы любого газа, то получается уравнение Клапейрона-Менделеева:
где m — масса газа; M — молекулярная масса; p — давление; V — объем; T — абсолютная температура (°К); R — универсальная газовая постоянная (8,314 Дж/(моль • К) или 0,082 л атм/(моль • К)).
Для данной массы конкретного газа отношение m / M постоянно, поэтому из уравнения Клапейрона-Менделеева получается объединенный газовый закон.
Какой объем займет при температуре 17°C и давлении 250 кПа оксид углерода (II) массой 84 г?
Задача решается подставлением всех данных в формулу.
Относительная плотность газов
Относительная плотность газов D показывает, во сколько раз 1 моль одного газа тяжелее (или легче) 1 моля другого газа.
Плотность некоторого газообразного вещества по водороду равна 17. Чему равна его плотность по воздуху (Мср.=29).
Источник