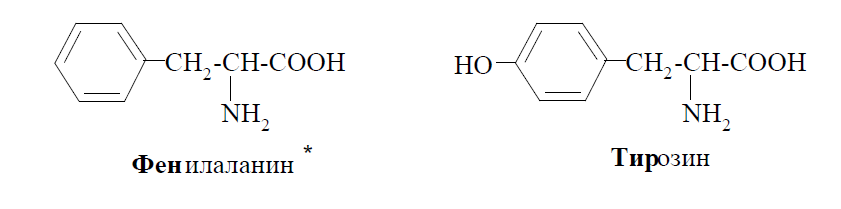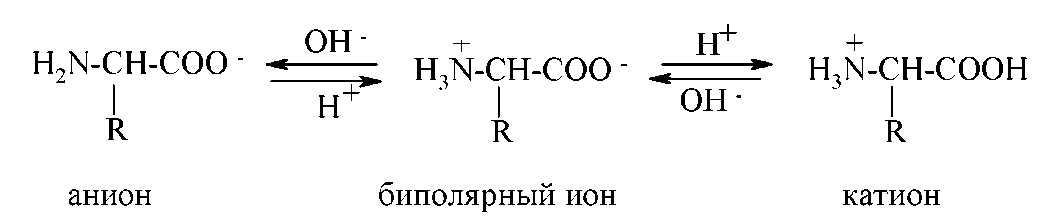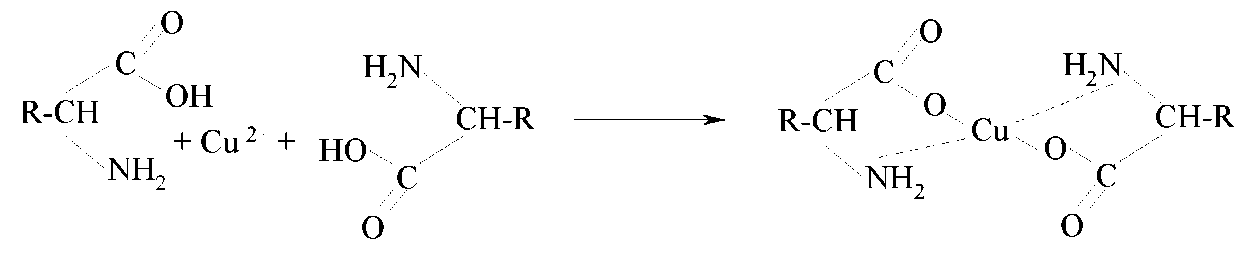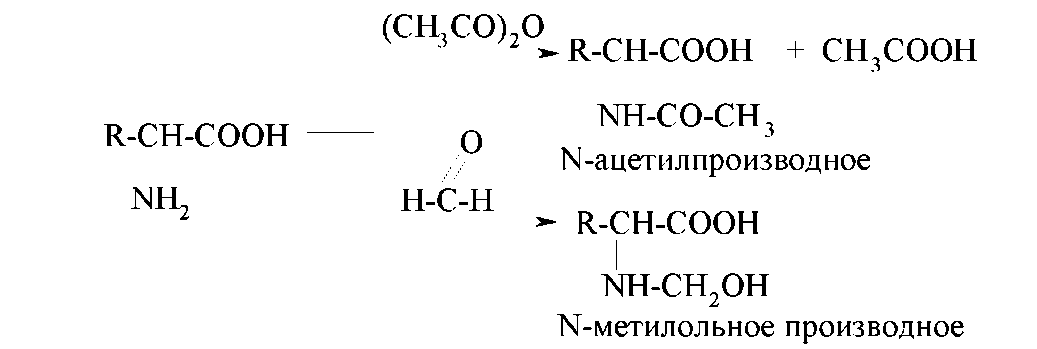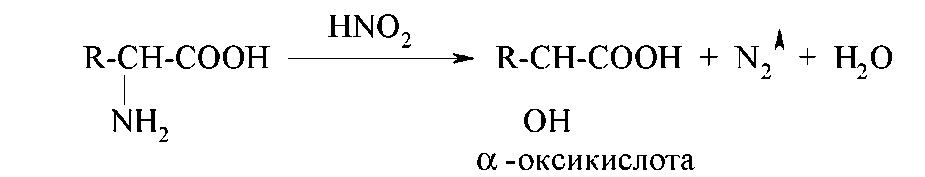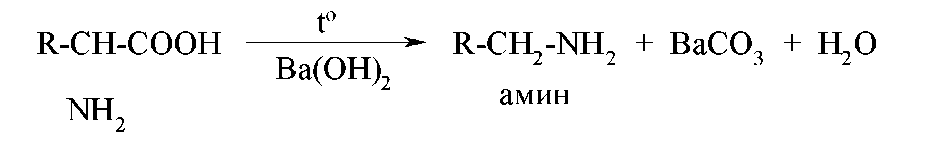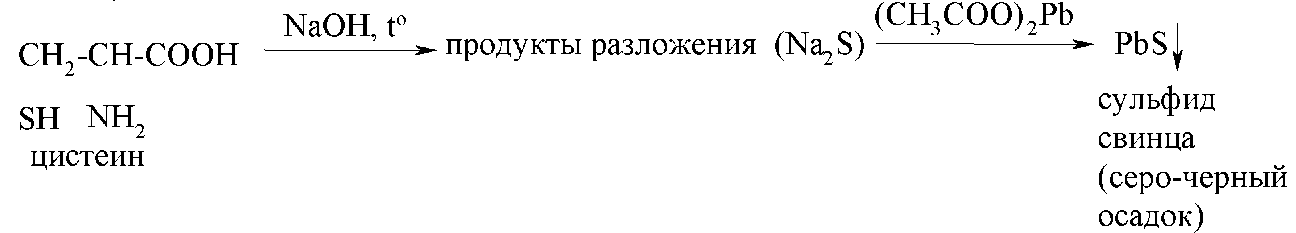7.1. Номенклатура, особенности пространственного и структурного строения природных аминокислот
Аминокислоты- большой класс органических соединений. характерным признаком которых является наличие в составе молекулы двух функциональных групп- карбоксильной и аминогруппы. Особую группу составляют природные аминокислоты. Их условно можно разделить на 2 группы:
— аминокислоты , которые участвуют в образовании пептидов и белков. Для них характерно только а- строение и все принадлежат к L – стереоряду.
— аминокислоты, которые обладают биологической активностью, но не являются мономерами природных полимеров белков и пептидов.
Природные а –L — аминокислоты – мономеры полипептидов и белков.
Обычно выделяют около 20 природных аминокислот , из которых образуется все множество природных белков растительного и животного происхождения.
Единый генетический код природы определяет единство аминокислотного состава белков.
Номенклатура природных аминокислот: применяются тривиальные названия.
Особенности строения и стереохимия.
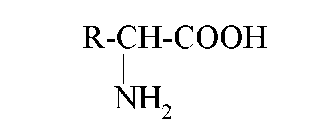
Природные аминокислоты относятся к L – стереоряду и имеют а- строение ( это означает, что обе функциональные группы- амино- и карбоксильная- связаны с общим атомом углерода, который всегда оптически активный ( за исключением глицина – аминоуксусной кислоты). Исследованию пространственного строения природных аминокислот посвящены фундаментальные работы Э.Фишера, П. Каррера.
R –C * H – COOH COOH NH2 — СН2— СООН
R L – стереоряд
Большинство природных аминокислот имеют только один асимметричный атом углерода, но две аминокислоты – треонин и изолейцин – содержат два хиральных центра.
Обе аминокислоты могут быть представлены двумя парами диастереомеров.( конечно, каждое соединение существует в виде 4 стереоизомеров, но конфигурация атома , связанного с амино- и карбоксильной группой может быть только L— ряда. Поэтому количество изомеров сводится к двум)
На рисунке представлены истинные абсолютные конфигурации этих аминокислот.
СН3 – * С Н — * С Н – СООН С 2Н5 – * С Н — * С Н- СООН
L— треонин L — изолейцин
Источник
Лекция №2-4 природные α-аминокислоты. Строение классификация стереоизомерия химические свойства
α-Аминокислоты являются мономерными единицами биополимеров — пептидов и белков. Белки — основа всего живого. Функции белков в природе многообразны. Это ферменты и гормоны, выполняющие регуляторную функцию, структурные белки (кератин, коллаген), транспортные (гемоглобин), защитные (иммуноглобулины). Некоторые аминокислоты используются как лекарственные средства, например, глутаминовая кислота — при заболеваниях ЦНС, метионин — для лечения заболеваний печени, цистеин — как радиопротектор, а также в глазной практике.
В природе в свободном и связанном виде обнаружены сотни аминокислот, 20-25 из них постоянно встречаются во всех белках.
Строение и классификация природных α-аминокислот
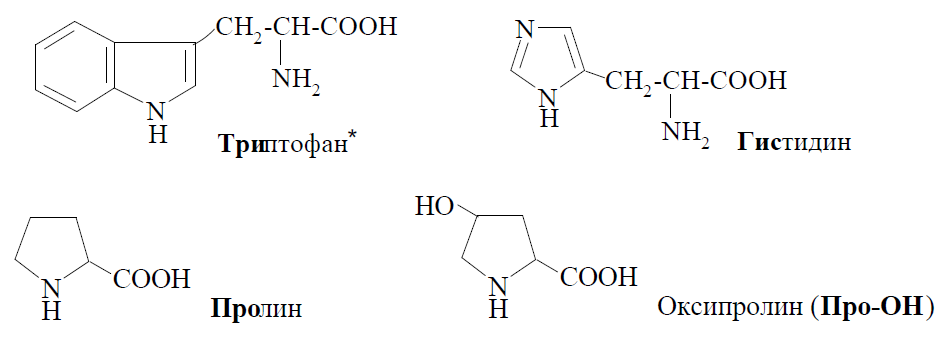
Общая формула α-аминокислот (исключение — пролин и оксипролин):
В основном используют тривиальные названия α- аминокислот. В биохимии часто пользуются сокращенными трехбуквенными названиями.
Согласно общей формуле, аминокислоты отличаются лишь строением радикала, в соответствии с чем они классифицируются на алифатические, ароматические и гетероциклические. Среди алифатических аминокислот в зависимости от наличия в радикале функциональной группы выделяют подгруппы гидрокси- и серосодержащих аминокислот.
Примеры алифатических аминокислот:
Примерами ароматических аминокислот являются фенилаланин и тирозин:
К гетероциклическим аминокислотам относятся:
В зависимости от соотношения количества карбоксильных и аминогрупп в молекулах различают нейтральные (моноаминомонокарбоновые) — глицин, аланин и др., кислые (моноаминодикарбоновые) — аспарагиновая, глютаминовая кислоты, основные (диаминомонокарбоновые) аминокислоты — лизин, орнитин, аргинин.
Природа радикала в молекулах аминокислот значительно влияет на свойства белков. Например, наличие полярных групп (-SH, NH2, -OH, COOH, фенольного гидроксила) увеличивает растворимость белков. Кроме того, эти группы принимают участие в образовании связей, формирующих пространственную структуру белка. За счет карбоксильной и аминогруппы многие ферменты обеспечивают кислотный или основный катализ ряда биохимических процессов. Большинство α-аминокислот синтезируется в организме, но некоторые организм не способен синтезировать, они должны поступать с пищей. Эти аминокислоты называют незаменимыми, в норме их восемь: валин, лейцин, изолейцин, треонин, метионин, фенилаланин, триптофан, лизин.
Стереоизомерия α-аминокислот
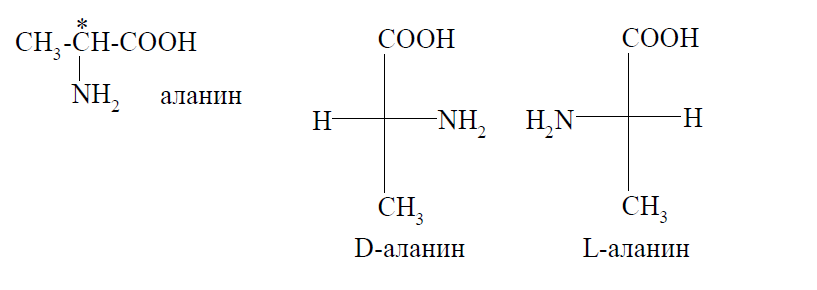
Все α-аминокислоты, за исключением глицина, имеют в своей структуре хотя бы один хиральный центр, значит, для них характерна оптическая изомерия. Например, аланин существует в виде пары энантиомеров:
Относительная конфигурация стереоизомеров определяется в сравнении с конфигурационным стандартом — стереоизомерами глицеринового альдегида.
Все α-аминокислоты, участвующие в построении молекул белков животных и человека, имеют L-конфигурацию. D-аминокислоты встречаются в некоторых грибах и микроорганизмах.
α-Аминокислоты представляют собой кристаллические вещества с высокой температурой плавления, растворимые в воде, но не растворимые в неполярных растворителях. Эти свойства результат того, что и в кристаллическом состоянии, и в водных растворах аминокислоты существуют в виде биполярных ионов (цвиттер-ионов). Возможность образования биполярных ионов связана с амфотерностью аминокислот, в молекулах которых присутствуют и кислотные COOH-группы, и основные NH2-группы. Близость этих групп у α-аминокислот облегчает переход протона от карбокисльонй группы.
Практически α-аминокислоты в водном растворе существуют в виде равновесной смеси из цвиттер-ионов, катионной и анионной форм:
Положение такого равновесия существенно зависит от pH среды: в сильнокислой среде (pH=1-2) преобладает катионная форма, в сильнощелочной (pH=13-14) — анионная.
Если поместить раствор аминокислоты в электрическое поле, то в кислых растворах она будет мигрировать к катоду, а в щелочных — к аноду. При некотором значении pH, характерном для данной аминокислоты, она не будет перемещаться в электрическом поле. При этом значении pH, называемом изоэлектрической точкой (ИЭТ, pI), аминокислота существует в виде биполярного иона и в целом электронейтральна. Итак, изоэлектрическая точка аминокислоты — это то значение pH раствора, при котором большинство молекул данной аминокислоты существуют в виде биполярных ионов, а концентрации анионной и катионной форм минимальны и равны. Изоэлектрическая точка зависит от соотношения кислотных и основных групп в молекуле: pI кислых аминокислот имеет значение 7.
При пропускании электрического тока через раствор, содержащий смесь аминокислот, каждая из них будет двигаться к катоду или аноду со скоростью, зависящей от природы аминокислоты и pH среды. Это явление используют для разделения и анализа смеси аминокислот методом электрофореза.
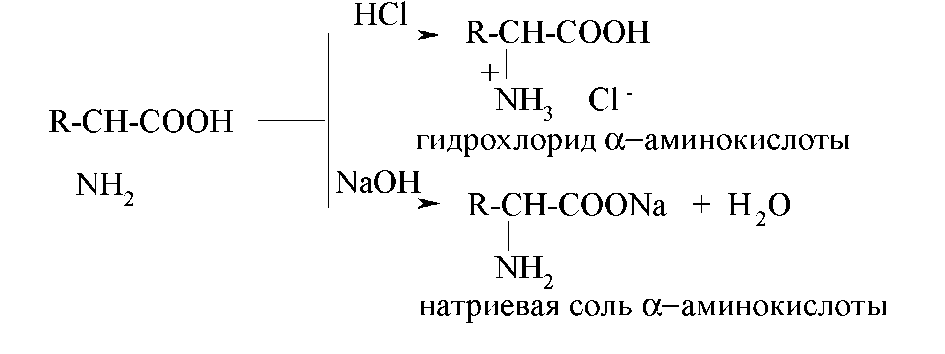
Химические свойства Являясь амфотерными соединениями, аминокислоты реагируют и с кислотами, и с щелочами:
Характерной особенностью α-аминокислот является способность образовывать комплексные соли с ионами тяжелых металлов:
Медные соли аминокислот нерастворимы в воде, имеют интенсивное синее окрашивание. Эта реакция используется для обнаружения α-аминокислот.
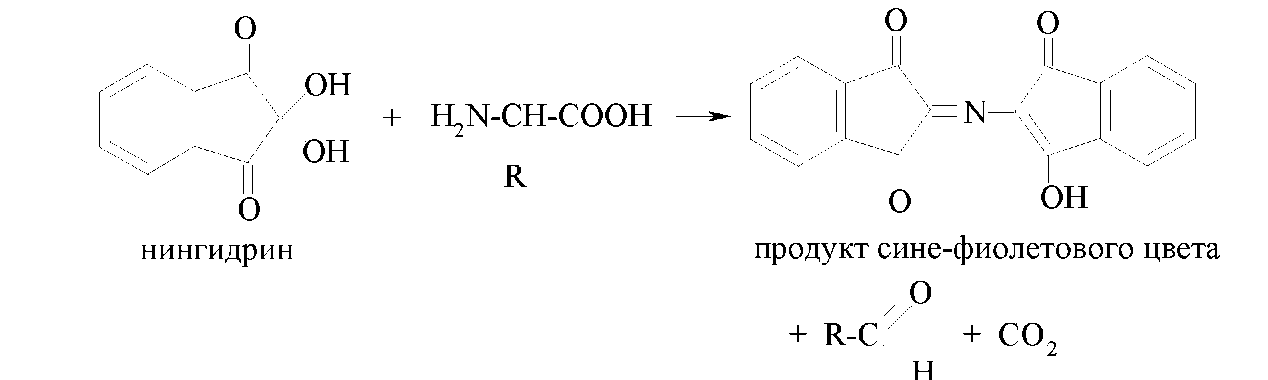
Другой общей качественной реакцией α-аминокислот является их взаимодействие с нингидрином с образованием продукта сине-фиолетового цвета:
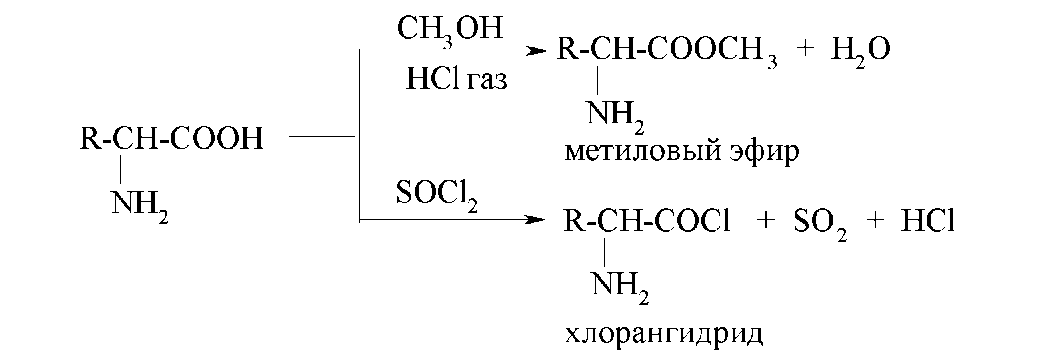
Как карбоновые кислоты, α-аминокислоты образуют сложные эфиры при взаимодействии со спиртами и хлорангидриды при взаимодействии с тионилхлоридом или хлоридами фосфора:
Сложные эфиры α-аминокислот летучи, они имеют сравнительно низкие температуры кипения. Это их свойство используется для разделения смеси аминокислот в белковых гидролизатах (эфирный метод Фишера). С этой целью аминокислоты сначала этерифицируют, а потом подвергают перегонке.
За счет аминогруппы α-аминокислоты подвергаются реакциям ацилирования и алкилирования, взаимодействуют с оксо- соединениями. Так, при ацилировании аминокислоты уксусным ангидридом образуется N-ацетильное производное. При взаимодействии с формальдегидом образуется продукт нуклеофильного присоединения — N-метилольное производное, которое достаточно устойчиво (с другими оксосоединениями протекает реакция нуклеофильного присоединения-отщепления).
Реакцию ацилирования раньше использовали для защиты аминогруппы в синтезе пептидов. Реакция с формальдегидом лежит в основе метода количественного анализа аминокислот (метод формольного титрования, метод Зеренсена). Сущность метода формольного титрования заключается в следующем: до взаимодействия с формальдегидом растворы большинства аминокислот имеют реакцию, близкую к нейтральной; N-метилольное производное проявляет кислотные свойства и может быть оттитровано раствором щелочи с известной концентрацией.
Как первичные алифатические амины α-аминокислоты подвергаются действию азотистой кислоты с образованием соответствующих α-оксикислот и выделением азота:
Эту реакцию называют реакцией дезаминирования in vitro. Ее используют и как качественную реакцию для доказательства наличия первичной алифатической аминогруппы (наблюдают выделение пузырьков газа), и для количественного анализа (метод Ван-Слайка) — по объему выделившегося азота рассчитывают количество аминокислоты, вступившей в реакцию.
Специфическим свойством α-аминокислот является их способность к декарбоксилированию при нагревании в присутствии гидроксида бария:
Рассмотренные выше реакции характерны для всех α- аминокислот.
Существуют также реакции на определенные группы аминокислот.
Серосодержащие аминокислоты (цистеин цистин, метионин) обнаруживают по реакции с ацетатом свинца (реакция Фоля).
При нагревании с щелочью серосодержащие аминокислоты разлагаются, одним из продуктов разложения является сульфид натрия. При дальнейшем добавлении ацетата свинца образуется осадок сульфида свинца серо-черного цвета.
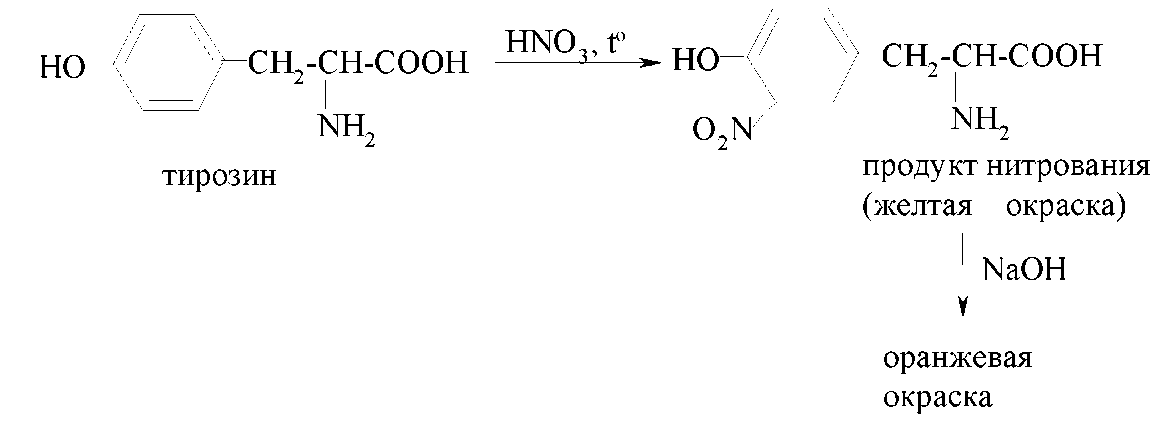
Для обнаружения ароматических аминокислот используют так называемую ксантопротеиновую реакцию. При нагревании этих аминокислот (или белков, в структуре которых присутствуют их остатки) с концентрированной азотной кислотой образуются продукты нитрования желтого цвета, которые в щелочной среде приобретают оранжевую окраску:
Источник
7.1. Номенклатура, особенности пространственного и структурного строения природных аминокислот
Аминокислоты- большой класс органических соединений. характерным признаком которых является наличие в составе молекулы двух функциональных групп- карбоксильной и аминогруппы. Особую группу составляют природные аминокислоты. Их условно можно разделить на 2 группы:
— аминокислоты , которые участвуют в образовании пептидов и белков. Для них характерно только а-строение и все принадлежат кL– стереоряду.
— аминокислоты, которые обладают биологической активностью, но не являются мономерами природных полимеров белков и пептидов.
Природные а–L— аминокислоты – мономеры полипептидов и белков.
Обычно выделяют около 20 природных аминокислот , из которых образуется все множество природных белков растительного и животного происхождения.
Единый генетический код природы определяет единство аминокислотного состава белков.
Номенклатура природных аминокислот: применяются тривиальные названия.
Особенности строения и стереохимия.
Природные аминокислоты относятся к L– стереоряду и имеюта-строение ( это означает, что обе функциональные группы- амино- и карбоксильная- связаны с общим атомом углерода, который всегда оптически активный ( за исключением глицина – аминоуксусной кислоты). Исследованию пространственного строения природных аминокислот посвящены фундаментальные работы Э.Фишера, П. Каррера.
R –C * H – COOH COOH NH2 — СН2— СООН
Большинство природных аминокислот имеют только один асимметричный атом углерода, но две аминокислоты – треонин и изолейцин – содержат два хиральных центра.
Обе аминокислоты могут быть представлены двумя парами диастереомеров.( конечно, каждое соединение существует в виде 4 стереоизомеров, но конфигурация атома , связанного с амино- и карбоксильной группой может быть только L— ряда. Поэтому количество изомеров сводится к двум)
На рисунке представлены истинные абсолютные конфигурации этих аминокислот.
СН3– * С Н — * С Н – СООН С2Н5– * С Н — * С Н- СООН
L— треонин L — изолейцин
Источник