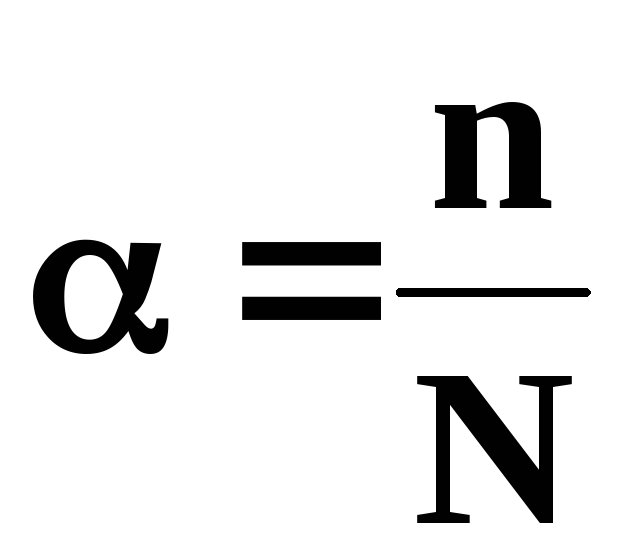- Лекция № 11. Теория электролитической диссоциации
- Теория электролитической диссоциации
- ГДЗ рабочая тетрадь по химии 8 класс Габриелян. Основные положения теории электролитической диссоциации (ТЭД). Часть 1. Номер №3
- ГДЗ рабочая тетрадь по химии 8 класс Габриелян. Основные положения теории электролитической диссоциации (ТЭД). Часть 1. Номер №3
- Решение
- От природы электролита например
Лекция № 11. Теория электролитической диссоциации
Электролитами называются вещества, растворы которых обладают электрической проводимостью. К электролитам относятся растворы кислот, солей и щелочей. Соли и щелочи проводят электрический ток не только в растворах, но и в расплавах. Неэлектролитами называются вещества, растворы которых не обладают электрической проводимостью. К неэлектролитам относятся многие органические вещества, сухие соли и основания, дистиллированная вода.
Теория электролитической диссоциации
В 1887 г. шведский ученый Сванте Аррениус выдвинул теорию электролитической диссоциации. Электролитической диссоциацией называется процесс распада электролита на сольватированные ионы под действием молекул растворителя. Теория Аррениуса заключалась в следующем:
1. При растворении в воде (или расплавлении) электролиты распадаются на положительно (катионы) и отрицательно (анионы) заряженные ионы (т.е. подвергаются электролитической диссоциации).
2. Под действием электрического тока катионы двигаются к отрицательно заряженному электроду (катоду), а анионы – к положительно заряженному электроду (аноду).
3. Электролитическая диссоциация – процесс обратимый (обратная реакция называется моляризацией).
Механизм электролитической диссоциации ионных веществ
При растворении соединений с ионными связями (например, NaCl) процесс гидратации начинается с ориентации диполей воды вокруг всех выступов и граней кристаллов соли. Ориентируясь вокруг ионов кристаллической решетки, молекулы воды образуют с ними либо водородные, либо донорно-акцепторные связи. При этом процессе выделяется большое количество энергии, которая называется энергией гидратации. Энергия гидратации, величина которой сравнима с энергией кристаллической решетки, идет на разрушение кристаллической решетки. При этом гидратированные ионы слой за слоем переходят в растворитель и, перемешиваясь с его молекулами, образуют раствор.
Механизм электролитической диссоциации полярных веществ
Аналогично диссоциируют и вещества, молекулы которых образованы по типу полярной ковалентной связи (полярные молекулы). Вокруг каждой полярной молекулы вещества (например, HCl), определенным образом ориентируются диполи воды. В результате взаимодействия с диполями воды полярная молекула еще больше поляризуется и превращается в ионную, далее уже легко образуются свободные гидратированные ионы.
Процесс электролитической диссоциации принято записывать в виде схемы, не раскрывая его механизма и опуская растворитель (H2O), хотя он является основным участником:
Из электронейтральности молекул следует вывод, что суммарный заряд катионов и анионов должен быть равен нулю. Например, Al2(SO4)3: 2·(+3) + 3·(-2) = +6 – 6 = 0.
Количественной характеристикой процесса диссоциации электролита является степень диссоциации. Степень электролитической диссоциации (α) зависит от природы электролита и растворителя, температуры и концентрации. Она показывает отношение числа молекул, распавшихся на ионы (n) к общему числу молекул, введенных в раствор (N) и выражается в долях единицы или в %:
0
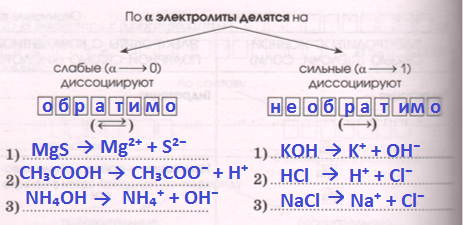
По величине степени диссоциации все электролиты делятся на сильные и слабые. Сильные электролиты – это вещества, которые при растворении в воде практически полностью распадаются на ионы. Как правило, к сильным электролитам относятся вещества с ионными или сильно полярными связями: все хорошо растворимые соли, сильные кислоты (HCl, HBr, HI, HClO4, H2SO4, HMnO4, HNO3) и сильные основания (LiOH, NaOH, KOH, RbOH, CsOH, Ba(OH)2, Sr(OH)2, Ca(OH)2). В растворе сильного электролита растворённое вещество находится в основном в виде ионов (катионов и анионов); недиссоциированные молекулы практически отсутствуют. Степень диссоциации сильных электролитов α>30%.
Слабые электролиты – это вещества, частично диссоциирующие на ионы. Растворы слабых электролитов наряду с ионами содержат недиссоциированные молекулы. Степень диссоциации α3COOH, C2H5COOH и др.); некоторые неорганические кислоты (H2CO3, H2SO3, H2SiO3, HCN, HNO2, H3PO4, HF, H2S и др.); почти все малорастворимые в воде соли, основания и гидроксид аммония (Ca3(PO4)2; Cu(OH)2; Al(OH)3; NH4OH); вода. Они плохо (или почти не проводят) электрический ток.
Источник
ГДЗ рабочая тетрадь по химии 8 класс Габриелян. Основные положения теории электролитической диссоциации (ТЭД). Часть 1. Номер №3
Основные положения ТЭД.
1 ) По способности проводить электрический ток в растворах 
2 ) В растворах электролиты _ _ _ _ _ _ _ _ _ _ _ _ на _ _ _ _, т.е . _ _ _ _ _ _ _ _ _ _ _ _. Ионы различают: 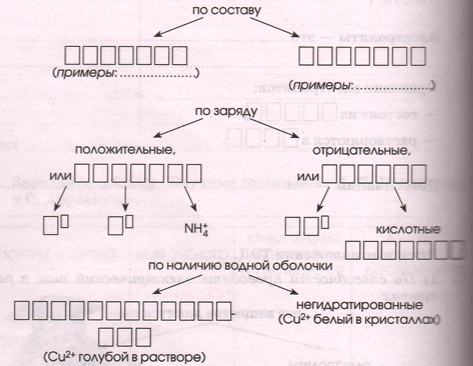
Механизмы диссоциации электролитов с разным типом химической связи
| Электролиты с ионной связью (щелочи, соли) | Электролиты с ковалентной полярной связью (кислоты) |
|---|---|
| Ориентация молекул воды вокруг противоположно заряженнных ионов электролита | Ориентация _ |
| Гидратация − _ | Гидратация − _ |
| Ионизация − превращение ковалентной полярной связи в ионную | |
| Диссоциация − _ | Диссоциация − _ |
3 ) Разные электролиты по−разному диссоциируют на ионы, что характеризует степень электрической диссоциации − _ : 
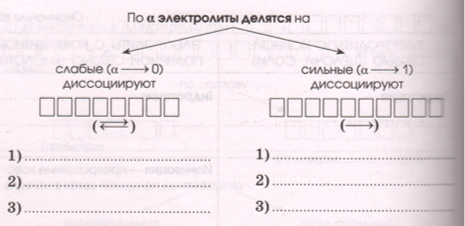
α зависит:
− от природы электролита, например : _
− от разбавления (как ?) _
4 ) Как электролиты, все вещества делятся на три класса.
а) Кислоты − это электролиты, которые диссоциируют на _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ и _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _ _.
Например: $HNO_$ = _ _ + _ _ _ _ ; $H_SO_$ = _ _ _ + _ _ _ _ _
б) Основания − _
Например: KOH = _ _ + _ _ _ ;
$Ba(OH)_ $ = _ _ _ _ + _ _ _ _ .
в) Соли − _
Например: $Fe(NO_)_ $ = _ _ _ _ + _ _ _ _ _ ;
$AlCl_$ = _ _ _ _ + _ _ _ _.
ГДЗ рабочая тетрадь по химии 8 класс Габриелян. Основные положения теории электролитической диссоциации (ТЭД). Часть 1. Номер №3
Решение
Основные положения ТЭД.
1 ) По способности проводить электрический ток в растворах 
2 ) В растворах электролиты распадаются на ионы, т.е. диссоциируют. Ионы различают: 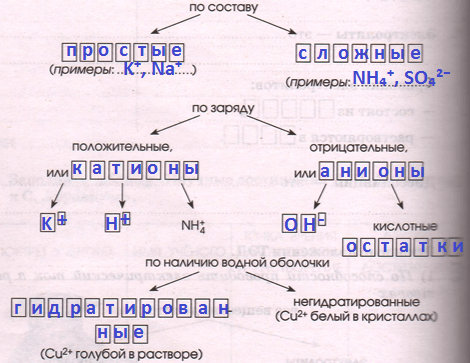
Механизмы диссоциации электролитов с разным типом химической связи
| Электролиты с ионной связью (щелочи, соли) | Электролиты с ковалентной полярной связью (кислоты) |
|---|---|
| Ориентация молекул воды вокруг противоположно заряженнных ионов электролита | Ориентация молекул воды вокруг электроотрицательного и электроположительного концов молекулы электролита. |
| Гидратация − взаимодействие молекул воды с противоположно заряженными ионами поверхностного слоя элекролита. | Гидратация − взаимодействие молекул воды с молекулами элекролита. |
| Ионизация − превращение ковалентной полярной связи в ионную | |
| Диссоциация − распад на катионы металла или аммония и на гидроксид−анионы или анионы кислотного остатка. | Диссоциация − распад на катионы водорода и анионы кислотного остатка |
3 ) Разные электролиты по−разному диссоциируют на ионы, что характеризует степень электрической диссоциации − _ : 
α зависит:
− от природы электролита, например: нерастворимые основания практически не диссоциируют
− от разбавления (как?): степень диссоциации растет по мере разбавления раствора
4 ) Как электролиты, все вещества делятся на три класса.
а) Кислоты − это электролиты, которые диссоциируют на катионы водорода и анионы кислотного остатка.
Например: $HNO_$ = $H^ + NO_^$ ; $H_SO_$ = $H^ + SO_^$
б) Основания − это электролиты, которые диссоциируют на катионы металла и гидроксид−анионы.
Например: KOH = $K^ + OH^$ ;
$Ba(OH)_ $ = $Ba^ + 2OH^$ .
в) Соли − это электролиты, которые диссоциируют на катионы металла и анионы кислотного остатка.
Например: $Fe(NO_)_$ = $Fe^ + 3NO_^$ ;
$AlCl_$ = $Al^ + 3Cl^$ .
Источник
От природы электролита например
1.1. Электролитическая диссоциация. Степень диссоциации. Сила электролитов
Согласно теории электролитической диссоциации, соли, кислоты, гидроксиды, растворяясь в воде, полностью или частично распадаются на самостоятельные частицы – ионы.
Процесс распада молекул веществ на ионы под действием полярных молекул растворителя называют электролитической диссоциацией. Вещества, диссоциирующие на ионы в растворах, называют электролитами. В результате раствор приобретает способность проводить электрический ток, т.к. в нем появляются подвижные носители электрического заряда. Согласно этой теории, при растворении в воде электролиты распадаются (диссоциируют) на положительно и отрицательно заряженные ионы. Положительно заряженные ионы называют катионами; к ним относятся, например, ионы водорода и металлов. Отрицательно заряженные ионы называются анионами; к ним принадлежат ионы кислотных остатков и гидроксид-ионы.
Для количественной характеристики процесса диссоциации введено понятие степени диссоциации. Степенью диссоциации электролита (α) называется отношение числа его молекул, распавшихся в данном растворе на ионы ( n ), к общему числу его молекул в растворе ( N ), или
Степень электролитической диссоциации принято выражать либо в долях единицы, либо в процентах.
Электролиты со степенью диссоциации больше 0,3 (30%) обычно называют сильными, со степенью диссоциации от 0,03 (3%) до 0,3 (30%)—средними, менее 0,03 (3%)—слабыми электролитами. Так, для 0,1 M раствора CH 3 COOH α = 0,013 (или 1,3 %). Следовательно, уксусная кислота является слабым электролитом. Степень диссоциации показывает, какая часть растворенных молекул вещества распалась на ионы. Степень электролитической диссоциации электролита в водных растворах зависит от природы электролита, его концентрации и температуры.
По своей природе электролиты можно условно разделить на две большие группы: сильные и слабые. Сильные электролиты диссоциируют практически полностью (α = 1).
К сильным электролитам относятся:
1) кислоты ( H 2 SO 4 , HCl , HNO 3 , HBr , HI , HClO 4 , H М nO 4 );
2) основания – гидроксиды металлов первой группы главной подгруппы (щелочи) – LiOH , NaOH , KOH , RbOH , CsOH , а также гидроксиды щелочноземельных металлов – Ba ( OH )2 , Ca ( OH )2, Sr ( OH )2;.
3) соли, растворимые в воде (см. таблицу растворимости).
Слабые электролиты диссоциируют на ионы в очень малой степени, в растворах они находятся, в основном в недиссоциированном состоянии (в молекулярной форме). Для слабых электролитов устанавливается равновесие между недиссоциированными молекулами и ионами.
К слабым электролитам относятся:
1) неорганические кислоты ( H 2 CO 3 , H 2 S , HNO 2 , H 2 SO 3 , HCN , H 3 PO 4 , H 2 SiO 3 , HCNS , HСlO и др.);
3) гидроксид аммония ( NH 4 OH );
4) большинство органических кислот
(например, уксусная CH3COOH, муравьиная HCOOH);
5) нерастворимые и малорастворимые соли и гидроксиды некоторых металлов (см. таблицу растворимости).
Процесс электролитической диссоциации изображают, пользуясь химическими уравнениями. Например, диссоциация соляной кислоты (НС l ) записывается следующим образом:
Основания диссоциируют с образованием катионов металла и гидроксид-ионов. Например, диссоциация КОН
Многоосновные кислоты, а также основания многовалентных металлов диссоциируют ступенчато. Например,
Первое равновесие – диссоциация по первой ступени – характеризуется константой
Для диссоциации по второй ступени:
В случае угольной кислоты константы диссоциации имеют следующие значения: KI = 4,3 × 10 –7 , KII = 5,6 × 10 –11 . Для ступенчатой диссоциации всегда KI>KII>KIII> . , т.к. энергия, которую необходимо затратить для отрыва иона, минимальна при отрыве его от нейтральной молекулы.
Средние (нормальные) соли, растворимые в воде, диссоциируют с образованием положительно заряженных ионов металла и отрицательно заряженных ионов кислотного остатка
Кислые соли (гидросоли) – электролиты, содержащие в анионе водород, способный отщепляться в виде иона водорода Н + . Кислые соли рассматривают как продукт, получающийся из многоосновных кислот, в которых не все атомы водорода замещены на металл. Диссоциация кислых солей происходит по ступеням, например:
KHCO 3 → K + + HCO 3 – (первая ступень)
HCO 3 – H + + CO 3 2– (вторая ступень).
Однако степень электролитической диссоциации по второй ступени очень мала, поэтому раствор кислой соли содержит лишь незначительное число ионов водорода.
Основные соли (гидроксосоли) – электролиты, содержащие в катионе одну или несколько гидроксо-групп OH – . Основные соли характерны для многовалентных металлов. Основные соли диссоциируют с образованием основных и кислотных остатков. Например:
FeOHCl 2 FeOH 2+ + 2 Cl – (первая ступень);
FeOH 2+ Fe 3+ + OH – (вторая ступень);
( ZnOH )2 SO 4 2 ZnOH + + SO 4 2– (первая ступень);
ZnOH + Zn 2+ + OH – (вторая ступень).
© О.А. Нaпилкoва, Н.С. Дoзорцевa
Источник