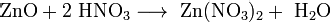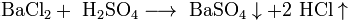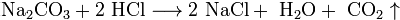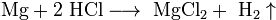Майер Юлиус Роберт
Майер Юлиус Роберт (25.02.1814-20.03.1878) — немецкий врач., Одним из первых открыл фундаментальный закон природы — закон сохранения и превращения энергии. Родился в Хейльбронне. Окончил Тюбингенский университет (1838), получив степень доктора медицины. В 1839 работал в клиниках в Париже. В 1840—41 как корабельный врач принимал участие в плавании на о. Яву. Во время плавания заметил, что цвет венозной крови матросов в тропиках значительно светлее, чем в северных широтах. Это изменение цвета венозной крови привело его к мысли, что существует связь между потреблением вещества и образованием тепла. Установил также, что количество окисляемых продуктов в организме человека возрастает с увеличением выполняемой им работы. Все это дало Майеру основание в 1840 допустить, что теплота и механическая работа способны взаимопревращаться. Результаты своих исследований он изложил в работах «О количественном и качественном определении сил» (1841, опубликована в 1881) и «Замечания относительно сил неживой природы» (1841, опубликована в 1842). В этих работах Майер впервые сформулировал закон сохранения энергии, подробнее — в работе «Органическое движение в его связи с обменом веществ» (1845), а также теоретически вычислил механический эквивалент теплоты. Однако выдающееся открытие Майера не имело признания, его работа (1845), которую он издал на собственные средства отдельной брошюрой, длительное время оставалась почти неизвестной. Первооткрывателем закона стали называть Дж. Джоуля, а затем и Г. Гельмгольца. Попытки Майера защитить свой приоритет в открытии закона сохранения и превращения энергии повлекли за собой нападки на него и травлю со стороны местных ученых. Это отрицательно отразилось на его психическом -состоянии и привело к тяжелому нервному расстройству, сделало невозможной активную научную деятельность. Лишь в 50-х — 60-х годах приоритет Майера в открытии закона сохранения энергии был признан. Майер также первый высказал мысль, что излучение Солнца приводит к уменьшению его массы.
Источник
1)Периодический закон — фундаментальный закон природы, открытый д. И. Менделеевым в 1869 году при сопоставлении свойств известных в то время химических элементов и величин их атомных масс.
Периоди́ческая систе́ма хими́ческих элеме́нтов (табли́ца Менделе́ева) — классификация химических элементов, устанавливающая зависимость различных свойств элементов от заряда атомного ядра. Система является графическим выражением периодического закона, установленного русским химиком Д. И. Менделеевым в 1869 году.
При l=0, т.е. на s-подуровне *, имеется всего одна орбиталь *, которую принято изображать в виде клетки. В атоме Н единственный электрон находится на самом низком из возможных энергетических состояний, т.е. на s-подуровне первого электронного слоя (на 1s-подуровне). Электронную структуру атома Н можно представить схемой:
В атоме гелия, порядковый номер которого в периодической системе * (или заряд ядра Z) равен 2, второй электрон тоже находится в состоянии 1s. Электронная структура атома гелия:
У этого атома завершается заполнение ближайшего к ядру K-слоя и тем самым завершается построение первого периода системы элементов.
Рассмотренные для атомов H и He способы описания электронных оболочек называются электронно-графическими формулами (орбитали изображаются в виде клеток) и электронными формулами (подуровни обозначаются буквами, а количество электронов на них указано верхним индексом).
У следующего за гелием элемента лития (Z=3) третий электрон уже не может разместиться на орбитали K-слоя: это противоречило бы принципу Паули *. Поэтому он занимает s-состояние второго энергетического уровня (L-слой, n=2). Его электронная структура записывается формулой 1s22s1, что соответствует схеме:
2)Периодическая система Менделеева является естественной классификацией хим.элементов по электронной структуре их атомов. Об электронной структуре атома, а значит, и свойствах элемента судят по положению элемента в соответствующем периоде и подгруппе пер системы. Закономерностями заполнения эл.уровней объясняется различное число элементов в периодах. Строгая периодичность расположения элементов в пер системе хим.элементов Менделеева полностью объясняется последовательным характером заполнения энергетических уровней.
3)Вале́нтность (от лат. valēns «имеющий силу») — способность атомов химических элементов образовывать определённое число химических связей с атомами других элементов.
Сте́пень окисле́ния (окислительное число, формальный заряд) — вспомогательная условная величина для записи процессов окисления, восстановления и окислительно-восстановительных реакций, численная величина электрического заряда, приписываемого атому в молекуле в предположении, что электронные пары, осуществляющие связь, полностью смещены в сторону более электроотрицательных атомов.
Представления о степени окисления положены в основу классификации и номенклатуры неорганических соединений.
Елементи Нітроген і Фосфор розташовані в V групі Періодичної системи, Нітроген у 2-му періоді, Фосфор — у 3-му.
Електронна конфігурація атома Нітрогену:
Валентність Нітрогену: III і IV, ступінь окиснення в сполуках: від –3 до +5.
Електронна конфігурація атома Фосфору:
Електронна конфігурація атома Фосфору в збудженому стані:
Валентність Фосфору: III і V, ступінь окиснення в сполуках: –3, 0, +3, +5.
Фізичні властивості азоту. Безбарвний газ без смаку й запаху, небагато легший за повітря г/моль, г/моль), погано розчинний у воді. Температура плавлення –210 °С, кипіння –196 °С.
Алотропні модифікації Фосфору. Серед простих речовин, що утворює елемент Фосфор, найбільш поширені білий, червоний і чорний фосфор.
Поширення Нітрогену в природі. Нітроген у природі зустрічається головним чином у вигляді молекулярного азоту . У повітрі об’ємна частка азоту складає 78,1 %, масова — 75,6 %. Сполуки Нітрогену в невеликих кількостях містяться в ґрунті. У складі органічних сполук (білки, нуклеїнові кислоти, АТФ) Нітроген міститься в живих організмах.
Поширення Фосфору в природі. Фосфор зустрічається в хімічно зв’язаному стані в складі мінералів: фосфоритів, апатитів, основна складова яких . Фосфор — життєво важливий елемент, входить до складу ліпідів, нуклеїнових кислот, АТФ, кальцій ортофосфату (у кістках і зубах).
5)Оксиген і Сульфур — елементи VI групи періодичної системи, входять до складу головної підгрупи.
Вони показують, що в атомах Оксигену і Сульфуру на зовнішньому електронному шарі міститься по 6 електронів (див. підкреслене в електронних формулах) —пs2пр4. В атомах Оксигену ці 6 зовнішніх електронів розміщуються на орбіталях двох типів —s і р (одна s- і три p-орбіталі):
За рахунок двох неспарених p-електронів атом Оксигену, як правило, утворює два ковалентні зв’язки. При цьому він проявляє ступінь окиснення -2, наприклад Н2О-2, Fe2O-23p, H2So4-2.
У сполуках з найбільш електронегативним елементом — Флуором Оксиген виявляє позитивний ступінь окиснення, наприклад у фториді оксигену O+2F2-1
Існують сполуки, що містять зв’язок Оксиген—Оксиген (О—О), наприклад пероксид гідрогену Н2+1O2-1 або пероксид барію Ва+2O2-1. Ступінь окиснення Оксигену в таких сполуках дорівнює, як вважається, -1.
На відміну від Оксигену, який міститься у другому періоді періодичної системи і електрони в його атомах розміщені на двох електронних шарах (а електрони другого шару—на s- і p-орбіталях), Сульфур міститься у третьому періоді. Це означає, що електрони в атомах Сульфуру розміщені на трьох електронних шарах, а електрони третього шару можуть розміщуватись на s-, р- і d-орбіталях (якщо атом перебуває у збудженому стані).
Отже, на відміну від атома Оксигену атом Сульфуру (ізольований, хімічно не зв’язаний) на зовнішньому електронному шарі має вільні орбіталі, на які можуть переходити електрони під час збудження атома, коли із затратою деякої енергії відбувається розпаровування електронних пар для утворення хімічних зв’язків з іншими атомами.
Таким чином, в атомі Сульфуру електрони на зовнішньому електронному шарі можуть розміщуватися так:
16S n=3 hjосновний стан атома
6)Будова зовнішнього електронного шару атома Карбону: 2s2 2р2,
Будова зовнішнього електронного шару атома Силіцію: 3s2 3р23d0,
Загальна характеристика Карбону і Силіцію: положення в періодичній системі, будова атомів
Карбон розташований в 2-му, Силіцій — у 4-му періоді Періодичної системи, обидва елементи розташовані в IV групі, отже, на зовнішньому енергетичному рівні їхніх атомів розташовано по 4 електрони.
Електронна конфігурація атома Карбону:
Характерні ступені окиснення Карбону в сполуках: -4, +2, +4.
Електронна конфігурація атома Силіцію:
Валентність Силіцію дорівнює II.
Характерна ступінь окиснення Силіцію в сполуках: -4,+4, рідко +2.
7)Окси́д (о́кисел, о́кись) — бинарное соединение химического элемента с кислородом в степени окисления −2, в котором сам кислород связан только с менее электроотрицательным элементом. Химический элемент кислород по электроотрицательности второй после фтора, поэтому к оксидам относятся почти все соединения химических элементов с кислородом. К исключениям относятся, например, дифторид кислорода OF2.
Оксиды — весьма распространённый тип соединений, содержащихся в земной коре и во Вселенной вообще. Примерами таких соединений являются ржавчина, вода, песок, углекислый газ, ряд красителей. Оксидами называется класс минералов, представляющих собой соединения металла с кислородом (см. Окислы).
В зависимости от химических свойств различают:
основные оксиды (например, оксид натрия Na2O, оксид меди(II) CuO): оксиды металлов, степень окисления которых I—II;
кислотные оксиды (например, оксид серы(VI) SO3, оксид азота(IV) NO2): оксиды металлов со степенью окисления V—VII и оксиды неметаллов;
амфотерные оксиды (например, оксид цинка ZnO, оксид алюминия Al2О3): оксиды металлов со степенью окисления III—IV и исключения (ZnO, BeO, SnO, PbO);
Несолеобразующие оксиды: оксид углерода(II) СО, оксид азота(I) N2O, оксид азота(II) NO, оксид кремния(II) SiO.
1. Основный оксид + кислота → соль + вода
Примечание: кислота ортофосфорная или сильная.
2. Сильноосновный оксид + вода → щелочь
3. Сильноосновный оксид + кислотный оксид → соль
4. Основный оксид + водород → металл + вода
Примечание: металл менее активный, чем алюминий.
Оксидами називаються складні речовини, до яких входять два елементи, один з яких оксиген.
Майже всі хімічні елементи утворюють оксиди. І досі ще не добуто оксиди трьох елементів – благородних газів: гелію, неону, аргону.
Солетворні оксиди здатні утворювати солі під час взаємодії з кислотами або кислотами.
Основними називаються такі оксиди, яким відповідають основи. Ці оксиди металів. Для них характрний фонний тип зв’язку. У металів, які входять до складу основних оксидів, ступінь окислення буває не вище + 3. Наприклад, No2O, CaO, FeO, NiO, CuO, ін.
Кислотними називають оксиди, яким відповідають кислоти. Утворюються неметалами і деякими металами, що виявляють високі ступені окислення. Наприклад, CO2, P2O5, SO2SO3, SiO2, CrO3, Mn2O7, ін.
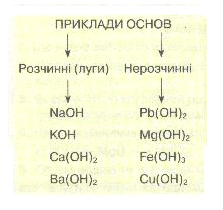
8)Класифікація основ. За розчинністю у воді основи поділяють на:
а) розчинні, або луги, — NaOH, КОН, Са(ОН)2, Ва(ОН)2 тощо;
б) нерозчинні — купрум(ІІ) гідроксид Си(ОН)2, ферум(ІІІ) гідроксид Fe(OH)3 та ін.
9)Кисло́ты — сложные вещества, в состав которых обычно входят атомы водорода, способные замещаться на атомы металлов, и кислотный остаток. Водные растворы кислот имеют кислый вкус, обладают раздражающим действием, способны менять окраску индикаторов, отличаются рядом общих химических свойств.
По основности — количество кислых атомов водорода
Двухосновные (H2SeO4, двухосновные предельные карбоновые кислоты);
Полиосновные (практически не встречаются).
Сильные — диссоциируют практически полностью, константы диссоциации больше 1·10−3 (HNO3);
Слабые — константа диссоциации меньше 1·10−3 (уксусная кислота Kд= 1,7·10−5).
По принадлежности к классам химических соединений
Химические свойства кислот
Взаимодействие с основными оксидами с образованием соли и воды:
Химические свойства кислот
Окрашивание индикаторной бумаги в растворе хлороводородной кислоты
Взаимодействие с основными оксидами с образованием соли и воды:
Взаимодействие с амфотерными оксидами с образованием соли и воды:
Взаимодействие со щелочами с образованием соли и воды (реакция нейтрализации):
Взаимодействие с нерастворимыми основаниями с образованием соли и воды, если полученная соль растворима:
Взаимодействие с солями, если выпадает осадок или выделяется газ:
Сильные кислоты вытесняют более слабые из их солей:
(в данном случае образуется неустойчивая угольная кислота , которая сразу же распадается на воду и углекислый газ)
Металлы, стоящие в ряду активности до водорода, вытесняют его из раствора кислоты (кроме азотной кислоты любой концентрации и концентрированной серной кислоты ), если образующаяся соль растворима:
С азотной кислотой и концентрированной серной кислотами реакция идёт иначе:
См. статью Взаимодействие кислот с металлами.
Для органических кислот характерна реакция этерификации (взаимодействие со спиртами с образованием сложного эфира и воды):
Источник