Лекция 3
Вопросы: Состав и физико-химические свойства природных газов, их классификация. Газовые смеси, плотность газов, состав газовой смеси. Парциальные давление и объём в смеси идеальных газов. Аналитические методы расчета физических свойств природных газов. Вязкость газа
Состав и физико-химические свойства природных газов. Классификация природных газов
Природные газы, добываемые из чисто газовых, нефтяных и газоконденсатных месторождений, состоят из углеводородов гомологического ряда метана (Сn Н2n+2), а также неуглеводородных компонентов: азота (N2), углекислого газа (СО2), сероводорода (H2S), редкоземельных (инертных) газов (гелия, аргона, криптона, ксенона), ртути. Число углеродных атомов n в молекуле углеводородов может достигать 17 и более.
Метан (СН4), этан (С2Н6) и этилен (С2Н4) при нормальных условиях (Р = 0,1 МПа и T = 273 К) являются реальными газами. Пропан (С3Н8), пропилен (С3Н6), изобутан (i-C4H10), нормальный бутан (n-С4Н10), бутилены C4Н8) при атмосферных условиях находятся в парообразном (газообразном) состоянии, при повышенных давлениях — в жидком. Они входят в состав жидких (сжижаемых, сжиженных) углеводородных газов.
Углеводороды, начиная с изопентана (i-C5H12) и более тяжелые (17 > n > 5) при атмосферных условиях находятся в жидком состоянии. Они входят в состав бензиновой фракции. Углеводороды, молекула которых состоит из 18 и более атомов углерода (от C18H38), расположенных в одну цепочку, при атмосферных условиях находятся в твердом состоянии.
Природные газы подразделяются на три группы:
1. Сухой газ, свободный от тяжелых углеводородов, добываемый из чисто газовых месторождений.
2. Смесь сухого газа, пропанобутановой фракции (сжиженного газа) и газового бензина, добываемые вместе с нефтью.
3. Сухой газ и жидкий углеводородный конденсат, добываемые из газоконденсатных месторождений.
Углеводородный конденсат состоит из большого числа тяжелых углеводородов, из которых можно выделить бензиновые, лигроиновые, керосиновые, а иногда и более тяжелые маслянистые фракции.
Следует отметить, что в промышленности используются искусственные газы, полученные из твердых топлив (горючие сланцы, бурый уголь и пр.).
Газовые смеси. Плотность газов
Под плотностью, или объёмной массой, тела понимают отношение массы тела в состоянии покоя к его объёму.
Плотность газа в нормальных физических условиях (при 0,1013 МПа и 273 К) можно определить по формуле
где М — молекулярная масса.
Если плотность газа задана при давлении 0,1013 МПа, то пересчёт её на другое давление (при той же температуре) для идеального газа проводится по формуле
Часто для характеристики газа применяют относительную плотность его по воздуху при нормальных условиях (0,1013 МПа и 273 К)
Коммерческие расчёты в газовой промышленности проводят при стандартных физических условиях — 0,1013 МПа и 293 К.
Состав газовой смеси
Газовые смеси (как и смеси жидкостей и паров) характеризуются массовыми или молярными концентрациями компонентов. Объёмный состав газовой смеси примерно совпадает с молярным, так как объёмы 1 кмоля идеальных газов при одинаковых физических условиях по закону Авогадро имеют одно и то же численное значение, в частности при 273 К и 0,1013 МПа составляют 22,41 м 3 .
Для характеристики газовой смеси следует знать её среднюю молекулярную массу, среднюю плотность (в кг/м 3 ) или относительную плотность по воздуху.
Если известен молярный состав смеси в процентах, то среднюю молекулярную массу вычисляют по формуле
где у1, у2, . уn—молярные (объёмные) доли компонентов, %;
Ml, М2, . Mn — молекулярные массы компонентов.
Если задан массовый состав смеси, то её среднюю молекулярную массу определяют по формуле
Плотность смеси ρсм определяется по вычисленному значению средней молекулярной массы Мсм по формуле, аналогичной (1)
Относительную плотность смеси вычисляют по формуле
где ρcм и ρв — плотности соответственно смеси и воздуха при 273 К и 0,1013 МПа.
Парциальные давление и объём компонента в
смеси идеальных газов
Смеси идеальных газов характеризуются аддитивностью парциальных давлений и парциальных объёмов. Это означает, что каждый газ в смеси идеальных ведет себя так, как если бы в данном объёме он был бы один.
Парциальное давление газа — давление газа, входящего в состав газовой смеси, которое он оказывал бы, занимая один весь объём смеси и находясь при неизменных первоначальных объёме и температуре.
Парциальный объём — объём, который занимал бы газ, входящий в состав газовой смеси, если бы он находился при тех же давлении и температуре, что и вся смесь.
Аддитивность парциальных давлений выражается законом Дальтона, согласно которому
где р — общее давление смеси газов;
pi — парциальное давление i-го компонента в смеси;
где ni — число молей i-го компонента в смеси;
N — общее число молей смеси;
уi — ni/N — молярная доля i-го компонента в смеси.
Таким образом, парциальное давление компонента рi в смеси идеальных газов равно произведению его молярной доли в смеси yi на общее давление смеси газов р.
Аддитивность парциальных объёмов компонентов газовой смеси выражается законом Амага, согласно которому
где V — общий объём смеси;
Vi, — парциальный объём i-го компонента в смеси.
Таким образом, парциальный объём компонента в смеси идеальных газов; Vi — равен произведению его молярной доли уi в смеси на общий объём V смеси газов.
Аналитические методы расчета физических свойств
Для определения многих физических свойств природных газов используют уравнение состояния — аналитическую зависимость между параметрами, описывающими изменение
простого или сложного вещества (давление, объём и температура).
Клапейрон и Менделеев предложили следующее уравнение состояния идеальных газов:
где р — абсолютное давление. Па;
G — масса вещества, кг;
Т — абсолютная температура, К;
R — удельная газовая постоянная, Дж/(кг К).
Идеальным называется газ, собственный объём молекул, которого пренебрежимо мал по сравнению с объёмом, занимаемым газом, и когда отсутствует взаимодействие между молекулами.
С термодинамической точки зрения идеальным называется газ, для которого справедливо равенство
где Е — внутренняя энергия парообразования, Дж/моль или
где z — коэффициент отклонения реального газа от закона идеального.
Экспериментальная проверка уравнения (14), проведенная многими исследователями, показала, что изменение свойств реальных газов при высоких давлениях нельзя описать зависимостью (16).
Голландский физик Ван-дер-Ваальс в 1879 г. предложил учесть собственный объём молекул газа и силы их взаимного притяжения посредством введения дополнительных членов в уравнение Клапейрона — Менделеева:
где v — V/G — удельный объем газа, м 3 /кг;
а/v 2 — константа сцепления молекул. Па;
b — поправка на собственный объём молекул, м 3 .
В уравнении (17) слагаемое а/v 2 , выражает внутреннее давление, которое является как бы равнодействующей сил притяжения всех молекул в объёме V. Оно прибавляется к внешнему давлению. Это уравнение приближенное.
В соотношениях для критического состояния вещества
коэффициенты a и b выражаются через критическое давление ркр и критическую температуру Ткр следующим образом:
Ван-дер-Ваальс нашел, что поправка b на собственный объём молекул, имеющих шарообразную форму, равна учетверённому объёму молекул.
Уравнение (17) приближенное. Коэффициенты а и b в действительности являются сложными функциями объёма, температуры, формы молекул газа.
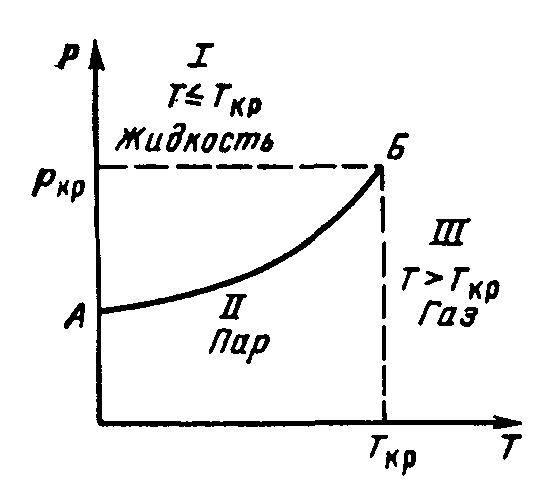
Критическая температура чистого вещества — это максимальная температура, при которой жидкая и паровая фазы могут сосуществовать в равновесии, или та температура, при которой средняя молекулярная кинетическая энергия становится равной потенциальной энергии притяжения молекул. При более высокой температуре существование жидкой фазы невозможно.
Давление паров вещества при критической температуре называется критическим давлением, а объём вещества, отнесенный к одному молю или другой единице массы вещества, называется критическим удельным объёмом. Критической принято называть такую температуру, выше которой газ под действием давления любого значения не может быть обращен в жидкость.
На рис. 1. приведена зависимость давления (упругости насыщенных паров) чистых веществ от температуры. Эта зависимость более точно описывает изменение свойств реальных газов при давлениях до 10 МПа и температурах от 283 до 293 К, но она не может численно описывать изменение, свойств многокомпонентных смесей месторождений природных газов.
Рисунок 1. Зависимость давления (упругости насыщенных паров) чистых веществ от температуры
Давление, необходимое для сжижения газа при критической температуре, называется критическим. Кроме критического давления и критической температуры вводится понятие критического объёма, равного объёму одного моля газа при критических давлении и температуре. Для природных газов, представляющих собой смесь отдельных компонентов, значения Ркр и Ткр определяются как среднекритические (псевдокритические).
Средние критические давление и температуру смеси можно определить по формулам:
где х1, х2…хn — объёмные доли компонентов, входящих в состав газа;
— критические давления компонентов;
— критические температуры компонентов.
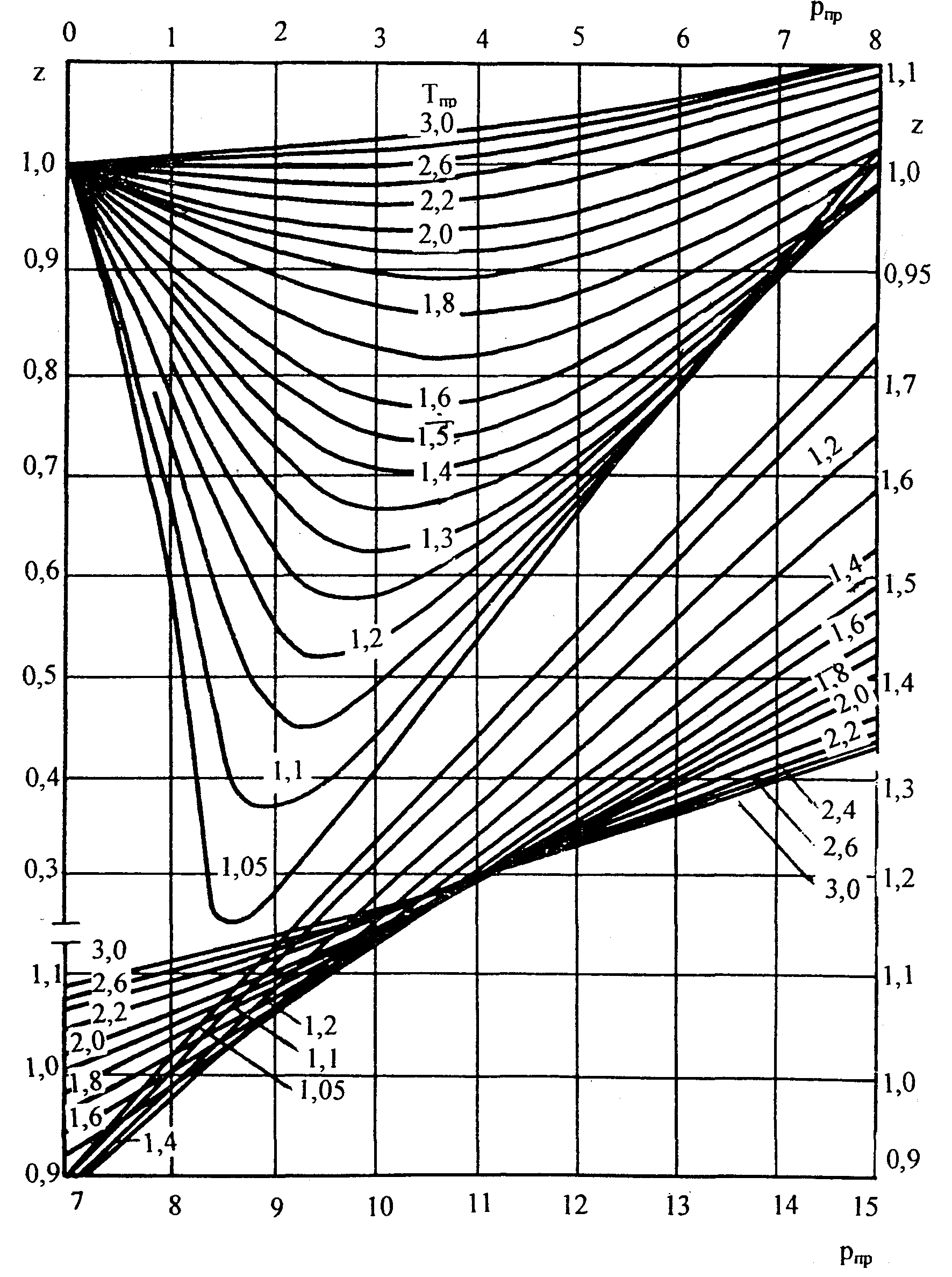
Следует отметить, что коэффициент сверхсжимаемости природной углеводородной смеси Zсм можно определить по графической зависимости представленной на рисунке 1.2.
Рис. 1.2. Значение коэффициента сверхсжимаемости z по данным Стэндинга и Катца
Если известна относительная плотность газа , то средние критические давление и температуру природного газа можно определить по графикам. При содержании в природном газе N2, СО2 или H2 S в значения Ркр и Ткр вводятся соответствующие поправки. Когда содержание N2, CO2 или Н2 S превышает 15% об., вместо графиков для определения Ркр и Ткр следует пользоваться формулой (1.20).
Для приближенных расчётов при изменении , от 0,5 до 0,9 значения Ркр и Ткр можно определить по формулам:
Часто в расчётах, например, при определении вязкости и коэффициента сверхсжимаемости газа, пользуются так называемыми приведенными давлениями и температурами. Приведенными параметрами индивидуальных компонентов называют безразмерные величины, показывающие, во сколько раз действительные параметры состояния газа (давление, абсолютная температура, объём, плотность, коэффициент отклонения) больше или меньше критических:
Приведенным давлением Рпр называется отношение давления газа Р к его критическому давлению Ркр
Приведенной температурой газа Тпр называется отношение абсолютной температуры газа Т к его критическому значению:
Дальнейший прогресс науки и техники потребовал разработки более точного уравнения состояния природных газов, способного правильно описывать изменение их свойств при давлениях до 100 МПа и температурах до 573 К в процессах добычи газа и при давлениях до 20 МПа и низких температурах до 223 — 93 К (от минус 50 до минус180°С) в процессах переработки природных газов.
В решении этой проблемы выявились два направления:
1) введение поправочного коэффициента z в уравнение состояния идеального газа (1.17), учитывающего отклонение реального газа от идеального, т. е. pV==zRT
2) дополнение уравнения состояния идеального газа большим числом констант.
Источник