Межмолекулярные взаимодействия
Рассмотрим взаимодействия, возникающие между отдельными молекулами в веществе — межмолекулярные взаимодействия . Межмолекулярные взаимодействия — это такой вид взаимодействия между нейтральными атомами, при котором не образуются новые ковалентные связи. Силы взаимодействия между молекулами обнаружены Ван-дер Ваальсом в 1869 году, и названы в честь него Ван-дар-Ваальсовыми силами . Силы Ван-дер-Ваальса делятся на ориентационные, индукционные и дисперсионные . Энергия межмолекулярных взаимодействий намного меньше энергии химической связи.
Ориентационные силы притяжения возникают между полярными молекулами (диполь-диполь взаимодействие). Эти силы возникают между полярными молекулами. Индукционные взаимодействия — это взаимодействие между полярной молекулой и неполярной. Неполярная молекула поляризуется из-за действия полярной, что и порождает дополнительное электростатическое притяжение.
Особый вид межмолекулярного взаимодействия — водородные связи.
Водородные связи — это межмолекулярные (или внутримолекулярные) химические связи, возникающие между молекулами, в которых есть сильно полярные ковалентные связи — H-F, H-O или H-N. Если в молекуле есть такие связи, то между молекулами будут возникать дополнительные силы притяжения.
Механизм образования водородной связи частично электростатический, а частично — донорно–акцепторный. При этом донором электронной пары выступают атом сильно электроотрицательного элемента (F, O, N), а акцептором — атомы водорода, соединенные с этими атомами. Для водородной связи характерны направленность в пространстве и насыщаемость.
Водородную связь можно обозначать точками: Н ··· O. Чем больше электроотрицательность атома, соединенного с водородом, и чем меньше его размеры, тем крепче водородная связь . Она характерна прежде всего для соединений фтора с водородом, а также кислорода с водородом, в меньшей степени азота с водородом.
Водородные связи возникают между следующими веществами:
- фтороводород HF (газ, раствор фтороводорода в воде — плавиковая кислота),
- вода H2O (пар, лед, жидкая вода):
- раствор аммиака и органических аминов — между молекулами аммиака и воды;
- органические соединения, в которых есть связи O-H или N-H : спирты, карбоновые кислоты, амины, аминокислоты, фенолы, анилин и его производные, белки, растворы углеводов — моносахаридов и дисахаридов.
Водородная связь оказывает влияние на физические и химические свойства веществ. Так, дополнительное притяжение между молекулами затрудняет кипение веществ. У веществ с водородными связями наблюдается аномальное повышение тепературы кипения.
Например , как правило, при повышении молекулярной массы наблюдается повышение температуры кипения веществ. Однако в ряду веществ H2O-H2S-H2Se-H2Te мы не наблюдаем линейное изменение температур кипения.
А именно, у воды температура кипения аномально высокая — не меньше -61 о С, как показывает нам прямая линия, а намного больше, +100 о С. Эта аномалия объясняется наличием водородных связей между молекулами воды. Следовательно, при обычных условиях (0-20 о С) вода является жидкостью.
Источник
3. Водородная связь
Водородная связь — это взаимодействие, возникающее между положительно заряженным атомом водорода и намного более электроотрицательным атомом, чаще всего кислорода, азота или фтора.
Это взаимодействие в несколько раз сильнее межмолекулярных сил, но в десять — пятнадцать раз слабее ковалентной связи.
Водородная связь образуется за счёт электростатического притяжения заряженных атомов, а также некоторый вклад в её возникновение вносит донорно-акцепторное взаимодействие. Из-за поляризации у атома водорода частично освобождается электронная орбиталь, а в атомах фтора, кислорода и азота есть пары электронов. Атом водорода выступает акцептором электронов, атом другого неметалла — их донором.
Водородная связь бывает межмолекулярной (в воде, аммиаке, фтороводороде, спиртах, карбоновых кислотах), а также внутримолекулярной (в многоатомных спиртах, белках, нуклеиновых кислотах).
Водородная связь значительно повышает температуры кипения и плавления веществ, а также их взаимную растворимость.
Рассмотрим влияние водородной связи на температуры кипения водородных соединений неметаллов \(IV\)–\(VII\) групп.
Температуры кипения зависят от молекулярных масс веществ и должны возрастать в каждом ряду. Но для воды, аммиака и фтороводорода эти значения температур не подчиняются общей закономерности. Причина такого явления — возникновение водородной связи.
Водородная связь образуется не только между одинаковыми молекулами, но и между разными. Например, такая связь возникает между молекулами спиртов и воды, что обуславливает их способность смешиваться друг с другом. Так, метанол, этанол, пропанол, этиленгликоль, глицерин растворяются в воде неограниченно благодаря образованию водородных связей.
Водородные связи широко встречаются в природе и оказывают значительное влияние на свойства веществ. Они значительно повышают температуры плавления и кипения веществ, влияют на их растворимость в воде.
Благодаря образованию водородных связей вода, метанол, этанол, уксусная кислота и многие другие вещества при обычных условиях находятся в жидком состоянии.
Водородные связи обуславливают вторичную (спиралевидную) структуру белков, а также соединяют две комплементарные цепи ДНК в единое целое.
Источник
Водородная химическая связь
Между атомами водорода и атомом элемента, обладающим высокой электроотрицательностью, возникает особый тип связи – водородная химическая связь. Она может образовываться не только внутри молекулы, но и между соседними молекулами.
Общее описание
Электроотрицательность – способность атома удерживать валентные электроны на внешнем энергетическом уровне или количественная характеристика, показывающая, с какой силой притягиваются электроны к ядру атома. Наиболее электроотрицательными элементами являются фтор, азот и кислород.
Сильное электростатическое взаимодействие между атомом водорода и электроотрицательными атомами обуславливается небольшими размерами атома водорода и силой притяжения атомов элементов. В результате возникает частный случай ковалентной полярной связи. Примерами водородной химической связи являются:
- плавиковая кислота (HF);
- вода (H2O);
- аммиак (NH3);
- соляная кислота (HCl);
- сероводород (H2S).
Наличие водородной связи обуславливает физические и химические свойства вещества. В частности определяет температуру плавления, кипения, растворимость, кислотность.
Особенностью связи является её невысокая прочность и распространённость, особенно в органических веществах.
Типы
Водородная связь бывают двух типов:
- межмолекулярная, возникающая между несколькими однотипными молекулами;
- внутримолекулярная, возникающая внутри одной молекулы.
Способ образования связи в обоих типах одинаковый. Разница только в том, что с помощью межмолекулярной водородной связи образуются цепочка молекул, а при внутримолекулярной связи водород «сцепляется» с атомами внутри молекулы.
Например, молекула воды образована одним атомом кислорода и двумя атомами водорода. За счёт высокой электроотрицательности кислород, на внешнем энергетическом уровне которого шесть электронов, притягивает единственные электроны двух атомов водорода. Две пары электронов кислорода остаются свободными. При этом у водорода освобождается орбиталь. Другая аналогичная молекула может присоединиться в месте свободных электронных пар атома кислорода, заполнив освободившуюся орбиталь водорода. Возникает межмолекулярная водородная связь.
Аналогичным образом соединяются молекулы плавиковой кислоты и аммиака. Однако связь между азотом и водородом будет слабее, чем между водородом и кислородом. Также молекулы плавиковой кислоты сильнее притягиваются друг к другу, чем молекулы воды. Это объясняется величиной электроотрицательности.
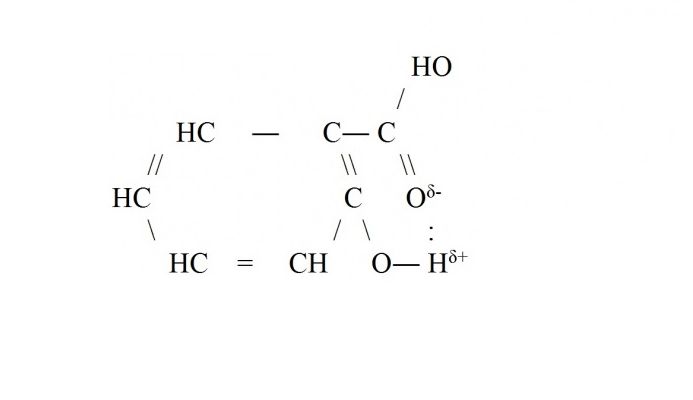
Внутримолекулярная водородная связь чаще всего возникает внутри сложных молекул органических веществ – белков, ДНК, аренов. Например, водородная связь образуется в молекуле салициловой кислоты между атомом водорода гидроксильной группы и кислорода, входящего в функциональную группу -СООН.
Водородные связи графически изображаются точками.
Что мы узнали?
Между атомами водорода и атомами неметаллов возникает водородная связь, основанная на электростатическом взаимодействии атомов. Это частный случай ковалентной полярной связи, характеризующийся взаимодействием водорода и атомов с высокой электроотрицательностью. Связь бывает двух типов: межмолекулярная, возникающая между молекулами вещества, и внутримолекулярная, возникающая между водородом и атомом другого элемента в одной молекуле. Водородная связь присуща неорганическим и органическим веществам.
Источник