2. Природа и типы химических связей
Атомы большинства химических элементов не могут существовать в изолированном состоянии. Они соединяются между собой и образуют молекулы или кристаллы (атомные, металлические, ионные).
Химическая связь — это электростатическое взаимодействие атомов, в результате которого они объединяются в более сложные комплексы (ионы, радикалы, молекулы, кристаллы).
Образование химической связи происходит самопроизвольно, и при этом всегда наблюдается выделение энергии. Это значит, что полная энергия образовавшейся системы меньше, чем общая энергия отдельных атомов. Стремление системы к минимуму энергии является главной причиной возникновения химической связи между атомами.
В образовании химической связи, как правило, участвуют электроны, расположенные на наружном энергетическом уровне и слабо связанные с ядром.
Благородные газы не образуют химических связей. Они существуют в виде изолированных атомов (одноатомных молекул). Наличие химической инертности благородных газов, отличающихся от других атомов заполненным внешним энергетическим уровнем, позволило учёным прийти к выводу, что при образовании химических связей атомы стремятся к завершению своего внешнего электронного уровня.
В основе химической связи всегда лежит электростатическое взаимодействие заряженных частиц — ядер и электронов. Образование химической связи связано с перекрыванием электронных орбиталей и перераспределением электронной плотности между взаимодействующими атомами.
В зависимости от разности электроотрицательностей связанных атомов возможно возникновение трёх типов химической связи: ковалентной , ионной и металлической .
Ковалентная связь возникает между атомами неметаллов, т. е. между атомами с высокой электроотрицательностью. При взаимодействии одинаковых атомов неметаллов (\(χ\) больше \(2\), и электроотрицательности примерно равны) образуется ковалентная неполярная связь. Если взаимодействуют атомы, для которых разность \(χ\) от \(0,4\) до \(2\), то образуется ковалентная полярная связь.
Ионная связь возникает между атомами металлов и неметаллов, электроотрицательности которых различаются значительно (разность \(χ\) больше \(2\)).
Источник
10.Природа химической связи. Основные виды связи: ковалентная, ионная, водородная, металлическая, межмолекулярное взаимодействие.
По современным представлениям химическая связь между атомами имеет электростатическую природу. Под химической связью понимают электрические силы притяжения, удерживающие частицы друг около друга.
Частицы, которые принимают участие в образовании химических связей, могут быть атомами, молекулами или ионами.
Каждая химическая связь в структурных формулах представляется валентной чертой, например: H−H (связь между двумя атомами водорода) H3N−H + (связь между атомом азота молекулы аммиака и катионом водорода) (K + )−(I − ) (связь между катионом калия и иодид-ионом)
Типы химических связей
Ковалентная связь – наиболее общий вид химической связи, возникающий за счет обобществления электронной пары посредством обменного механизма, когда каждый из взаимодействующих атомов поставляет по одному электрону, или по донорно-акцепторному механизму, если электронная пара передается в общее пользование одним атомом (донором) другому атому (акцептору) (рис. 3.2).
Обменный (а) и донорно-акцепторный (б) механизмы образования ковалентной связи
Классический пример неполярной ковалентной связи (разность электроотрицательностей равна нулю) наблюдается у гомоядерных молекул: H–H, F–F. Энергия двухэлектронной двухцентровой связи лежит в пределах 200–2000 кДж∙моль –1 .
При образовании гетероатомной ковалентной связи электронная пара смещена к более электроотрицательному атому, что делает такую связь полярной. Ионность полярной связи в процентах вычисляется по эмпирическому соотношению 16(χA – χB) + 3,5(χA – χB) 2 , где χA и χB – электроотрицательности атомов А и В молекулы АВ. Кроме поляризуемостиковалентная связь обладает свойством насыщаемости – способностью атома образовывать столько ковалентных связей, сколько у него имеется энергетически доступных атомных орбиталей. О третьем свойстве ковалентной связи – направленности – речь пойдет ниже (см. метод валентных связей).
Ионная связь – частный случай ковалентной, когда образовавшаяся электронная пара полностью принадлежит более электроотрицательному атому, становящемуся анионом. Основой для выделения этой связи в отдельный тип служит то обстоятельство, что соединения с такой связью можно описывать в электростатическом приближении, считая ионную связь обусловленной притяжением положительных и отрицательных ионов. Взаимодействие ионов противоположного знака не зависит от направления, а кулоновские силы не обладают свойством насыщености. Поэтому каждый ион в ионном соединении притягивает такое число ионов противоположного знака, чтобы образовалась кристаллическая решетка ионного типа. В ионном кристалле нет молекул. Каждый ион окружен определенным числом ионов другого знака (координационное число иона). Ионные пары могут существовать в газообразном состоянии в виде полярных молекул. В газообразном состоянии NaCl имеет дипольный момент ~3∙10 –29 Кл∙м, что соответствует смещению 0,8 заряда электрона на длину связи 0,236 нм от Na к Cl, т. е. Na 0,8+ Cl 0,8– .
Металлическая связь возникает в результате частичной делокализации валентных электронов, которые достаточно свободно движутся в решетке металлов, электростатически взаимодействуя с положительно заряженными ионами. Силы связи не локализованы и не направлены, а делокализированные электроны обусловливают высокую тепло- и электропроводность.
Модель 3.1. Виды химической связи
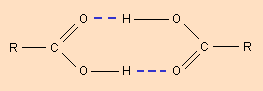
Водородная связь. Ее образование обусловленно тем, что в результате сильного смещения электронной пары к электроотрицательному атому атом водорода, обладающий эффективным положительным зарядом, может взаимодействовать с другим электроотрицательным атомом (F, O, N, реже Cl, Br, S). Энергия такого электростатического взаимодействия составляет 20–100 кДж∙моль –1 . Водородные связи могут быть внутри- и межмолекулярными. Внутримолекулярная водородная связь образуется, например, в ацетилацетоне и сопровождается замыканием цикла (рис. 3.3).
Молекулы карбоновых кислот в неполярных растворителях димеризуются за счет двух межмолекулярных водородных связей (рис. 3.4).
Образование внутримолекулярной водородной связи
Образование межмолекулярной водородной связи
Исключительно важную роль водородная связь играет в биологических макромолекулах, таких неорганических соединениях как H2O, H2F2, NH3. За счет водородных связей вода характеризуется столь высокими по сравнению с H2Э (Э = S, Se, Te) температурами плавления и кипения. Если бы водородные связи отсутствовали, то вода плавилась бы при –100 °С, а кипела при –80 °С.
Химическая связь в твердых телах. Свойства твердых веществ определяются природой частиц, занимающих узлы кристаллической решетки и типом взаимодействия между ними.
Твердые аргон и метан образуют атомные и молекулярные кристаллы соответственно. Поскольку силы между атомами и молекулами в этих решетках относятся к типу слабых ван-дер-ваальсовых, такие вещества плавятся при довольно низких температурах. Большая часть веществ, которые при комнатной температуре находятся в жидком и газообразном состоянии, при низких температурах образуют молекулярные кристаллы.
Температуры плавления ионных кристаллов выше, чем атомных и молекулярных, поскольку электростатические силы, действующие между ионами, намного превышают слабые ван-дер-ваальсовы силы. Ионные соединения более твердые и хрупкие. Такие кристаллы образуются элементами с сильно различающимися электроотрицательностями (например, галогениды щелочных металлов). Ионные кристаллы, содержащие многоатомные ионы, имеют более низкие температуры плавления; так для NaCl tпл. = 801 °C, а для NaNO3 tпл = 306,5 °C.
В ковалентных кристаллах решетка построена из атомов, соединенных ковалентной связью, поэтому эти кристаллы обладают высокими твердостью, температурой плавления и низкими тепло- и электропроводностью.
Кристаллические решетки, образуемые металлами, называются металлическими. В узлах таких решеток находятся положительные ионы металлов, в межузлиях – валентные электроны (электронный газ).
Наибольшую температуру плавления из металлов имеют d-элементы, что объясняется наличием в кристаллах этих элементов ковалентной связи, образованной неспаренными d-электронами, помимо металлической, образованнной s-электронами.
Источник
10. Типы химической связи (ковалентная , ионная, металлическая, водородная)
Химическая связь возникает благодаря взаимодействию электрических полей создаваемых электронами и ядрами атомов, т.е. химическая связь имеет электрическую природу.
Под химической связью понимают результат взаимодействия 2х или более атомов приводящий к образованию устойчивой многоатомной системы. Условием образования химической связи является уменьшение энергии взаимодействующих атомов, т.е. молекулярное состояние вещества энергетически более выгодно, чем атомное. При образовании химической связи атомы стремятся получить завершенную электронную оболочку.
Различают: ковалентную, ионную, металлическую, водородную и межмолекулярную.
Ковалентная связь – наиболее общий вид химической связи, возникающий за счет обобществления электронной пары посредством обменного механизма –, когда каждый из взаимодействующих атомов поставляет по одному электрону, или по донорно-акцепторному механизму, если электронная пара передается в общее пользование одним атомом (донором – N, O, Cl, F) другому атому (акцептору – атомы d-элементов ).
1 – кратность связей – между 2мя атомами возможна только 1 сигма-связь, но наряду с ней между теми же атомами могут быть пи и дельта-связь, что приводит к образованию кратных связей. Кратность определяется числом общих электронных пар.
2 – длина связи – межъядерное расстояние в молекуле, чем больше кратность, тем меньше ее длина.
3 – прочность связи – это количество энергии необходимое для ее разрыва
4 – насыщаемость ковалентной связи проявляется в том, что одна атомная орбиталь может принимать участие в образовании только одной к.с. Это свойство определяет стехиометрию молекулярных соединений.
5 – направленность к.с. в зависимости от того, какую форму и какое направление имеют электронные облака в пространстве при их взаимном перекрывании могут образовываться соединения с линейной и угловой формой молекул.
Ионная связь – образуется между атомами которые сильно отличаются по электроотрицательности. Это соединения главных подгрупп 1 и 2 групп с элементами главных подгрупп 6 и 7 групп. Ионной называют химическую связь, которая осуществляется в результате взаимного электростатического притяжения противоположно заряженных ионов.
Механизм образования ионной связи: а) образование ионов взаимодействующих атомов; б) образование молекулы за счет притяжения ионов.
Ненаправленность и ненасыщенность ионной связи
Силовые поля ионов равномерно распределяются во всех направлениях поэтому каждый ион может притягивать к себе ионы противоположного знака в любом направлении. В этом заключается ненаправленность ионной связи. Взаимодействие 2х ионов противоположного знака не приводит к полной взаимной компенсации их силовых полей. Поэтому у них сохраняется способность притягивать ионы и по другим направлениям, т.е. ионная связь характеризуется ненасыщенностью. Поэтому каждый ион в ионном соединении притягивает такое число ионов противоположного знака, чтобы образовалась кристаллическая решетка ионного типа. В ионном кристалле нет молекул. Каждый ион окружен определенным числом ионов другого знака (координационное число иона).
Металлическая связь – хим. Связь в металлах. У металлов имеется избыток валентных орбиталей и недостаток электронов. При сближении атомов их валентные орбитали перекрываются благодаря чему электроны свободно перемещаются из одной орбитали в другую, осуществляется связь между всеми атомами металла. Связь которую осуществляют относительно свободные электроны между ионами металла в кристаллической решетке называется металлической связью. Связь сильно делокализована и не обладает направленностью и насыщенностью , т.к. валентные электроны равномерно распределены по кристаллу. Наличие свободных электронов обусловливает существование общих свойств металлов: непрозрачность, металлический блеск, высокая электро и теплопроводность, ковкость и пластичность.
Водородная связь – связь между атомом Н и сильноотрицательным элементом (F, Cl, N, O, S). Водородные связи могут быть внутри- и межмолекулярными. ВС слабее ковалентной связи. Возникновение ВС объясняется действием электростатических сил. Атом Н обладает маленьким радиусом и при смещении или отдаче единственного электрона Н приобретает сильный положительный заряд, который действует на электроотрицательность.
Источник