- Физические и химические свойства кальция и его роль в природе
- История открытия
- Кальций в таблице Менделеева
- Строение атома
- Физические свойства
- Химический свойства
- Кальций в природе
- Применение
- 13.2. Кальций
- Простое вещество
- I. Взаимодействие с простыми веществами.
- II. Взаимодействие со сложными веществами.
- Cоединения кальция
- Ca(oh)2 — гидроксид кальция(II), гашеная известь
- Гидрид кальция CaH2 и карбид кальция СаС2
- 13.3. Жесткость воды и способы ее устранения
Физические и химические свойства кальция и его роль в природе
Кальций (Ca) – легкий агрессивный металл серебристого цвета с беловатым оттенком. Он играет важную роль во многих сферах жизни. В свободном виде в природе его нет, так как он химически высокоактивен.
История открытия
В первом десятилетии 19-го века Хэмфри Дэви получил вещество без примесей. Он взял для электролиза катод на основе ртути и увлажненную гашеную известь. На первом этапе результат – сплав кальция и ртути. На втором, после удаления ртутной части – чистый элемент.
История названия «кальций» берет начало в том же веке от латинского “calx”, что переводится как известь.
Однако в древнем мире слово уже употреблялось для описания некоторых процессов, например для обжига известняка, гашения извести. Сам процесс термической обработки позднее получил название «кальцинация».
Кальций в таблице Менделеева
В системе Менделеева занимает 20 порядковое место, что относится ко второй группе и четвертому периоду.
Атомная масса вещества – 40,078 г/моль. Это металл, входящий в категорию щелочноземельных, s-семейство.
Строение атома
Атом имеет положительно заряженное ядро и область вокруг него с орбиталями. Ядро любого атома содержит протоны и нейтроны, соответственно, положительно и нейтрально заряженные частицы.
Ядро атома кальция содержит по 20 протонов и нейтронов. В области вокруг него находится 4 орбитали, по которым движется 20 электронов – отрицательно заряженных частиц. При этом электроны располагаются в порядке 2, 8, 8, 2.
Последняя орбиталь в электронном строении описывается как 4S², имеет 2 спаренных электрона, из-за чего валентность элемента равна 2. При образовании соединений отдает 2 электрона с внешнего слоя, выполняет функцию окислителя. Степень окисления равна +2.
Физические свойства
Это твердый металл серебряного цвета с беловатым оттенком в нормальных условиях. При постепенном нагревании переходит в жидкое агрегатное состояние, потом в газообразное.
| Параметр | Значение |
| Плавление | При 842°С |
| Кипение | При 1484°С |
| Плотность | 1,55 г/см³ |
Хорошо подвергается различным манипуляциям – режется, прессуется, прокатывается.
Аллотропия – способность химического элемента существовать в виде двух и более простых веществ, которые различаются по свойствам, химическому строению. Существует две аллотропные модификации:
Различаются они моделью кубической решетки. У α-Ca она гранецентрированная, а у β-Ca объемноцентрированная.
Химический свойства
Является типичным представителем семейства щелочноземельных металлов. Кальций вступает в реакции с разными веществами, так как является химически активным.
Несмотря на свою высокую способность к взаимодействию, кальций не самый активный металл семейства. Степень окисления +2.
Кальций вступает в следующие химические реакции:
- С кислородом взаимодействует в нормальных условиях, образуя оксид и выделяя тепло. Может даже загореться чистым красным огнем и белым дымом. Образуется оксид кальция — 2Ca + O₂ -> 2CaO.
- С галогенами реагирует в нормальных условиях — Ca + Br₂ -> CaBr₂ – бромид.
- С углеродом дает реакцию при нагреве. Аналогичными будут взаимодействия с водородом, кремнием и другими неметаллами — Ca + 2C -> CaC₂ – карбид.
- С кислотами, иногда с мощным выделением тепла. Выделяют 2 варианта уравнения реакции кальция с серной кислотой: Ca + H₂SO₄(разбавленная) -> CaSO₄ + 2H₂ и Ca + H₂SO₄(концентрированная) -> CaSO₄ + SO₂ + 2H₂O. В обоих случаях результатом реакции будет соль сульфат, побочные продукты.
- С водой реакция проходит с выделением тепла, но без воспламенений — Ca + 2H₂O -> Ca(OH)2 + H₂.
На воздухе металл покрывается сероватым налетом.
В реакции вступает много соединений элемента:
- Соединения кальция и неметаллов в присутствии воды разлагаются до гидроксида, водорода — CaH₂ + H₂O -> Ca(OH)₂ + 2H₂.
- Существует особенный перенос веществ, а именно превращение из карбоната в кислую его версию и обратно в разных условиях.
- При реакции воды, обогащенной углекислым газом, с карбонатом кальция выделяется кислый карбонат, одновременно происходит растворение — СаСО3 + СО2 + Н2О = Са(НСО3)2.
- В обратном случае кислый карбонат кальция нагревается под солнцем распадаясь на 3 компонента — Са(НСО3)2 = СаСО3 + СО2↑ + Н2О.
Рекомендовано не хранить кальций в открытом виде, а убирать в герметичную стеклянную посуду с добавлением парафина или керосина.
Кальций в природе
В целом вещество является пятым по распространенности на планете. К осадочным породам с кальцием в составе относят меловые отложения и известняк. В основном они состоят из кальцита, который в кристаллической форме представляет собой мрамор.
Элемент способен мигрировать в земной коре и из-за своей активности вступать в различные реакции, образуя минералы. Насчитывается более 380 минералов с участием этого компонента. Часто встречаются:
Элемент содержится и в живых организмах. Большая часть, а именно гидроксиапатит, приходится на клетки костей, зубов. У губок, кораллов скелет целиком состоит из карбоната кальция.
Применение
В редких случаях кальций используется как самостоятельный компонент, чаще он находится в других веществах. В чистом виде применяется в восстановительных реакциях металлов из оксидов.
В металлургии востребован для удаления окислений или для получения трудно восстанавливаемых металлов, например урана или хрома.
В свинцовый аккумуляторах кальций используют как небольшую добавку. От общего объема вещества его меньше 1%. Однако этого достаточно, чтобы не дать аккумулятору перегреться или закипеть. Дополнительно элемент защищает основное вещество, свинец, от коррозии.
Используется для огнеупорных материалов и средств.
Соединения кальция применяются для получения:
Каждый хоть раз видел мел, гипс, известняк. Первый используется для письма на досках, второй – в медицине и строительстве зданий, а третий – в качестве стройматериала, а также для пищевой, химической промышленности.
Отмечают биологическую роль элемента. Живым организмам он нужен для нормального сердцебиения. Его ионы участвуют в передаче сигнала по нервным клеткам, в работе мышц, в процессе свертывания крови.
Без кальция не существовало бы многих отраслей промышленности и даже жизни, так как он является важным макроэлементом.
А что вам известно о кальции? Сохраняйте статью, чтобы не потерять полезную информацию, делитесь ею в социальных сетях.
Также рекомендуем посмотреть подобранные видео по нашей теме.
Различные опыты с кальцием.
Химический элемент кальций.
Карбонат и гидрокарбонат кальция.
- https://www.chem100.ru/elem.php?n=20
- https://allmetalls.ru/ca.html
- https://ru.wikipedia.org/wiki/Кальций
- http://www.mining-enc.ru/k/kalcij
Источник
13.2. Кальций
Электронное строение атома: 1s 2 2s 2 2p 6 3s 2 3р 6 4s 2 .
Степени окисления: 0, +2.
Простое вещество
Серебристо-белый, довольно твердый, легкий металл.
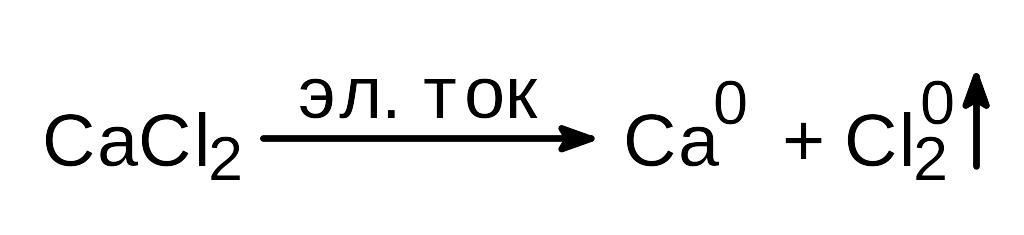
Электролизом расплавов солей (6 ч. CaCl2 и 1 ч. CaF2, последний добавляется для понижения температуры плавления хлорида кальция):
Сильный восстановитель. Во всех реакциях легко отдает валентные электроны и превращается в положительно заряженный катион.
I. Взаимодействие с простыми веществами.
1) При обычных условиях — с хлором, кислородом:
2) При нагревании — с некоторыми неметаллами:
II. Взаимодействие со сложными веществами.
2) С кислотами (при взаимодействии с кислотами-”неокислителями” вытесняет водород из кислот, а с кислотами-”окислителями” — образуются продукты восстановления серы и азота):
3) С оксидами (при нагревании):
Cоединения кальция
СаО — оксид кальция(II), негашеная известь
1) Взаимодействие с кислородом (см. свойства Са).
2) Термическое разложение карбоната кальция:
СаО — типичный основной оксид, взаимодействует с водой, кислотами и кислотными оксидами:
Ca(oh)2 — гидроксид кальция(II), гашеная известь
Взаимодействием оксида кальция с водой (см. выше).
1) Ca(OH)2 — растворимое основание, его раствор в воде называется известковой водой.
Диссоциация: Сa(OH)2 Ca 2 +2OH
2) Реакции с кислотами, кислотными оксидами и солями:
[осадок исчезает при дальнейшем пропускании углекислого газа:
Гидрид кальция CaH2 и карбид кальция СаС2
Взаимодействие кальция с водородом и углеродом (см. выше).
Карбид кальция, кроме того, получают взаимодействием оксида кальция с углеродом при нагревании:
Наиболее важным является взаимодействие с водой:
13.3. Жесткость воды и способы ее устранения
Жесткость воды — совокупность свойств, обусловленных содержанием в ней ионов Са 2 и Mg 2 .
Количественно выражается суммой миллиэквивалентов этих ионов в 1 л воды. Один миллиэквивалент жесткости соответствует 20,04 мг/л Ca 2+ или 12,16 мг/л Mg 2+ . Мягкая вода имеет общую жесткость менее 4 мэкв/л, жесткая — более 8 мэкв/л.
В жесткой воде плохо развариваются продукты питания, так как катионы кальция с белками пищи образуют нерастворимые соединения.
Постоянное употребление жесткой воды может привести к отложению солей (мочекаменная болезнь) в организме человека. В то же время мягкая вода плохо влияет на состояние зубной эмали. Жесткая вода из-за образования накипи непригодна для использования в паровых котлах, вредна для металлических конструкций, трубопроводов. В жесткой воде плохо мылится мыло, так как оно связывается ионами Сa 2 , Mg 2 , и пена образуется лишь после полного осаждения этих ионов:
Общая жесткость воды складывается из временной и постоянной жесткости. Различие между ними, а также способы устранения приведены в таблице:
Источник