Природа химической связи. Основные виды связи: ковалентная, ионная, водородная, металлическая, межмолекулярное взаимодействие.
Химическая связь — это взаимное притяжение атомов, приводящее к образованию молекул и кристаллов.
Частицы, которые принимают участие в образовании химических связей, могут быть атомами, молекулами или ионами.
В образовании связи могут принимать участие:
— неспаренные электроны атома;
— пара валентных электронов, находящихся на одной орбитали;
· Ковалентная связь образуется за счёт общих электронных пар, возникающих в оболочках связываемых атомов.
Образование общей пары может происходить двумя связями:
1. Обменный механизм: образующие электронные пары в равной мере принадлежат обоим атомам. Ковалентная связь, образующая между одинаковыми атомами, называется неполярной (простые вещества, газы).
Ковалентная связь, образующаяся между атомами разных элементов, которых разница ЭОковалентной полярной связью.
2.Донорно-акцепторный механизм:
донор — атом элемента, предоставляющий для образования связи пару валентных электронов;
акцептор — атом элемента, принимающий пару от соседнего атома и предоставляющий вакантную орбиталь.
Физические свойства:
Они образуют кристаллическую решетку двух видов
— атомные (прочные, твердые, с высокой температурой плавления, нелетучи, нерастворимы);
— молекулярные (в узлах решетки находится молекула, а внутри связи простые ковалентные: очень слабые, межмолекулярные. Летучие, с низкой температурой плавления).
· Ионная связь образуется за счет взаимного притяжения катионов металла и анионов неметалла. (Атом металла отдавая электроны становится катионом, а атом неметалла, принимая эти электроны, становится анионом)
Физические свойства: Ионная связь достаточно прочная. Вещества с ионной решеткой нелетучи, тугоплавкие, хрупкие.
· Водородная связь — форма ассоциации между электроотрицательным атомом и атомом водорода H, связанным ковалентно с другим электроотрицательным атомом. В качестве электроотрицательных атомов могут выступать N, O или F. Водородные связи могут быть межмолекулярными или внутримолекулярными.
· Металлическая связь (самая сильная связь) — химическая связь, образующая за счет притяжения катионов металла.
Физические свойства:
· Межмолекулярное взаимодействие — взаимодействие между электрически нейтральными молекулами или атомами.
Понравилась статья? Добавь ее в закладку (CTRL+D) и не забудь поделиться с друзьями:
Источник
10.Природа химической связи. Основные виды связи: ковалентная, ионная, водородная, металлическая, межмолекулярное взаимодействие.
По современным представлениям химическая связь между атомами имеет электростатическую природу. Под химической связью понимают электрические силы притяжения, удерживающие частицы друг около друга.
Частицы, которые принимают участие в образовании химических связей, могут быть атомами, молекулами или ионами.
Каждая химическая связь в структурных формулах представляется валентной чертой, например: H−H (связь между двумя атомами водорода) H3N−H + (связь между атомом азота молекулы аммиака и катионом водорода) (K + )−(I − ) (связь между катионом калия и иодид-ионом)
Типы химических связей
Ковалентная связь – наиболее общий вид химической связи, возникающий за счет обобществления электронной пары посредством обменного механизма, когда каждый из взаимодействующих атомов поставляет по одному электрону, или по донорно-акцепторному механизму, если электронная пара передается в общее пользование одним атомом (донором) другому атому (акцептору) (рис. 3.2).
Обменный (а) и донорно-акцепторный (б) механизмы образования ковалентной связи
Классический пример неполярной ковалентной связи (разность электроотрицательностей равна нулю) наблюдается у гомоядерных молекул: H–H, F–F. Энергия двухэлектронной двухцентровой связи лежит в пределах 200–2000 кДж∙моль –1 .
При образовании гетероатомной ковалентной связи электронная пара смещена к более электроотрицательному атому, что делает такую связь полярной. Ионность полярной связи в процентах вычисляется по эмпирическому соотношению 16(χA – χB) + 3,5(χA – χB) 2 , где χA и χB – электроотрицательности атомов А и В молекулы АВ. Кроме поляризуемостиковалентная связь обладает свойством насыщаемости – способностью атома образовывать столько ковалентных связей, сколько у него имеется энергетически доступных атомных орбиталей. О третьем свойстве ковалентной связи – направленности – речь пойдет ниже (см. метод валентных связей).
Ионная связь – частный случай ковалентной, когда образовавшаяся электронная пара полностью принадлежит более электроотрицательному атому, становящемуся анионом. Основой для выделения этой связи в отдельный тип служит то обстоятельство, что соединения с такой связью можно описывать в электростатическом приближении, считая ионную связь обусловленной притяжением положительных и отрицательных ионов. Взаимодействие ионов противоположного знака не зависит от направления, а кулоновские силы не обладают свойством насыщености. Поэтому каждый ион в ионном соединении притягивает такое число ионов противоположного знака, чтобы образовалась кристаллическая решетка ионного типа. В ионном кристалле нет молекул. Каждый ион окружен определенным числом ионов другого знака (координационное число иона). Ионные пары могут существовать в газообразном состоянии в виде полярных молекул. В газообразном состоянии NaCl имеет дипольный момент ~3∙10 –29 Кл∙м, что соответствует смещению 0,8 заряда электрона на длину связи 0,236 нм от Na к Cl, т. е. Na 0,8+ Cl 0,8– .
Металлическая связь возникает в результате частичной делокализации валентных электронов, которые достаточно свободно движутся в решетке металлов, электростатически взаимодействуя с положительно заряженными ионами. Силы связи не локализованы и не направлены, а делокализированные электроны обусловливают высокую тепло- и электропроводность.
Модель 3.1. Виды химической связи
Водородная связь. Ее образование обусловленно тем, что в результате сильного смещения электронной пары к электроотрицательному атому атом водорода, обладающий эффективным положительным зарядом, может взаимодействовать с другим электроотрицательным атомом (F, O, N, реже Cl, Br, S). Энергия такого электростатического взаимодействия составляет 20–100 кДж∙моль –1 . Водородные связи могут быть внутри- и межмолекулярными. Внутримолекулярная водородная связь образуется, например, в ацетилацетоне и сопровождается замыканием цикла (рис. 3.3).
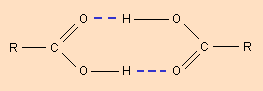
Молекулы карбоновых кислот в неполярных растворителях димеризуются за счет двух межмолекулярных водородных связей (рис. 3.4).
Образование внутримолекулярной водородной связи
Образование межмолекулярной водородной связи
Исключительно важную роль водородная связь играет в биологических макромолекулах, таких неорганических соединениях как H2O, H2F2, NH3. За счет водородных связей вода характеризуется столь высокими по сравнению с H2Э (Э = S, Se, Te) температурами плавления и кипения. Если бы водородные связи отсутствовали, то вода плавилась бы при –100 °С, а кипела при –80 °С.
Химическая связь в твердых телах. Свойства твердых веществ определяются природой частиц, занимающих узлы кристаллической решетки и типом взаимодействия между ними.
Твердые аргон и метан образуют атомные и молекулярные кристаллы соответственно. Поскольку силы между атомами и молекулами в этих решетках относятся к типу слабых ван-дер-ваальсовых, такие вещества плавятся при довольно низких температурах. Большая часть веществ, которые при комнатной температуре находятся в жидком и газообразном состоянии, при низких температурах образуют молекулярные кристаллы.
Температуры плавления ионных кристаллов выше, чем атомных и молекулярных, поскольку электростатические силы, действующие между ионами, намного превышают слабые ван-дер-ваальсовы силы. Ионные соединения более твердые и хрупкие. Такие кристаллы образуются элементами с сильно различающимися электроотрицательностями (например, галогениды щелочных металлов). Ионные кристаллы, содержащие многоатомные ионы, имеют более низкие температуры плавления; так для NaCl tпл. = 801 °C, а для NaNO3 tпл = 306,5 °C.
В ковалентных кристаллах решетка построена из атомов, соединенных ковалентной связью, поэтому эти кристаллы обладают высокими твердостью, температурой плавления и низкими тепло- и электропроводностью.
Кристаллические решетки, образуемые металлами, называются металлическими. В узлах таких решеток находятся положительные ионы металлов, в межузлиях – валентные электроны (электронный газ).
Наибольшую температуру плавления из металлов имеют d-элементы, что объясняется наличием в кристаллах этих элементов ковалентной связи, образованной неспаренными d-электронами, помимо металлической, образованнной s-электронами.
Источник