Современное представление о природе химической связи. Типы химической связи
Природа химической связи едина: она имеет электрическое происхождение. Химическое взаимодействие обусловлено обменно-спиновым взаимодействием между электронами атомов, участвующих в образовании химической связи. Проявление сил химического взаимодействия весьма многообразно. Различают следующие основные типы химических связей: 1) ионная (электровалентная, гетерополярная) химическая связь; 2) ковалентная (атомная, гомеополярная) химическая связь, в том числе донорно-акцепторная (координационная); 3) металлическая связь (существует в металлах); 4) межмолекулярное взаимодействие (в том числе водородная связь). Все эти связи важны, особенно первые три типа. В общем случае характер связи между атомами элементов определяется различием величин их электроотрицательности, которая представляет собой сумму энергий ионизации элемента и его сродства к электрону. Между разностью электроотрицательностей связывающихся атомов и сдвигом электронного облака существует зависимость: чем больше разность электроотрицательностей атомов, тем больше и степень ионности образующейся связи, которую обычно оценивают в процентах.
Атомная связь (ковалентная связь)
Льюис и Ленгмюр в 1916 г. на основе теории строения электронной оболочки Н. Бора предложили новую теорию химической связи – теорию ковалентной связи, которая позволяет охватить практически все разновидности химической связи. Согласно этой теории, атомы в молекуле связаны между собой за счет образования общих электронных пар. При этом количество электронов, отдаваемых атомами для образования связывающих пар, определяет их степень окисления. Например, на рис. 3.1 показано образование молекул фтора.
Рис. 3.1. Образование молекулы F2
Позднее, в 1927 г. Лондон и Гейтлер развили эту теорию. Они провели квантовомеханический расчет энергии для молекулы водорода, используя уравнения Шредингера, и показали, что атомы водорода могут образовать молекулу лишь в том случае, если их электроны будут иметь противоположные по знаку спины. Если спины параллельны, то атомы будут отталкиваться и химическая связь не образуется.
Расчет впервые показал подлинную причину возникновения химической связи: стремление атомов к устойчивым двух- и восьми- электронным оболочкам благородных газов, а электрические силы, действующие между ядрами и движущимися электронами, обусловливают соединение атомов в молекулы.
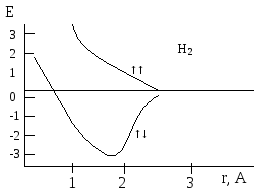
Рассмотрим образование молекулы водорода: Н+Н = Н2 + 431 кДж/моль. Молекула Н2 включает два протона и два электрона. В ней действуют силы: две силы отталкивания между протонами и электронами и 4 силы притяжения между протонами и электронами
Рис 3.2.Кривые потенциальной энергии для молекулы водорода
Рис. 3.3. Перекрывание электронных облаков в молекуле водорода
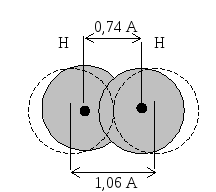
При сближении двух атомов водорода электроны стремятся попасть в межъядерное пространство вследствие электрического притяжения ядрами. На это проникновение влияет их спин. Возможны два случая (рис. 3.2, 3.3): а)спины параллельны (электроны отталкиваются, нет межатомного связывания), кривая 1 – потенциальная энергия системы при сближении атомов А и В растет; б) кривая 2 – спины направлены в противоположные стороны – сила притяжения между электронами значительно превосходит силу отталкивания их как одноименных зарядов, и оба электрона будут находиться в межъядерном пространстве, что приводит к появлению межатомной силы притяжения, которая называется ковалентной связью. Между ядрами появляется повышенная электронная плотность. Таким образом, ковалентная связь образована двумя электронами с антипараллельными спинами, движущимися в поле двух ядер. Это энергетически более выгодно, чем движение каждого электрона в поле своих ядер, происходит натекание электронной плотности в межъядерное пространство, и ядра как бы стягиваются. Происходит сближение ядер и перекрывание облаков. В молекуле Н2 r(Н1 – Н2) = 0,74 Å, в то время как сумма двух радиусов, определенных по Бору, составляет 0,53+ +0,53 = 1,06 Å . Чем больше область перекрывания, тем прочнее связь, тем устойчивее молекула.
Спиновая теория валентности была развита Гейтлером, Лондоном, Слейтером и Полингом, выполнившими квантовомеханические расчеты и показавшими роль спина. Эта идея спаривания электронов была высказана еще в 90 г. XIX в. Н.А. Морозовым. Он писал: «Во всех случаях, где обнаруживается соединение друг с другом пары однородных пунктов атомного сцепления, оно происходит путем спаривания их зарядов, как бы слившихся в один». Работами Гейтлера, Лондона, Полинга была разработана так называемая теория валентных связей или теория локализованных пар, которая получила широкое распространение для описания образования химической связи во многих соединениях. В настоящее время широко применяют два подхода к рассмотрению системы их химически связанных атомов, две теории химической связи: метод валентных связей (МВС) и метод молекулярных орбиталей (ММО).
Метод валентных связей (МВС) или метод локализованных электронных пар. Основные положения МВС: а) связывающее звено между атомами – общие электронные пары, каждая из которых образуется за счет перекрывания по одному электронному облаку от двух атомов и локализованы между ядрами этих атомов; б) обобщаться могут лишь неспаренные электроны; в) образование связи между неспаренными электронами двух атомов возможно лишь при антипараллельных спинах; г) образование общей пары электронов вызывает в пространстве между ядрами (по линии связи) повышение концентрации электронной плотности (причина связи); д) образующаяся связь – двухцентровая, и пара электронов находится на энергетическом уровне, общем для всей молекулы; е) общая пара – единица химической связи – единица валентности каждого из двух атомов; ж) число общих электронных пар у данного атома с другими атомами определяет число валентных связей.
Основные свойства ковалентной связи. Направленность. Идея Полинга: связи образуются в направлении максимального перекрывания электронных облаков вдоль линии, соединяющей ядра взаимодействующих атомов. Для s-электронов направление не имеет значения. Для р-электронов уже не безразлично, в каком направлении приближается другой атом. Таким образом, конфигурация молекулы из двух и более атомов будет определяться взаимным расположением АО, участвующих в образовании химической связи. Например, молекулу воды ранее (доквантовая теория) считали линейной. Однако экспериментальные данные свидетельствовали, что угол между связями О―Н равен 105º.
Угловая структура Н2О легко объясняется с учетом направления 2р-орбиталей кислорода (они направлены под углом 90º). Увеличение угла до 105º объясняется эффектом расталкивания электронных облаков и ядер водорода. Аналогично структура NH3 в виде тетраэдра объясняется участием в связи трех 2р-АО атома азота, направленных под углом друг к другу в 90º. Для объяснения структурных особенностей тех или иных молекул в МВС получила широкое распространение концепция гибридизации АО. Которая подробно будет рассмотрена далее (рис. 3.4).














Рz 



N(2рx, 2рy, 2рz)
у H(1S) NH3
Рис. 3.4.Схемы образования молекул:
а- воды из s-орбиталей водорода и негибридных р-орбиталей кислорода (2рХ , 2рУ); б – аммиака из s-орбиталей водорода и негибридных р-орби- талей азота (2рХ , 2рУ , 2рZ)
Насыщаемость ковалентной связи. Чем она вызвана? Почему образуется строго определенное число связей? Почему есть Н2, а не Н3 и т. д.? Причина насыщаемости – ограниченное число неспаренных электронов и принцип Паули.
Например, может ли молекула Н2 присоединить еще один атом водорода Н2 + Н → Н3 МВС утверждает, что образование такой молекулы исключается, так как молекула Н2 насыщена и все валентные возможности (неспаренные электроны) связанных в молекулу атомов водорода исчерпаны.
Другой пример, нет неспаренных электронов, нет и связи. Взаимодействие атомов гелия исключается, так как наборы электронов дадут совпадающие спины, что приведет к преобладанию компоненты отталкивания.


По МВС, если у атома нет неспаренных электронов, то взаимодействие между ними исключается. Но вот интересный пример: Be ↑↓ 2s 2 – нет неспаренных электронов, а дает BeCl2. У Ве есть вакантные орбитали, и один из s-электронов возбуждается и переходит на р-орбиталь. Такой Ве* уже может взаимодействовать с образованием двух ковалентных связей.
Ве 1s 2 2s 2 → Ве* 1s 2 2s 1 2p 1
Источник
2. Природа и типы химических связей
Атомы большинства химических элементов не могут существовать в изолированном состоянии. Они соединяются между собой и образуют молекулы или кристаллы (атомные, металлические, ионные).
Химическая связь — это электростатическое взаимодействие атомов, в результате которого они объединяются в более сложные комплексы (ионы, радикалы, молекулы, кристаллы).
Образование химической связи происходит самопроизвольно, и при этом всегда наблюдается выделение энергии. Это значит, что полная энергия образовавшейся системы меньше, чем общая энергия отдельных атомов. Стремление системы к минимуму энергии является главной причиной возникновения химической связи между атомами.
В образовании химической связи, как правило, участвуют электроны, расположенные на наружном энергетическом уровне и слабо связанные с ядром.
Благородные газы не образуют химических связей. Они существуют в виде изолированных атомов (одноатомных молекул). Наличие химической инертности благородных газов, отличающихся от других атомов заполненным внешним энергетическим уровнем, позволило учёным прийти к выводу, что при образовании химических связей атомы стремятся к завершению своего внешнего электронного уровня.
В основе химической связи всегда лежит электростатическое взаимодействие заряженных частиц — ядер и электронов. Образование химической связи связано с перекрыванием электронных орбиталей и перераспределением электронной плотности между взаимодействующими атомами.
В зависимости от разности электроотрицательностей связанных атомов возможно возникновение трёх типов химической связи: ковалентной , ионной и металлической .
Ковалентная связь возникает между атомами неметаллов, т. е. между атомами с высокой электроотрицательностью. При взаимодействии одинаковых атомов неметаллов (\(χ\) больше \(2\), и электроотрицательности примерно равны) образуется ковалентная неполярная связь. Если взаимодействуют атомы, для которых разность \(χ\) от \(0,4\) до \(2\), то образуется ковалентная полярная связь.
Ионная связь возникает между атомами металлов и неметаллов, электроотрицательности которых различаются значительно (разность \(χ\) больше \(2\)).
Источник