Урок №22. Электронное строение и химические связи атома углерода
2. Органическим соединениям свойственны ковалентные связи. Ковалентная связь в молекулах характеризуется: энергией, длиной, насыщаемостью и пространственной направленностью.
а) Из курса химии 8 класса вы знаете, что ковалентная связь образуется за счёт перекрывания электронных облаков, при этом выделяется энергия , чем больше перекрывание, тем больше выделяется энергии и тем прочнее связь.
Типы перекрываний электронных облаков в порядке возрастания их прочности и энергии, выделяемой при образовании:
б) Длина связи определяется расстоянием между центрами ядер связывающихся атомов и измеряется в нанометрах (1 нм = 10 -9 м). С повышением кратности связи (одинарная, двойная, тройная) длина становится меньше, а энергия выше:
в) Под насыщаемостью связи понимают способность образовывать строго определённое количество ковалентных связей.
г) Направленность ковалентной связи определяется взаимным расположением электронных облаков, участвующих в образовании химической связи. Ковалентная связь образуется в направлении максимального перекрывания электронных орбиталей взаимодействующих атомов.
Вы уже знаете, что атом углерода содержит на внешнем уровне четыре валентных электрона:
1 электрон на s – орбитали сферической формы
3 электрона на трёх p – орбиталях в форме гантели и расположены под углом 90˚.
Таким образом можно предположить, что в молекуле метана CH 4 атом углерода не может образовать 4 одинаковых связи с четырьмя атомами водорода (1 атом водорода имеет 1 электрон на s – орбитали сферической формы). Однако экспериментально доказано, что в молекуле метана все связи С – Н равноценны и направлены к вершинам правильного тетраэдра под углом 109˚28`.
В 1931 г. американский учёный Л. Полинг доказал, что в молекуле метана в момент образования молекулы электронные облака смешиваются и образуют гибридные электронные облака, происходит процесс гибридизации.
Гибридизация – процесс смешения разных, но близких по энергии, орбиталей данного атома, с возникновением того же числа новых гибридных орбиталей, одинаковых по форме и энергии.
В зависимости от числа вступивших в гибридизацию орбиталей атом углерода может находиться в одном их трёх состояний гибридизации: sp 3 , sp 2 , sp.
sp 3 – гибридизация: происходит смешение одной s и трёх p орбиталей. Образуются четыре одинаковые гибридные орбитали, расположенные относительно друг друга под тетраэдрическим углом 109˚28`. Образуются 4 ковалентные σ – связи.
Рисунок. Схема процесса образования σ-связей при sp 3 – гибридизации
Рисунок. Строение молекулы метана СН 4 (тетраэдрическое)
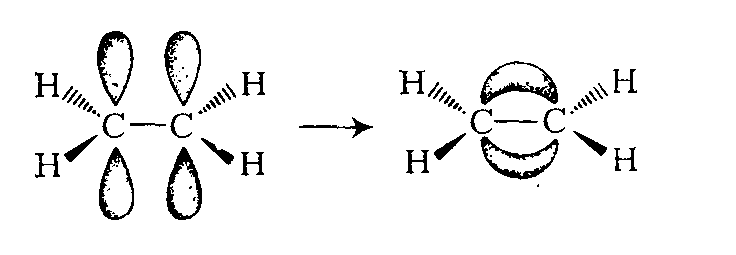
sp 2 – гибридизация: происходит смешение одной s и двух p орбиталей. Образуются три одинаковые гибридные орбитали, они расположены относительно друг друга под углом 120˚, лежат в одной плоскости и стремятся к вершинам треугольника. Образуются 3 ковалентные σ – связи.
Оставшаяся одна негибридизованная орбиталь расположена перпендикулярно плоскости образования σ – связей и участвует в образовании π — связи.
Расстояние между атомами углерода при двойной связи С=С сокращается по сравнению с одинарной (С-С) в случае sp 3 – гибридизаци и с 0,154 нм до 0,134 нм
Рисунок. Схема процесса образования σ-связей при sp 2 – гибридизации
Рисунок. Строение молекулы этилена Н 2 С=СН 2 (плоское тригональное)
а) Схема образования σ-связей при sp 2 – гибридизации
б) Схема образования π-связей при sp 2 – гибридизации
sp – гибридизация: происходит смешение одной s и одной p орбитали. Образуются две одинаковые гибридные орбитали, они расположены относительно друг друга под углом 180˚, лежат на одной линии. Образуются 2 ковалентные σ – связи.
Оставшиеся две негибридизованные орбитали расположены во взаимно перпендикулярных плоскостях и образуют две π- связи.
Расстояние между атомами углерода при тро йной связи С≡С сокращается по сравнению с одинарной (С-С) в случае sp 3 – гибридизации с 0,154 нм до 0,1 2 нм
Рисунок. Схема процесса образования σ-связей при sp – гибридизации
Рисунок. Строение молекулы ацетилена Н С≡С Н (линейное)
а) Схема образования π-связей при sp – гибридизации
б) Схема образования σ-связей при sp – гибридизации
Направленность гибридных орбиталей в пространстве, а, следовательно, и геометрическое строение молекул зависят от типа гибридизации. На форму молекулы в пространстве влияет направленность только σ – связей.
СТЕПЕНЬ ОКИСЛЕНИЯ АТОМА УГЛЕРОДА
Для атома углерода в органических соединениях характерны степени окисления от -4 до +4.
Пример №2. Укажите степени окисления всех элементов в CH 3 -CH 2 -OH
Решение . Нахождение степеней окисления в органических соединениях имеет свою специфику. В частности, необходимо отдельно находить степени окисления для каждого атома углерода. Рассуждать можно следующим образом. Рассмотрим, например, атом углерода в составе метильной группы (СН 3 –). Данный атом С соединен с 3 атомами водорода и соседним атомом углерода. По связи С-Н происходит смещение электронной плотности в сторону атома углерода (т. к. электроотрицательность углерода превосходит ЭО водорода). Если бы это смещение было полным, атом углерода приобрел бы заряд -3.
Атом С в составе группы -СН 2 ОН связан с двумя атомами водорода (смещение электронной плотности в сторону С), одним атомом кислорода (смещение электронной плотности в сторону О) и одним атомом углерода (можно считать, что смещения эл. плотности в этом случае не происходит). Степень окисления углерода равна -2 +1 +0 = -1.
Ответ: С -3 H +1 3 C -1 H +1 2 O -2 H +1 .
Простая и кратная ковалентные связи
Способность атома углерода иметь разные степени окисления и лёгкость гибридизации позволяет атому углерода образовывать одинарные, и кратные (двойные и тройные связи) не только с другими атомами углерода, но и с атомами других элементов-органогенов:
СН 3 – СН 3 (1 σ – сигма связь С-С)
CH 2 =CH 2 (1 σ – сигма связь С-С и 1 π – пи связь С-С)
CH ≡ CH (1 σ – сигма связь С-С и 2 π – пи связи С-С)
Источник
2. Ковалентные связи в соединениях углерода
Ковалентные связи, свойства, способы и причины образования – школьная программа. Напомню, лишь что: 1. Образование связи между атомами можно рассматривать как результат перекрывания их атомных орбиталей, при этом, чем оно эффективнее (больше интеграл перекрывания), тем прочнее связь. Согласно расчетным данным, относительные эффективности перекрывания атомных орбиталей Sотн возрастают следующим образом: 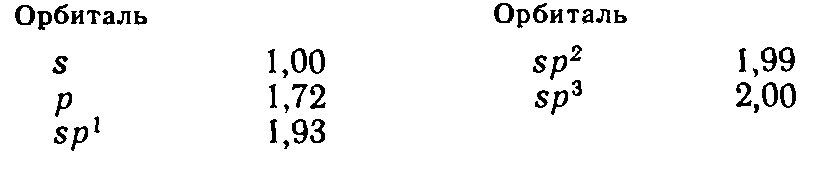

Источник