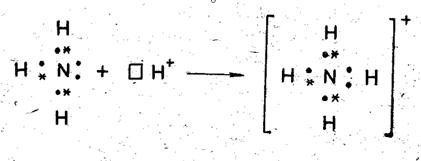Химическая связь, ее природа и типы
Все вещества делятся на простые (состоящие из атомов одного элемента) и сложные (из атомов двух и более элементов). Простые вещества подразделяются на металлы и неметаллы (H, B, C, N, O, F, Si, P, S, Cl, As, Se, Br, Te, I, At, He, Ne, Ar, Kr, Xe и Rn). Сложные вещества делятся на неорганические и органические. Вещества могут быть низкомолекулярными (состоят из небольших молекул) и высокомолекулярными или полимерными (состоят из макромолекул – больших молекул, построенных из повторяющихся звеньев-мономеров, число которых может достигать десятков тысяч и более).
Язык химии – химические символы элементов, формулы, уравнения. Символы химических элементов, их написание и названия приведены в периодической таблице элементов Менделеева. Так как уже известно более 6 миллионов химических соединений, то возникает необходимость в их классификации, разработке единой и строгой системы принципов построения их формул и названий. Такой системой в химии является химическая номенклатура. Наиболее используемая – номенклатура ИЮПАК, называемая международной.
По правилам номенклатуры ИЮПАК каждое вещество в соответствие с его формулой получает систематическое название, полностью отражающее его состав. Таких равноценных названий может быть несколько. Например, SO3 — оксид серы (VI) или триоксид серы. Для некоторых соединений (распространенные кислоты, их соли и др.) допускается использование традиционных названий. Например, H2SO4 — серная кислота, систематическое – тетрасульфат (VI) водорода. Кроме того, эти же правила допускают использование и небольшого числа несистемных специальных названий. Например, аммиак, аммоний, гидразин. На практике, в технической и учебной литературе применяются и другие несистемные названия: тривиальные – соляная кислота, сода, негашеная известь, едкий натр и др., минералогические – рутил, малахит, молибденит и др.
Химическая связь – связь, возникшая между атомами вследствие перераспределения между ними электронов (электронных облаков).
Основным условием образования химической связи является понижение полной энергии многоатомной системы в сравнении с суммарной энергией изолированных атомов.
Химическая связь – это взаимодействие атомов, обусловленное перекрыванием их электронных облаков и сопровождающееся уменьшением полной энергии системы.
Различают 3 типа химической связи: ковалентная, ионная и металлическая. Основными параметрами химической связи являются: длина (межъядерное расстояние связанных атомов), прочность (энергия, выделяющаяся при образовании или затрачиваемая на разрыв связи), валентный угол или угол связи (угол между прямыми, проходящими через ядра связанных атомов), полярность (дипольный момент).
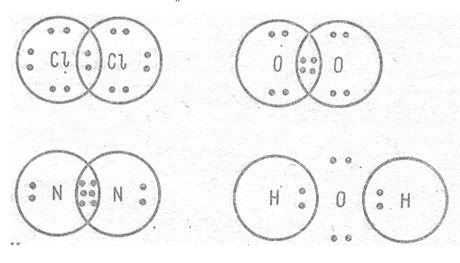
Ковалентная связь (атомная связь, гомеополярная связь) –связь, обусловленная наличием электронных пар, общих для соединяющихся атомов.
Рис. 4.1. Ковалентная связь
Ионная связь – тип химической связи, энергия которой в основном определяется электростатическими силами притяжения противоположно заряженных ионов (катионов и анионов).
Более строго ее следует рассматривать как предельный случай ковалентной полярной связи, так как реально полного разделения зарядов, т.е. перехода электрона от одного атома к другому, никогда не происходит.
Ионная связь в отличие от ковалентной связи характеризуется ненаправленностью и ненасыщенностью (ионы представляются в виде электрических зарядов со сферической симметрией).
В целом ионное соединение представляют как гигантскую ассоциацию ионов противоположных знаков, а химические формулы ионных соединений – как простейшее соотношение между числом атомов элементов, входящих в состав такой ассоциации.
Металлическая связь по своей природе подобна ковалентной связи: оба типа связи основаны на обобществлении валентных электронов. Однако в атомах металло количество таких электронов значительно меньше количества свободных орбиталей, поэтому они могут вследствие невысоких энергий ионизации металлов свободно переходить из одной орбитали в другую. Благодаря свободному перемещению электронов по всему объему металлическая связь является нелокализованной и ненеправленной, а металлы обладают высокой электро- и теплопроводностью.
Упрощенно металл можно рассматривать как гигантскую молекулу, построенную из катионов, связанных меду собою относительно свободно перемещающимися между ними валентными электронами (электронным газом).
Донорно-акцепторная связь. Образование ковалентной связи возможно и при взаимодействии атомов, один из которых имеет пару электронов, называемую неподеленной, а другой – свободную орбиталь. Эта электронная пара становится общей для обоих атомов. Донор – атом, предоставляющий электронную пару, а участвующий в обоществлении пары за счет свободной орбитали атом – акцептор. Такая связь называется донорно-акцепторной.
Классический пример – образование иона аммония:
Рис. 4.2. Донорно-акцепторная связь
Источник
Природа химической связи. Кривая зависимости энергии от межъядерного расстояния. Типы химической связи: ковалентная, ионная, металлическая, водородная.
Кривая зависимости энергии от межъядерного расстояния:


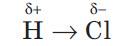

- Метод валентных связей. Основные положения метода валентных связей. Ковалентная связь. Ее характеристики: длина связи, энергия связи, кратность, насыщаемость и направленность. Обменный и донорно-акцепторный механизм.— и-связывание. Теория гибридизации. Пространственное строение молекул.
Метод валентных связей (локализованных электронных пар) предполагает, что каждая пара атомов в молекуле удерживается вместе при помощи одной или нескольких общих электронных пар. Поэтому химическая связь представляется двухэлектронной и двухцентровой, т. е. локализована между двумя атомами. В структурных формулах соединений обозначается черточкой: H-Cl, H-H, H-O-H В её основе лежат следующие положения:
- Химическая связь образуется двумя электронами с разными спинами, эта пара принадлежит двум атомам.
- Связь тем прочнее, чем в большей степени перекрываются взаимодействующие электронные облака.
- Образование химической связи может происходить двумя механизмами:
Обменный механизм представляет собой образование связи между двумя неспаренными электронами разных атомов. Возможен и другой механизм образования ковалентной связи за счет неподелённых электронных пар одного атома и свободных орбиталей другого. Такая связь называется донорно-акцепторной и отличается от обычной ковалентной связи только происхождением электронной пары. Связь, возникающая при взаимодействии электронов с образованием обобщенных электронных пар, называется ковалентной. В случае если взаимодействующие атомы имеют равные значения электроотрицательности, общая электронная пара в равной степени принадлежит обоим атомам, то есть находится на равном расстоянии от обоих атомов. Такая ковалентная связь называется неполярной. Она имеет место в простых веществах-неметаллах: H2, О2, N2, Cl2 и т. д. При взаимодействии атомов, имеющих различные значения электроотрицательности, например водорода и хлора, общая электронная пара оказывается смещенной в сторону атома с большей электроотрицательностью, то есть в сторону хлора. Атом хлора приобретает частичный отрицательный заряд, а атом водорода — частичный положительный. Это пример полярной ковалентной связи.
Источник
2. Природа и типы химических связей
Атомы большинства химических элементов не могут существовать в изолированном состоянии. Они соединяются между собой и образуют молекулы или кристаллы (атомные, металлические, ионные).
Химическая связь — это электростатическое взаимодействие атомов, в результате которого они объединяются в более сложные комплексы (ионы, радикалы, молекулы, кристаллы).
Образование химической связи происходит самопроизвольно, и при этом всегда наблюдается выделение энергии. Это значит, что полная энергия образовавшейся системы меньше, чем общая энергия отдельных атомов. Стремление системы к минимуму энергии является главной причиной возникновения химической связи между атомами.
В образовании химической связи, как правило, участвуют электроны, расположенные на наружном энергетическом уровне и слабо связанные с ядром.
Благородные газы не образуют химических связей. Они существуют в виде изолированных атомов (одноатомных молекул). Наличие химической инертности благородных газов, отличающихся от других атомов заполненным внешним энергетическим уровнем, позволило учёным прийти к выводу, что при образовании химических связей атомы стремятся к завершению своего внешнего электронного уровня.
В основе химической связи всегда лежит электростатическое взаимодействие заряженных частиц — ядер и электронов. Образование химической связи связано с перекрыванием электронных орбиталей и перераспределением электронной плотности между взаимодействующими атомами.
В зависимости от разности электроотрицательностей связанных атомов возможно возникновение трёх типов химической связи: ковалентной , ионной и металлической .
Ковалентная связь возникает между атомами неметаллов, т. е. между атомами с высокой электроотрицательностью. При взаимодействии одинаковых атомов неметаллов (\(χ\) больше \(2\), и электроотрицательности примерно равны) образуется ковалентная неполярная связь. Если взаимодействуют атомы, для которых разность \(χ\) от \(0,4\) до \(2\), то образуется ковалентная полярная связь.
Ионная связь возникает между атомами металлов и неметаллов, электроотрицательности которых различаются значительно (разность \(χ\) больше \(2\)).
Источник