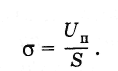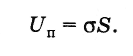§ 7.3. Поверхностная энергия
Когда вода из опрокинутого стакана разливается по полу или когда мы выдуваем мыльный пузырь, поверхность жидкости увеличивается. При этом возникают новые участки разреженного поверхностного слоя. Среднее расстояние между молекулами при их переходе из глубины жидкости на ее поверхность возрастает. Силы притяжения между молекулами жидкости совершают при этом отрицательную работу. В соответствии с законами механики это означает увеличение потенциальной энергии молекул, перешедших из глубины жидкости на поверхность.
Молекулы поверхностного слоя жидкости обладают избытком потенциальной энергии по сравнению с энергией, которой эти молекулы обладали бы, находясь внутри жидкости.
Избыточную потенциальную энергию, которой обладают молекулы на поверхности жидкости, называют поверхностной энергией.
С макроскопической (термодинамической) точки зрения поверхностная энергия — это один из видов внутренней энергии, отсутствующая у газов, но имеющаяся у жидкостей*.
* Поверхностной энергией обладают также твердые тела. Ведь особые условия, в которых находятся молекулы на поверхности жидкости, характерны и для поверхности твердых тел.
При растекании воды из опрокинутого стакана по полу увеличение энергии молекул поверхностного слоя происходит за счет работы силы тяжести. А при выдувании мыльного пузыря увеличение потенциальной энергии молекул поверхностного слоя происходит за счет работы сил давления воздуха в пузыре. Ведь для того чтобы пузырь раздувался, давление воздуха в нем должно быть больше атмосферного.
Поверхностное натяжение
Молекулы на всех участках поверхностного слоя жидкости находятся в одинаковых условиях, и два участка одинаковой площади обладают одинаковой поверхностной энергией. Это означает, что поверхностная энергия прямо пропорциональна площади поверхности жидкости. Поэтому отношение поверхностной энергии Un участка поверхности жидкости к площади S этого участка есть величина постоянная, не зависящая от площади S. Эту величину называют коэффициентом поверхностного натяжения или просто поверхностным натяжением и обозначают буквой σ:
(7.3.1)
Поверхностное натяжение представляет собой удельную поверхностную энергию, т. е. энергию, приходящуюся на поверхность единичной площади.
В СИ поверхностное натяжение выражается в джоулях на квадратный метр (Дж/м 2 ). Так как 1 Дж = 1 Н · м, то поверхностное натяжение можно выражать ив ньютонах на метр (Н/м).
Поверхностное натяжение а зависит от природы граничащих сред и от температуры. По мере повышения температуры различие между жидкостью и ее насыщенным паром постепенно стирается и при критической температуре исчезает совсем. Соответственно поверхностное натяжение для границы жидкость — насыщенный пар с повышением температуры уменьшается и при критической температуре становится равным нулю.
Из формулы (7.3.1) следует, что
(7.3.2)
Следовательно, при уменьшении площади поверхности поверхностная энергия уменьшается. Молекулярные силы совершают при этом положительную работу, так как расстояния между молекулами при переходе их из поверхностного слоя в глубь жидкости уменьшаются. В состоянии равновесия жидкости поверхностная энергия имеет минимальное значение. Это соответствует минимальной при заданном объеме площади поверхности. Поэтому, как говорилось в § 7.1, жидкость принимает форму шара, если нет других сил, искажающих ее естественную сферическую форму.
В поверхностном слое жидкости запасена энергия, прямо пропорциональная площади поверхности. Поверхностная энергия — одна из форм внутренней энергии.
Источник
Лекция 2. Поверхностные явления
Дисперсные частицы и дисперсионная среда относятся к различным фазам. Система может состоять из разных фаз только в том случае, если межмолекулярные взаимодействия в граничных фазах различны. 

2.2. Поверхностное натяжение
Наиболее важной характеристикой поверхности является поверхностное натяжение. Оно характеризует избыток поверхностной энергии, приходящийся на единицу площади межфазной поверхности. Поверхностное натяжение (σ) равно термодинамически обратимой, изотермической работе, которую надо совершить, чтобы увеличить площадь межфазной поверхности на единицу. 

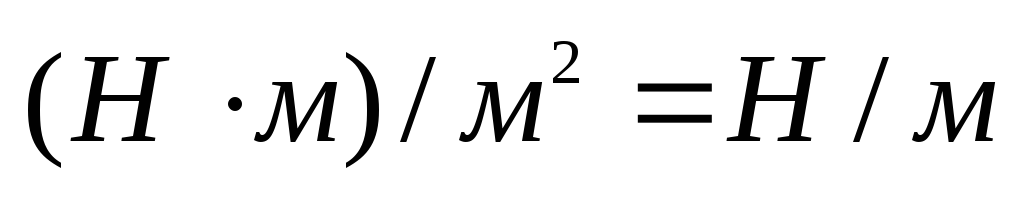





Источник