Природа химической связи
Химическая связь -это сила, удерживающая вместе два или несколько атомов, ионов, молекул или любую комбинацию из них. По своей природе она представляет собой электростатическую силу притяжения между отрицательно заряженными электронами и положительно заряженными ядрами. Величина этой силы притяжения зависит главным образом от электронной конфигурации внешней оболочки атомов (см. гл. 1). Например, благородные газы с трудом образуют химические связи, потому что они имеют устойчивую внешнюю электронную оболочку. В отличие от этого элементы, атомы которых имеют во внешней оболочке только один электрон, легко образуют связи. Примером таких элементов является водород.
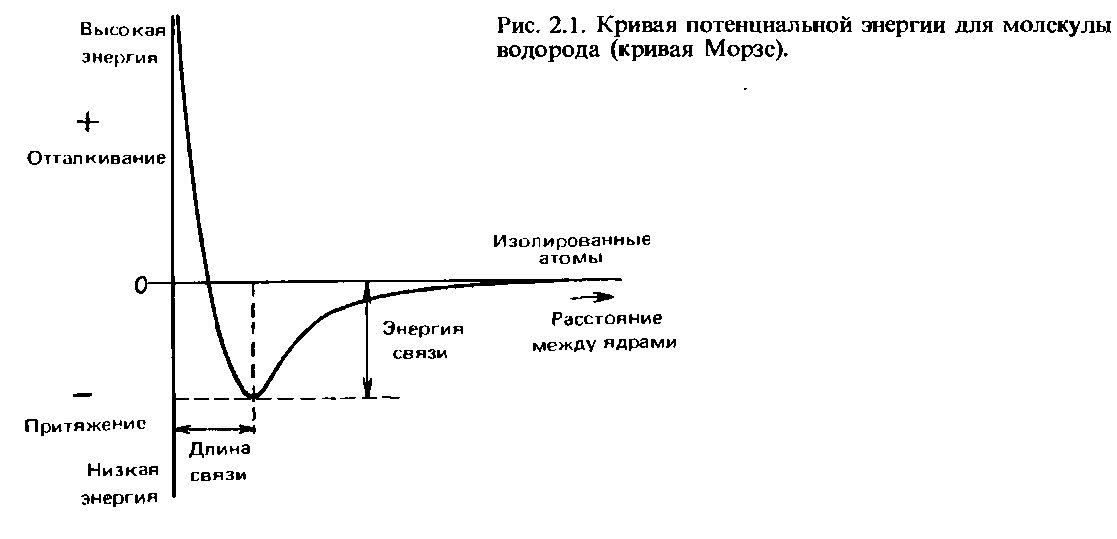
Когда два атома водорода сближаются на малое расстояние, они притягиваются друг к другу. Однако, если они сближаются слишком сильно, между ними возникает отталкивание. Оптимальным оказывается такое расстояние, при котором силы притяжения и отталкивания уравновешиваются. Ha таком расстоянии потенциальная энергия двух взаимодействующих атомов минимальна. Это расстояние называется длиной связи. Мы еще вернемся к ее более подробному обсуждению в данной главе. Ha рис. 2.1 показана зависимость потенциальной энергии от расстояния между ядрами. Кривая такого типа называется кривой Морзе. Энергия, необходимая для того, чтобы разделить два связанных между собой атома и удалить их друг от друга на расстояние, на котором они уже не испытывают силы притяжения друг к другу, называется энергия связи, или энергия диссоциации связи. Ее экспериментальное определение осуществляется путем измерения энтальпии связи (с этим понятием мы познакомимся в гл. 5).
Способность атома образовывать химические связи называется его валентностью. Впрочем, это понятие считается сильно устаревшим, поскольку в настоящее время гораздо чаще принято рассматривать химическую связь не вообще, а с учетом ее конкретного типа. Электроны, пршшмающие участие в образовании химических связей, называются валентными электронами. Эти электроны находятся на самых высоких по энергии орбиталях атома (см. гл. 1). Внешняя оболочка атома, которая содержит эти орбитали, называется валентной оболочкой.
Электронная теория валентности. Современные представления о природе химической связи основаны на электронной теории валентности. Эту теорию разработали независимо Г. Н. Льюис и В. Коссель в 1916 г. Согласно электронной теории валентности, атомы, образуя связи, приближаются к достижению наиболее устойчивой (т.е. имеющей наиболее низкую энергию) электронной конфигурации. Атомы могут достичь этого двумя способами:
1. Они могут терять либо приобретать электроны, образуя ионы. Если атомы приобретают электроны, они превращаются в анионы. Если они теряют электроны, то превращаются в катионы. Анионы и катионы с заполненной внешней электронной оболочкой имеют устойчивую электронную конфигурацию. Между анионом и катионом возникает химическая связь, представляющая собой электростатическую силу притяжения. Химическая связь такого типа ранее называлась электровалентной связью; современное название ионная связь.
2. Атомы могут также приобретать устойчивые внешние электронные конфигурации путем обобществления электронов. Возникающая при этом химическая связь называется ковалентной связью. Ковалентная связь образуется в результате обобществления пары электронов, поставляемых по одному от каждого атома. Однако в некоторых молекулах или многоатомных ионах оба таких электрона могут поставляться только одним атомом. Такая разновидность ковалентной связи называется координационной, донорно-акцепторной или дативной ковалентной связью.
Правило октета. Когда атом какого-либо элемента образует химическую связь, приобретая, теряя либо обобществляя валентные электроны, его электронная конфигурация становится такой же, как у атома благородного газа, расположенного в конце того же периода, что и данный элемент, либо в конце предыдущего периода. Атомы всех благородных газов, за исключением гелия, имеют во внешней оболочке устойчивый октет (восьмерку) электронов. Поэтому образование химических связей путем достижения устойчивых электронных конфигураций, как в атомах благородных газов, составляет суть так называемого правила октета. Это правило применимо и к ионным, и к ковалентным связям.
Другие типы химической связи. Особый случай представляет собой химическая связь в металлах; ее нельзя отнести ни к ионному типу, ни к ковалентному. В твердом состоянии металлы состоят из положительно заряженных ионов, плотно упакованных в кристаллическую решетку и удерживаемых вместе свободными электронами, которые «плавают» вокруг ионов в «электронном море». Такой тип связи называется металлической связью.
Существуют еще два типа химической связи, которые тоже будут рассматриваться в данной главе. Это — водородная связь и вандерваальсовы силы. Связи этих двух типов значительно слабее, чем связи других типов.
Источник
1. Природа сил химической связи
Существует утверждение, что силы связи между атомами в молекуле могут быть поняты только на основе квантовомеханического рассмотрения этой задачи. Однако это утверждение нуждается в пояснении. Этот вывод в известном смысле справедлив, но существует очень важная теорема, доказанная независимо Фейнманом и Хеллманом и названная их именами, утверждающая, что силы, связывающие атомы в молекулу, представляют собой не что иное, как электростатические силы. Суть теоремы Фейнмана-Хеллмана заключается в том, что если известно распределение вероятности электрона в молекуле, то вычисление энергии системы (сил связи) представляет собой чисто классическую электростатическую
задачу. Конечно, рассмотрение проблемы распределения заряда в молекуле немыслимо без квантовой механики. Но если распределения заряда в молекуле известно, то остающаяся задача является чисто классической. Связи в многоатомных молекулах представляют собой сложную картину, которую можно рассмотреть с помощью двух подходов: в представлениях модели валентных связей и
| метода молекулярных орбиталей . Оба подхода являются | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| -e | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| основными | приближенными | методами расчета химиче- | |||||||||||||||||||||||||||||||||||||||||||||||||||||
| r 12 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1 | -e | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ской связи. Познакомимся кратко с этими методами. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| r B1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Обычно, в целях упрощения задачи, при описании | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| r A1 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| r B2 | молекулы | пренебрегают ее вращательным движением и | |||||||||||||||||||||||||||||||||||||||||||||||||||||
| r A2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| всеми взаимодействиями электронных и колебательных | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| движений с вращательным, что допустимо из-за малости | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| r AB | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| A | B | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| энергии вращательного движения молекулы по сравнению | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Рис.1 Схема молекулы | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| с | электронной | и колебательной энергиями. Молекулу | |||||||||||||||||||||||||||||||||||||||||||||||||||||
| водорода | обычно описывают в системе координат, в которой она | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| покоится. В этом случае уравнение Шредингера для | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| гоатомной молекулы будет иметь видмногоатомной молекулы будет иметь вид | |||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1 | ∂ 2 ψ | ∂ 2 ψ | ∂ 2 ψ | 1 | ∂ 2 | ψ | ∂ 2 ψ | ∂ 2 ψ | |||||||||||||||||||||||||||||||||||||||||||||||
| ∑ | 2 | + | 2 + | 2 | + ∑ | 2 | + | 2 + | 2 + | ||||||||||||||||||||||||||||||||||||||||||||||
| m e i | ∂ x i | ∂ y i | ∂ z i | A | m A | ∂ x A | ∂ y A | ∂ z A | |||||||||||||||||||||||||||||||||||||||||||||||
| 8 π | 2 | e | 2 | z | e | 2 | z | z | e | 2 | |||||||||||||||||||||||||||||||||||||||||||||
| A | A | B | |||||||||||||||||||||||||||||||||||||||||||||||||||||
| + | E | − | + | − | ψ = 0 | ||||||||||||||||||||||||||||||||||||||||||||||||||
| h 2 | ∑ r | ∑ r | ∑ | r | |||||||||||||||||||||||||||||||||||||||||||||||||||
| ij | 1.1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ij | iA | iA | AB | AB | |||||||||||||||||||||||||||||||||||||||||||||||||||
| где ψ – волновая функция молекулы; m e , M A | – массы электронов и ядер атомов соответст- | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
| венно; r ij – расстояние между | i-м | j-м электронами; r iA , r AB | – расстояния между i-м элек- | ||||||||||||||||||||||||||||||||||||||||||||||||||||
| троном и A-м ядром и A-м и B-м ядрами соответственно; z A , z B | – заряды ядер. В уравне- | ||||||||||||||||||||||||||||||||||||||||||||||||||||||
нии (1.1) первый член соответствует кинетической энергии электронов, причем в нем суммирование ведется по всем электронам молекулы. Второй член характеризует кинетическую (колебательную) энергию ядер. Третий член описывает потенциальную энергию отталкивания электронов друг от друга (второе слагаемое в скобках), энергию притяжения электронов к ядрам (третье слагаемое) и энергию отталкивания ядер (четвертое слагаемое). В них суммирование ведется по всем возможным различным сочетаниям пар частиц. Точное решение уравнения (1.1) невозможно, поэтому при его решении приходится делать ряд допущений. Борн и Оппенгеймер показали, что уравнение (1.1), поскольку m e
случае не учитывать, так как он превращается в константу и его следует прибавить ко всем значениям E после решения уравнения (1.2)). Второе уравнение описывает движение ядер и оно важно при рассмотрении при рассмотрении колебательных уровней молекулы. Для иллюстрации путей решения уравнения (1.2) рассмотрим самую простую молекулу – молекулу водорода. Для молекулы уравнение (1.2) будет иметь вид (см. рис. 1)
| ∑ ∂ | ψ 2 | + | ∂ | ψ 2 | + | ∂ | ψ 2 | + | 8 π | 2 m e E − | e | + | e | + | e | + | e | − e | ψ = 0 | |||
| 2 | 2 | 2 | 2 | 2 | 2 | 2 | 2 | 2 | 2 | |||||||||||||
| i = 1 | ∂ x i | ∂ y i | ∂ z i | h | r A1 | r B1 | r A2 | r B2 | r 12 | 1.3 | ||||||||||||
1.1.1 Метод валентных связей
точенного в центре между протонами, создавая, тем самым, достаточно прочную связь между атомами водорода в молекулу H 2. В связи с этим симметричную волновую функцию ψ s , описывающую электронное облако из двух электронов с антипараллельнонаправленными спинами, называют связывающей молекулярной орбиталью. В случае антисимметричной волновой функции ψ a плотность электронного облака между протонами H 2 уменьшена, что
| 5 | 4 | 6 | 1 | |||
| 6 | ||||||
| 4 | ||||||
| 3 | 3 | |||||
| 2 | ||||||
| 1 | 2 | 5 | ||||
| Рис.2 Распределение ψ s 2 — | Рис.3 Распределение ψ a 2 — | |||||
| электронной плотности в | электорнной плотности в | |||||
| молекуле H 2 для случая | молекуле H 2 для случая | |||||
| связи. | отталкивания. | |||||
приводит к образованию двух эффективных отрицательных зарядов, один из которых сосредоточен слева протона A, а другой справа от протона B. Такое расположение зарядов приводит к отталкиванию атомов водорода и поэтому антисимметричную волновую функцию ψ a , описывающую электронное облако из двух электронов с параллельными спинами, называют разрыхляющей молекулярной орбиталью. Значения ψ 2 s и ψ 2 a , т.е. распределение электронной плотности в молекуле H 2 показаны на рис.2 и 3 в виде линий, соединяющих точки равной плотности – равных значений ψ 2 . Причем большая цифра у линии означает большую плотность, большую вероятность нахождения электрона. Вышеизложенный метод Гайтлера и Лондона рассмотрения молекулы H 2 , распространенный на другие молекулы, получил название метода валентных связей (ВС). В методе ВС, исходя из экспериментального факта, что для многих молекул различные связи между соседними атомами оказываются независимыми от других атомов, молекулярная волновая функция сложной молекулы строится по аналогии с волновой функцией молекулы водорода в методе Гайтлера и Лондона. Для каждой i–й связи записывается функция вида
| ψ i = ψ Ai ( j ) ψ Bi ( k ) + ψ Ai | ( k ) ψ Bi ( j ) | 1.11 |
| где j,k – валентные электроны A и B атомов, а ψ A i ( j ) | и ψ Bi ( k ) – волновые функции этих | |
электронов в атомах A и B , число связей i в молекуле числено равно половине валентных электронов входящих в нее атомов. Полная волновая функция, отвечающая данному состоянию сложной молекулы, представляет собой линейную комбинацию функций (1.11) Метод ВС дает возможность осуществить количественный (приближенный) расчет связей, причем достигается вполне удовлетворительное согласие наблюдаемой энергии диссоциации молекул с предсказуемым им числом связей. Кроме того, метод ВС позволяет убедительно истолковывать ряд важных особенностей валентности и валентной связи (целочисленность, насыщенность, направленность и др.). Однако в ряде случаев выводы метода ВС приводят к серьезным противоречиям с опытом. Метод ВС неприменим к соединениям, содержащим некомпенсированные электроны. В частности, согласно методу ВС, двухатомные молекулы не должны обладать магнитным моментом, т.е. должны быть диамагнитны (так как все электроны в молекуле спарены). Однако из опыта известно, что молекулы O 2 и B 2 парамагнитны, т.е. обладают магнитным моментом.
Источник