- .Межмолекулярное взаимодействие
- 3.2.1.Межмолекулярные взаимодействия (силы Ван-дер-Ваальса)
- 54.Взаимодействие молекул.Природа сил молекулярного взаимодействия.График зависимости их от расстояния.
- 55.Постоянная Авогадро.Количество вещества.
- 56.Идеальный газ.Основное уравнение мкт идеального газа.
- 57.Молекулярно-кинетический смысл температуры. Энергия и скорость теплового движения молекул.
- 58.Испарение и конденсация.Насыщенные и ненасыщенные пары.
- 3. Межмолекулярное взаимодействие.
- Лекция № 6 основы химии, термодинамики. План
.Межмолекулярное взаимодействие
3.2.1.Межмолекулярные взаимодействия (силы Ван-дер-Ваальса)
В конденсированных фазах (жидкость, твердое тело) расстояние между молекулами соизмеримо с размерами самих молекул. На таких малых расстояниях проявляют себя силы электростатического взаимодействия диполей, как постоянных, так и наведенных. При этом энергия системы понижается. Межмолекулярные взаимодействия характеризуются отсутствием обмена электронами между частицами, отсутствием специфичности и насыщаемости. Энергия межмолекулярного взаимодействия сравнительно невелика, однако она вносит существенный вклад в энергетическое состояние системы, определяя в значительной степени физические и химические свойства вещества. На сравнительно больших расстояниях r между молекулами, когда электронные оболочки не перекрываются, действуют только силы притяжения. При этом возможны три механизма возникновения сил притяжения. 1. Ориентационный эффект (диполь – дипольное взаимодействие). Если молекулы полярны, то проявляется электростатическое взаимодействие двух постоянных диполей. Полярные молекулы ориентируются относительно друг друга противоположно заряженными частями, энергия притяжения прямо пропорциональна дипольным моментам (i 2 ) и обратно пропорциональна расстоянию между ними (r 6 ). Повышение температуры ослабляет это взаимодействие, так как тепловое взаимодействие стремится нарушить взаимную ориентацию молекул. 2. Индукционный эффект (взаимодействие диполь – наведенный диполь). Неполярные молекулы под действием поля полярной молекулы поляризуются, возникает индуцированный диполь. Индуцированный дипольный момент прямо пропорционален поляризуемости молекул (и д). Энергия притяжения таких молекул прямо пропорциональна дипольным моментам (д 2 ) и обратно пропорциональна расстоянию между ними (r 6 ). Так как наведение диполей происходит при любом пространственном расположении молекул, индукционный эффект от температуры не зависит. 3. Дисперсионный эффект (взаимодействие мгновенных диполей). В отличие от ориентационного и индукционного взаимодействия дисперсионный эффект имеет объяснение только в рамках квантовой механики. Его возникновение можно представить следующим образом: в процессе движения электронов распределение зарядов внутри атомов может стать несимметричным, что приводит к образованию «мгновенных диполей», которые притягиваются друг к другу. Более того, при сближении молекул движение электронов перестает быть независимым и возникает «самосогласованная» система взаимодействующих мгновенных диполей. Энергия притяжения прямо пропорциональна поляризуемостям молекул (i) и обратно пропорциональна расстоянию между ними (r 6 ). Дисперсионный эффект, как наиболее универсальный, проявляется при взаимодействии как полярных, так и неполярных молекул. Причем для неполярных молекул и молекул с небольшим дипольным моментом он является основным. Индукционный и ориентационный эффекты играют существенную роль при взаимодействии полярных молекул. Для молекул с большим значением дипольного момента основным является ориентационный эффект. Индукционный эффект обычно невелик и становится значительным лишь тогда, когда полярные молекулы сосуществуют с сильно поляризующимися молекулами (табл. 3.2). На малых расстояниях между молекулами, когда их электронные оболочки сильно перекрываются, электростатическое отталкивание ядер и электронов становится больше их взаимного притяжения. Энергия отталкивания гораздо сильнее зависит от расстояния (r 12 ), чем энергия притяжения. На больших расстояниях межмолекулярное взаимодействие определяется силами притяжения, а на малых силами отталкивания. Таблица 3.2
Источник
54.Взаимодействие молекул.Природа сил молекулярного взаимодействия.График зависимости их от расстояния.
Силы молекулярного взаимодействия являются потенциальными и их можно охарактеризовать потенциальной Е взаимодействия. Силы молекулярного взаимодействия имеют электромагнитную природу, возникают вследствие взаимодействия электронов и атомных ядер и являются короткодействующими. Сфера молекулярного взаимодействия это – область, в которой наиболее интенсивно проявляются взаимодействия молекул 10 -9 м. Fпр=1/r 7 ; Fот=1/r 12 .
55.Постоянная Авогадро.Количество вещества.
Постоянная Авогадро – одинаковое кол-во частиц, содержащихся в одном моле любого вещ-ва. 1 моль – кол-во вещ-ва, в котором содержится столько же молекул или атомов сколько в 0,012 кг углерода. Число Авогадро NА=6,02*10 23 . Число Авагадро является одной из фундаментальных физических постоянных. Количество вещества ν — число молекул в данной порции вещества = отношению числа молекул N к постоянной Авагадро. ν=N/NA; N=(m*NA)/M.
56.Идеальный газ.Основное уравнение мкт идеального газа.
Идеальный газ: 1)объем молекул много меньше объема сосуда. 2)нет межмолекулярных сил притяжения. 3)при соударении молекул меж собой и со стенами сосуда действуют силы отталкивания. Основное уравнение МКТ идеального газа или ур-ие Клаузиуса: вывод — p=/S=(1/3)*(Nmυ)/(tS)=(1/3)*(Nmυ 2 )/(lS)=1/3nmυ 2 . В действительности у молекул разные скорости поэтому используем усредненное значение скорости: =( υ 2 1+υ 2 2+. + υ 2 n)/N => p=1/3nm. Также p можно выразить и через среднюю кинетич. эн. молекул: К>=/2=(m/2)* => p=(2/3)nК>. Основное уравнение МКТ идеального газа связывает между собой макро- (р) и микропараметры К>.
57.Молекулярно-кинетический смысл температуры. Энергия и скорость теплового движения молекул.
Температура-величина характеризующая ср. кинетич энергию поступательного движения идеального газа. T=(2К>)/3k. Эту формулу можно использовать чтобы найти среднюю скорость поступательного движения молекул: кв>=кор()=кор((3kT)/m)=кор((υ 2 1+ υ 2 2+. υ 2 n)/N). Из этой формулы сразу видно, что при повышении температуры скорость возрастает. Энергия теплового движения молекул: К>=1/2m=3/2kT. k=R/NА — постоянная Больцмана ≈ 1,38*10 -23 Дж/К.
58.Испарение и конденсация.Насыщенные и ненасыщенные пары.
Насыщенный пар – пар находящийся в динамическом равновесии со своей жидкостью. А состояние динамического равновесия это такое состояние что молекулы, совершая хаотическое тепловое движение, непрерывно переходят из одной фазы в другую и обратно. Свойства насыщенного пара: 1)При Т=const, давление насыщенного пар не зависит от его объёма V. => закон Бойля-Мариотта для насыщенного пара не выполняется. 2)При V=const давление насыщенного пара с ростом температуры увеличивается быстрее, чем давление ИГ=> закон Гей-Люссака не выполняется. 3)Уравнение p=nkT описывает состояние насыщенного газа только приближено. Ненасыщенный пар -пар давление, которого меньше давления насыщенного пара, подчиняется законам ИГ. Испарение — парообразование, происходящее со свободной поверхности жидкости при любой температуре. Конденсация — обратный кипению процесс — превращение пара в жидкость.
Источник
3. Межмолекулярное взаимодействие.
Молекулы взаимодействуют с друг другом не только при образовании межмолекулярной водородной связью, но и во многих других случаях. Существует три типа межмолекулярного взаимодействия: ориентационное, индукционное, дисперсное.
Ориентационное взаимодействие– это взаимодействие между двумя полярными молекулами (сюда относятся и ионные молекулы).
При сближении полярные молекулы ориентируются друг относительно друга, противоположными концами диполей. Чем больше полярность в молекуле, тем прочнее связь. При увеличении температуры ориентационное взаимодействие уменьшается так как тепловое движение молекул нарушает ориентацию.
Индукционное взаимодействие– осуществляется между полярной и не полярной молекулой. При этом полярная молекула деформирует электронное облако не полярным. В результате у не полярной образуется временный электрический момент диполя, а затем обе молекулы реагируют как диполи. Индукционное взаимодействие не зависит от температуры.
Дисперсное взаимодействие – осуществляется между двумя не полярными молекулами. При движении электронов внутри молекулы в одной из них происходит небольшая мгновенная деформация электронного облака. В результате чего возникает асимметрия в распределении заряда, т.е. возникает диполь который существует очень короткое время. Этот диполь взаимодействует с соседней молекулой, такое взаимодействие и называется дисперсионным. На дисперсионном взаимодействии основан процесс сжижения благородных и элементарных двухатомных газов.
При межмолекулярном взаимодействии имеет место все три типа указанных сил, их часто называют вандервальсовыми силами. Они так названы в честь голландского физика-химика Ван-Дер-Вальса.
Количество химических связей которые образует тот или иной атом называют валентностью.
Лекция № 6 основы химии, термодинамики. План
- Понятия о системе, фазе. Системы гетерогенные, гомогенные.
- Тепловые эффекты реакции. Энтальпия. Закон Гесса. Следствия из него.
- Понятия об энтропии и энергии Гиббса.
- Понятия о системе, фазе.Системы гетерогенные, гомогенные.
Системой называется вещество или совокупность веществ реально или мысленно обособленных от окружающей среды. Составная часть системы называется фазой. Фазы обособленны от основной части системы границы раздела. Если система не может обмениваться с окружающей средой ни веществом ни энергией, то она называется изолированной. Химические реакции протекающие в многофазных системах называются гетерогенными, а протекающие в однородной системе гомогенными. Механизм этих двух типов реакции сильно отличаются: гетерогенные реакции протекают только на границе раздела фаз, гомогенные протекают во всем объеме системы. Сущность химической реакции сводится к разрыву одних связей в исходных веществах, и образованию новых связей продуктов реакции, при этом общее число атомов до и после реакции не изменяется. Так как при разрыве связей энергия поглощается, а при образовании новых связей энергия выделяется. Химические реакции сопровождаются энергетическими эффектами. Обычно энергия выделяется или поглощается в виде теплоты, поэтому признаку реакции делятся: на эндотермические и экзотермические.Экзотермические реакции –это реакции, которые идут с выделением тепла. Например: Н2+Cl2= 2HCl∆H= — 184,6 кДж/моль. В этих реакциях выигрыш энергии обусловленный образованием новых связей, больше расхода энергии на разрыв старых связей. Эндотермические реакции – это реакции, которые идут с поглощением энергии. Например: N2+O2= 2NO∆Н=180,8 кДж/моль.
- Тепловые эффекты реакции. Энтальпия. Закон Гесса. Следствия
Количество энергии поглощенной или выделенной в процессе реакции в виде теплоты, называется тепловым эффектом реакции. Раздел химии изучающий тепловые эффекты химических реакций, называется термохимией. Уравнения химических реакций с указанием тепловых эффектов называется термохимическими. Так как тепловой эффект зависит от давления и температуры договорились относить это к давлениям. Р=101,3кПа Т=298К(25ºС) В тепло химических реакциях указывают агрегатное состояние вещества: (г) –газ, (ж) – жидкость, (к) – кристаллическое вещество. Тепловой эффект в реакциях ∆Н выражается в кДж и относится к тому числу молей вещества, которая указана в уравнении реакции. У эндотермических реакциях ∆Н>0 у экзотермических реакциях ∆Н Если конечные продукты реакции и исходные вещества находятся в стандартных условиях (Р=101,3 кПа).то ∆Н называют стандартной эктопией и обозначают 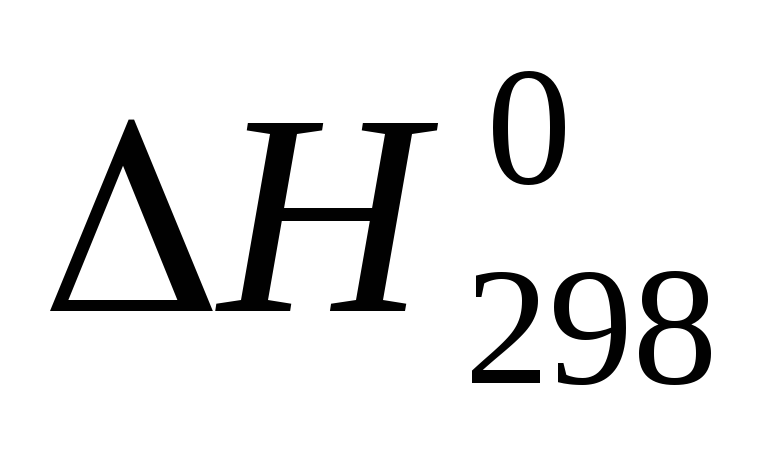
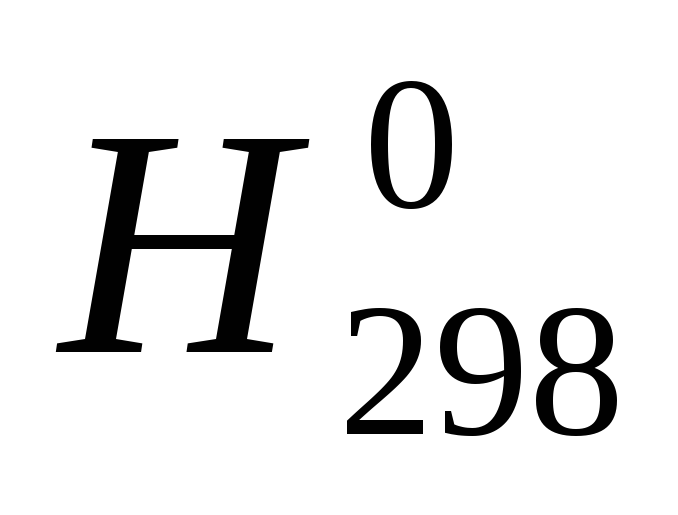

Источник