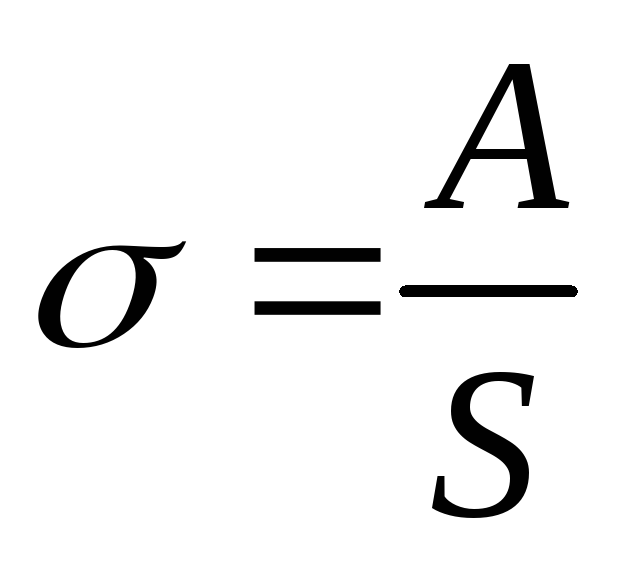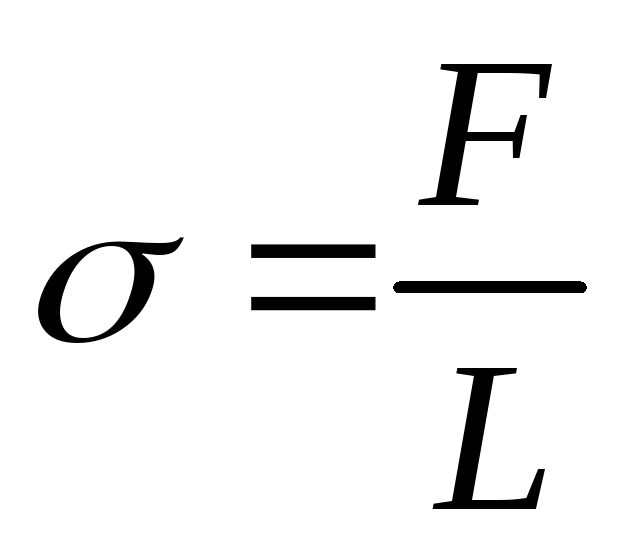Свойства жидкостей. Поверхностное натяжение
Вещество, находящееся в жидком состоянии, характеризуется крайне плотным расположением молекул друг относительно друга. Отличаясь от твердых кристаллических тел, чьи молекулы формируют упорядоченные структуры по всему объему кристалла и ограничены в своих тепловых колебаниях фиксированными центрами, молекулы жидкости обладают значительной степенью свободы. Любая конкретная молекула жидкого вещества, как это происходит и в твердых телах, «зажата» соседними молекулами и может совершать тепловые колебания поблизости с некоторым положением равновесия. Несмотря на это, в какой-то момент, любая молекула может переместиться на соседнее вакантное место. Подобные перемещения в жидкостях происходят довольно часто, благодаря чему молекулы не привязаны к конкретным центрам, как в кристаллах, а имеют возможность перемещаться по всему объему жидкости. Именно на этом факте основывается текучесть жидкостей.
Тепловое расширение воды обладает важным для жизни на Земле эффектом. В условиях температуры ниже 4 ° С вода начинает расширяется при снижении температуры β < 0 . Максимальную плотность ρ в = 10 3 к г / м 3 вода приобретает при температуре 4 ° С .
Замерзая, вода расширяется, из-за чего лед продолжает плавать на поверхности замерзающего водоема. Температура замерзающей воды подо льдом эквивалентна величине в 0 ° С . У дна водоема, то есть слоях воды, обладающих большей плотностью, температура держится около 4 ° С .
Поверхностное натяжение
Наличие свободной поверхности в жидкостях является одной из самых интересных ее особенностей. В отличие от газов, жидкость не заполняет весь объем сосуда, в котором она находится. Между жидкостью и газом, возможно паром, возникает граница раздела, находящаяся в особых условиях по сравнению с остальной массой жидкости. В отличие от молекул в глубине жидкости, молекулы, располагающиеся в пограничном ее слое, окружены другими молекулами этой же жидкости не со всех сторон. В среднем воздействующие на одну из молекул внутри жидкости со стороны соседних молекул силы межмолекулярного взаимодействия взаимно скомпенсированы. Каждая отдельно взятая молекула в пограничном слое притягивается находящимися внутри жидкости молекулами. При этом, силами, которые оказывают воздействие на такую молекулу жидкости со стороны молекул газа можно пренебречь. Вследствие этого возникает некая направленная вглубь жидкости равнодействующая сила. Поверхностные молекулы втягиваются внутрь жидкости, с помощью действия сил межмолекулярного притяжения. Однако все молекулы, в том числе и принадлежащие пограничному слою, должны находиться в состоянии равновесия. Оно достигается за счет сокращения расстояния между молекулами в пограничном слое и ближайшими их соседями в жидкости. Как проиллюстрировано на рисунке 3 . 1 . 2 , в процессе уменьшения расстояния расстояния между молекулами появляются силы отталкивания. В случае, когда средняя величина расстояния между молекулами в жидкости равна r 0 , молекулы поверхностного слоя расположены плотнее, и по этой причине по сравнению с внутренними молекулами они имеют дополнительным запас потенциальной энергии, что можно увидеть на рисунке 3 . 1 . 2 .
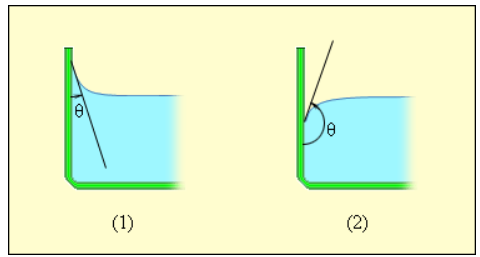
Краевой угол θ является тупым (рисунок 3 . 5 . 5 ), в случае, если силы взаимодействия между молекулами жидкости превосходят силы их взаимодействия с молекулами твердого тела. В подобном случае можно сказать, что поверхность твердого тела не смачивается жидкостью. В условиях полного смачивания θ = 0 , полного несмачивания θ = 180 ° .
Рисунок 3 . 5 . 5 . Краевые углы смачивающей ( 1 ) и несмачивающей ( 2 ) жидкостей.
Капиллярные явления
Капиллярными явлениями называют процесс подъема или опускания жидкости в трубках малого диаметра, другими словами, в капиллярах.
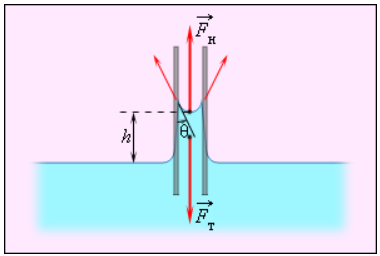
Смачивающие жидкости поднимаются по капиллярам, несмачивающие – опускаются. На рисунке 3 . 5 . 6 проиллюстрирована опущенная нижним концом в смачивающую жидкость плотности ρ капиллярная трубка, обладающая некоторым радиусом r . При этом верхний конец капилляра является открытым. Подъем жидкости в капилляре будет происходить до тех пор, пока сила тяжести F т → , оказывающая воздействие на столб жидкости в капилляре, не станет эквивалентна по модулю результирующей F н действующих вдоль границы соприкосновения жидкости с поверхностью капилляра сил поверхностного натяжения: F т = F н , где F т = m g = ρ h π r 2 g , F н = σ 2 π r cos θ .
Рисунок 3 . 5 . 6 . Подъем смачивающей жидкости в капилляре.
При полном смачивании θ = 0 , cos θ = 1 . В таком случае:
Вода почти полностью смачивает чистую поверхность стекла. Ртуть же, строго наоборот, полностью не смачивает стеклянную поверхность. По этой причине уровень ртути в стеклянном капилляре опускается ниже, чем уровень в сосуде.
Источник
Почему это важно
Хорошо известно, что при лечении различных заболеваний большинство жидких препаратов рекомендуется принимать по рецептуре в определенном количестве капель.
Эти капли образуются при медленном истечении жидкости из небольшого отверстия, причём форма капли определяется силами поверхностного натяжения и силой тяжести. В состоянии невесомости силы тяжести нет, и форма капель полностью определяется силами поверхностного натяжения, стремящимися уменьшить площадь поверхности до минимума и придающими каплям строго шарообразную форму – форму объекта с минимальной площадью поверхности.
С поверхностным натяжением связаны диспергирование (измельчение, распыление) твёрдых тел и жидкостей на малые частицы или капли, коалесценция (слияние капель или пузырьков в эмульсиях, туманах, пенах), коагуляция (агрегирование частиц дисперсной фазы). Все эти явления важны для фармакологии.
Капиллярные явления также объясняются поверхностным натяжением. Поверхностное натяжение определяет форму клеток и их частей. Изменение сил поверхностного натяжения влияет на фагоцитоз (захват клетками соседних частиц), пиноцитоз (захват клеточной поверхностью жидкости с содержащимися в ней веществами), а значит и на динамику действия используемых фармакологических лекарственных средств.
Рассмотрим явление поверхностного натяжения подробнее.
Поверхностное натяжение – это явление, при котором вещество (прежде всего, жидкость) стремится приобрести форму с минимально возможной площадью поверхности. Это достигается за счёт наличия сил поверхностного натяжения. Приближение к шаровой форме достигается тем больше, чем слабее силы тяжести. Но даже при нормальной силе тяжести небольшие количества жидких сред стремятся принять шарообразную форму, соответствующую наименьшей величине поверхности, т.к. у малых капель сила поверхностного натяжения значительно превосходит силу тяжести.
Природа сил поверхностного натяжения
Жидкое состояние вещества характеризуется значительно меньшим расстоянием между молекулами, чем в газе, более значительными силами притяжения между молекулами и весьма значительными силами отталкивания, проявляющимися при объемном сжатии. Молекулярное движение частиц жидкости – это, в основном, колебательное движение около среднего положения. Поступательное движение ограничивается обменом местами с соседними частицами.
Строго говоря, всякое тело находится не в вакууме, а в какой-либо другой среде, например в атмосфере. Поэтому следует говорить не просто о поверхности тел, а о поверхностях раздела двух сред.
На поверхностях раздела жидкости и ее насыщенного пара, двух несмешиваемых жидкостей, жидкости и твердого тела возникают силы, обусловленные различным межмолекулярным взаимодействием граничащих сред: прежде всего водородными связями и более слабыми неполярными взаимодействиями.
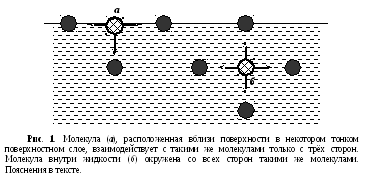
Молекулы внутри жидкости окружены со всех сторон такими же молекулами (рис.1б), поэтому силы притяжения со стороны соседей скомпенсированы. Векторная сумма сил притяжения со стороны соседей равна 0 – молекула находится в равновесии. Молекулы, расположенные вблизи поверхности в некотором тонком поверхностном слое (рис.1а), находятся в условиях, отличных от условий внутри тела: молекулы же вблизи поверхности имеют одинаковых с ними соседей лишь с трёх сторон. Поэтому силы притяжения со стороны соседей не скомпенсированы, а значит, на неё действует нескомпенсированная сила, направленная внутрь жидкости. Из-за этого молекула стремится перейти туда же, вглубь. При этом поверхность жидкости стремиться уменьшиться.
Это приводит к тому, что энергия молекул в поверхностном слое отлична от их энергии внутри тела. Разность между энергией всех молекул вблизи поверхности раздела и той энергией, которую эти молекулы имели бы, если бы они находились внутри тела, называется поверхностной энергией.
Поверхностная энергия – это избыток энергии поверхностного слоя на границе раздела фаз (по сравнению с энергией вещества внутри тела), обусловленный различием межмолекулярных взаимодействий в обеих веществах.
Очевидно, что поверхностная энергия Епов пропорциональна площади S поверхности раздела: Епов= σ·S. Коэффициент σ (греческая буква «сигма») называется коэффициентом поверхностного натяжения и зависит от природы соприкасающихся сред и от их состояния. Часто этот коэффициент называют коротко поверхностным натяжением. Не следует путать явление поверхностного натяжения с коэффициентом поверхностного натяжения, характеризующим это явление.
Известно из механики, что силы действуют всегда так, чтобы привести тело в состояние с наименьшей энергией. В частности, и поверхностная энергия Епов стремится принять наименьшее возможное значение.
Из этого следует, что поверхность раздела двух сред всегда стремится уменьшиться. Именно с этим связано стремление капелек жидкости (или пузырьков газа) принять сферическую форму: при заданном объёме шар обладает наименьшей из всех фигур поверхностью. Этому стремлению противодействует влияние сил тяжести, но для маленьких капелек это влияние слабо и их форма близка к сферической.
При этом молекулы поверхностного слоя втягиваются внутрь жидкости. Для перемещения молекул из жидкости на ее поверхность требуется совершить работу А, по модулю равную поверхностной энергии, т.е. А = Епов=σ·S. Отсюда следует определение коэффициента поверхностного натяжения.
Коэффициент поверхностного натяжения (поверхностное натяжение) σ равен работе А, требуемой для образования поверхности жидкости площадью S при постоянной температуре: .
Поверхностное натяжение может быть определено не только энергетически. Поверхностное натяжение проявляет себя как сила в следующем простом примере. Представим себе плёнку жидкости (например, мыльную плёнку), натянутую на квадратную проволочную рамку, каждая из сторон которой имеет длину L. Благодаря стремлению поверхности уменьшиться, на проволочку будет действовать сила, которую можно непосредственно измерить. При постоянной силе F работа равна А= F L. Тогда:
.
Таким образом, на линию, ограничивающую поверхность тела (или какой-либо участок этой поверхности), действуют силы, направленные перпендикулярно этой линии по касательной к поверхности, внутрь её. Поверхностный слой жидкости всегда ограничен линией возможного разрыва и находится под действием сил поверхностного натяжения в постоянном натяжении, стремящемся сократить поверхность. Сокращение поверхности возможно при условии, если силы поверхностного натяжения будут касательными к поверхности и перпендикулярны к линии возможного разрыва.
Отсюда следует второе определение: коэффициент поверхностного натяжения σ равен силе поверхностного натяжения F, действующей на единицу длины L отрезка, на котором действует эта сила (линии возможного разрыва): .
Размерность σ вытекает из его определения и может быть представлена в различных видах: энергия на единицу площади (Дж/м 2 ) или сила на единицу длины (Н/м). Анализ размерностей показывает равнозначность этих единиц: Дж/м 2 = Н • м/м 2 = Н/м.
При указании значения коэффициента поверхностного натяжения надо указывать, о соприкосновении каких именно двух сред идёт речь. Просто поверхностным натяжением жидкости (без указания второй среды) часто называют поверхностное натяжение на границе данной жидкости и её пара. Эта величина уменьшается с повышением температуры линейно.
Силы поверхностного натяжения никак не изменяются по мере сокращения площади поверхности пленки, так как плотность жидкости, а, следовательно, и среднее расстояние между молекулами на поверхности не изменяется.
Ниже приведены значения поверхностного натяжения для некоторых жидкостей при температуре 20°С (табл. 1).
Таблица 1. Значение коэффициента поверхностного натяжения σ (в миллиньютонах на метр) для некоторых жидкостей при температуре 20°С (второй фазой является воздух).
Источник