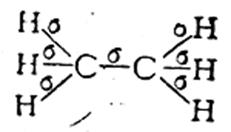Acetyl
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
| H + | Li + | K + | Na + | NH4 + | Ba 2+ | Ca 2+ | Mg 2+ | Sr 2+ | Al 3+ | Cr 3+ | Fe 2+ | Fe 3+ | Ni 2+ | Co 2+ | Mn 2+ | Zn 2+ | Ag + | Hg 2+ | Pb 2+ | Sn 2+ | Cu 2+ | |
| OH — | Р | Р | Р | Р | Р | М | Н | М | Н | Н | Н | Н | Н | Н | Н | Н | — | — | Н | Н | Н | |
| F — | Р | М | Р | Р | Р | М | Н | Н | М | М | Н | Н | Н | Р | Р | Р | Р | Р | — | Н | Р | Р |
| Cl — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | Р | М | Р | Р |
| Br — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Н | М | М | Р | Р |
| I — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | Р | ? | Р | Р | Р | Р | Н | Н | Н | М | ? |
| S 2- | М | Р | Р | Р | Р | — | — | — | Н | — | — | Н | — | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| HS — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | Н | ? | ? | ? | ? | ? | ? | ? |
| SO3 2- | Р | Р | Р | Р | Р | Н | Н | М | Н | ? | — | Н | ? | Н | Н | ? | М | М | — | Н | ? | ? |
| HSO3 — | Р | ? | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? |
| SO4 2- | Р | Р | Р | Р | Р | Н | М | Р | Н | Р | Р | Р | Р | Р | Р | Р | Р | М | — | Н | Р | Р |
| HSO4 — | Р | Р | Р | Р | Р | Р | Р | Р | — | ? | ? | ? | ? | ? | ? | ? | ? | ? | ? | Н | ? | ? |
| NO3 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р |
| NO2 — | Р | Р | Р | Р | Р | Р | Р | Р | Р | ? | ? | ? | ? | Р | М | ? | ? | М | ? | ? | ? | ? |
| PO4 3- | Р | Н | Р | Р | — | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н | Н |
| CO3 2- | Р | Р | Р | Р | Р | Н | Н | Н | Н | ? | ? | Н | ? | Н | Н | Н | Н | Н | ? | Н | ? | Н |
| CH3COO — | Р | Р | Р | Р | Р | Р | Р | Р | Р | — | Р | Р | — | Р | Р | Р | Р | Р | Р | Р | — | Р |
| SiO3 2- | Н | Н | Р | Р | ? | Н | Н | Н | Н | ? | ? | Н | ? | ? | ? | Н | Н | ? | ? | Н | ? | ? |
| Растворимые (>1%) | Нерастворимые ( Спасибо! Ваша заявка отправлена, преподаватель свяжется с вами в ближайшее время. Вы можете также связаться с преподавателем напрямую: Скопируйте эту ссылку, чтобы разместить результат запроса » » на другом сайте. Изображение вещества/реакции можно сохранить или скопировать, кликнув по нему правой кнопкой мыши. Если вы считаете, что результат запроса » » содержит ошибку, нажмите на кнопку «Отправить». Внимание, если вы не нашли в базе сайта нужную реакцию, вы можете добавить ее самостоятельно. На данный момент доступна упрощенная авторизация через VK. Здесь вы можете выбрать параметры отображения органических соединений. Эти параметры действуют только для верхнего изображения вещества и не применяются в реакциях.
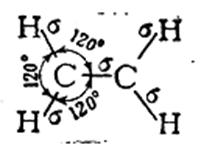
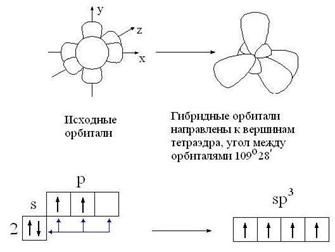
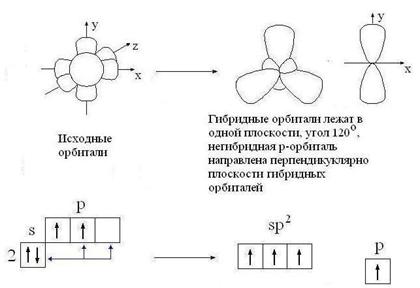
Корректная работа сайта обеспечена на всех браузерах, кроме Internet Explorer. Если вы пользуетесь Internet Explorer, смените браузер. На сайте есть сноски двух типов: Подсказки — помогают вспомнить определения терминов или поясняют информацию, которая может быть сложна для начинающего. Дополнительная информация — такие сноски содержат примечания или уточнения, выходящие за рамки базовой школьной химии, нужны для углубленного изучения. Источник 4. Особенности углерод-углеродных связейОдной из причин многообразия органических веществ является способность атома углерода к образованию различных типов углерод-углеродных связей. Электронная конфигурация углерода 1s 2 2s 2 2p 2 , т. е. атом углерода имеет два неспаренных p-электрона, которые могут принимать участие в образовании двух ковалентных связей. Однако известно, что углерод, как правило, образует четыре ковалентные связи. Это объясняется тем, что при образовании ковалентных связей один из 2s-электронов переходит на свободную p-орбиталь, в результате чего появляются четыре неспаренных электрона, которые могут образовать четыре ковалентные связи с другими атомами. Но при этом одна из них будет образована за счет сферического s-электронного облака, а три – за счет p-облаков, имеющих форму гантели. Экспериментально установлено, что в молекулах предельных углеводородов все связи атомов углерода равноценны. Это можно объяснить с привлечением представлений о гибридизации электронных облаков. Согласно теории гибридизации (Л. Полинг, 1931), в образовании химической связи могут принимать участие гибридные (комбинированные) электронные облака, форма которых отличается от форм исходных облаков. sp 3 -гибридизация. В этом случае гибридные облака формируются за счет одного s- и трех p-облаков. Доля сферической s-орбитали в общей электронной плотности невелика, поэтому четыре гибридных облака имеют форму немного несимметричной восьмерки. Электронные облака одноименно (отрицательно) заряжены и стремятся максимально удалиться друг от друга, что достигается при их ориентации в пространстве в направлении от центра к вершинам тетраэдра (рис. 1). Углы между осями гибридных электронных облаков составляют 109º28 / . Подобным расположением химических связей Рис. 1. sp 3 — гибридизованные орбитали атомов углерода обусловлена зигзагообразная форма углеродных цепей предельных углеводородов и тетраэдрическое строение простейшего алкана – метана. sp 2 -гибридизация. Этот тип гибридизации орбиталей реализуется при комбинации одной s- и двух p-орбиталей. Образующиеся три sp 2 -орбитали лежат в одной плоскости и образуют углы 120 º (рис. 2). Доля s-орбитали в гибридной орбитали увеличивается, поэтому sp 2 -орбиталь представляет собой восьмерку, одна из долей которой короче и толще, чем в sp 3 -орбитали; атомный объем уменьшается. Облако одного из p-электронов, не участвующего в гибридизации, имеет форму симметричной относительно ядра восьмерки и располагается перпендикулярно плоскости, в которой находятся гибридные орбитали. При взаимодействии sp 2 -углеродных атомов расширяются возможности перекрывания их орбиталей: наряду с перекрыванием по линии, соединяющей ядра атомов (образование σ-связи) возможно боковое перекрывание негибридных орбиталей (образование π-связи). Такая связь называется двойной связью и представляет собой комбинацию σ- и π-связей (рис. 3). Поскольку объем sp 2 -углеродного атома меньше объема sp 3 -гибридного углерода, соответственно и длина двойной связи будет меньше, чем длина одинарной. Рис. 2. sp 2 — гибридизованные Рис. 3. Пространственное расположе- орбитали ние орбиталей в молекуле этилена sp-гибридизация. В гибридизации участвуют лишь две орбитали атома углерода (s- и p-). Форма гибридной орбитали еще более приближается к шарообразной, атомный объем становится еще меньше. Две гибридные орбитали, стремясь максимально удалиться друг от друга, образуют с другими атомами связи, ориентированные под углом 180 º . Две другие p-орбитали атома углерода не участвуют в гибридизации и при боковом перекрывании с подобными орбиталями другого sp-гибридного углерода образуют π-связи, расположенные во взаимно перпендикулярных плоскостях (рис. 4). Возникаю- Рис. 4. sp-гибридизованные орбитали (а) и пространственное расположение орбиталей в молекуле ацетилена (б) щая при этом химическая связь носит название тройной связи – это комбинация одной σ- и двух π-связей. Атомный объем sp-гибридного углерода меньше, чем sp 2 -гибридного, поэтому тройная связь должна быть короче двойной, а ее энергия – больше. Данные о различных типах углерод-углеродных связей приведены в табл. 1.2. Таблица 1.2. Сравнительная характеристика углерод-углеродных связей Угол между гибридными орбиталями Источник Электронное строение одинарной, двойной и тройной углерод-углеродных связей в органических молекулах. Типы гибридизации углеродных атомов.Согласно современным представлениям, необходимым условием для образования химической связи между двумя атомами является перекрывание облаков их электронов. Электрон образует связь в том направлении, в котором расположена наибольшая часть его облака, так что при этом осуществляется максимальное перекрывание облаков двух связующих электронов. В случае простой связи (изображаемой одной валентной черточкой) максимальное перекрывание осуществляется по прямой, соединяющей два атома. Такая простая кова-лентная связь называется σ-связью, а электроны, ее образующие, — σ-электронами. В молекуле этилена, как это установлено с помощью физических методов исследования, пять σ-связей расположены друг относительно друга под углом 120° и находятся в одной плоскости: Однако при таком расположении связей в этилене у каждого атома углерода остается по одному неспаренному электрону. Они уже не могут образовать между атомами углерода вторую σ-связь, так как это сопровождалось бы нарушением принципа Паули. Поэтому такие неспаренные электроны атомов углерода образуют качественно иную связь. Перекрывание двух электронных облаков происходит так, что восьмерки этих облаков перпендикулярны плоскости, в которой расположены все шесть атомов молекулы этилена. Такая связь называется π-связью, а электроны, ее образующие, — π-электронами. Двойная углерод – углеродная связь С=С состоит из σ-связиπ-связи. Тройная углерод-углеродная связь С≡С состоит из σ-связи, возникающей при перекрыванииsp-гибридных орбиталей, и двух π-связей. Гибридизация — это взаимодействие атомных орбиталей с близкими значениями энергии, сопровождающееся образованием новых ‘гибридных’ орбиталей. Гибридизация — процесс, требующий затрат энергии, но эти затраты с избытком компенсируются за счет энергии, выделяющейся при образовании большего числа ковалентных связей.образующиеся ‘гибридные’ орбитали имеют форму ассимметричной гантели и резко отличаются от исходных орбиталей атома углерода. Для атома углерода возможно три типа гибридизации: sр 3 -гибридизация — взаимодействующиеорбитали показаны стрелками: sр 2 -гибридизация: sр-гибридизация: Гибридные орбитали атома углерода способны участвовать в образовании только σ-связей, незатронутые гибридизацией р-орбитали образуют только π-связи. Именно этой особенностью определяется пространственное строение молекул органических веществ. 5. Делокализованная химическая связь: π, π- и р, π-сопряжение (бутадиен-1,3; хлорэтен). Сопряжение – перераспределение (выравнивание) электронной плотности в сопряженной системе, приводящее к стабилизации молекулы. Сопряжение возможно только в том случае, если все атомы, принимающие участие в этом процессе расположены в одной плоскости, т.е. должно выполняться условие копланарности. Различают сопряженные системы с открытой цепью и замкнутые сопряженные системы. Возможны два типа сопряжения π,π-сопряжение (в сопряжении участвуют π-электроны кратной связи) и р,π-сопряжение (в сопряжении участвуют π-электроны кратной связи и р-электроны неподеленной электронной пары гетероатомов –N–, –O–, –S–). Сопряжение – это энергетически выгодный процесс, происходящий с выделением энергии, поэтому для сопряженных систем характерна повышенная термодинамическая устойчивость. Количественно термодинамическую устойчивость можно оценить как разность энергий соединений с сопряженными двойными связями и соединений с изолированными двойными связями. Эту разность называют энергией сопряжения или энергией делокализации. Термодинамическая устойчивость соединения увеличивается с увеличением длины сопряженной цепи. Из сопряженных полиенов наиболее широко распространены в природе каратиноиды(каротин, витамин А, ретиналь). Простейшей π,π-сопряженной системой этого типа является бутадиен-1,3, а р,π-сопряженной является хлорэтен. Все атомы углерода находятся в sp2-гибридизации, все s связи лежат в одной плоскости, четыре негибридизованныеРz-орбитали расположены перпендикулярно плоскости s-связей и параллельны друг другу (необходимое условие для перекрывания). Н2С = СН – СН = СН2 Н2С = СН –Cl Понравилась статья? Добавь ее в закладку (CTRL+D) и не забудь поделиться с друзьями: Источник Электронная природа двойной связи углерод-углерод. Цис-транс изомерия этиленовых углеводородов.Алкины – это углеводороды, в молекулах которых два атома углерода находятся в состоянии sp-гибридизации и связаны друг с другом тройной связью. Общая формула: CnH2n–2, где n > 2. Особенности алкинов: 1) длина связи в алкинах равна 0,120 нм; 2) каждый атом углерода в состоянии sp-гибридизации связан с двумя другими атомами; 3) может присоединять еще два атома. Существует два типа изомерии алкинов: 1) изомерия положения тройной связи; 2) изомерия цепи. Первые два члена гомологического ряда – этин и пропин – изомеров не имеют. Для бутинов возможен только один вид изомерии – изомерия положения тройной связи. Существует два типа номенклатуры: 1) международная номенклатура: этин; пропин; 2) рациональная номенклатура: ацетилен; метиацетилен. Физические свойства алкинов: 1) С2Н2…С4Н6 – газы; 2) С5Н8…С15Н28 – жидкости; 3) С16Н30… – твердые вещества; 4) плохо растворимы в воде. Химические свойства алкинов: обладают большой реакционной способностью, характеризуются реакцией присоединения, тройная связь содержит две π-связи. Алкины (ацетиленовые углеводороды) содержат тройную связь. Общая формула алкина с одной тройной связью C nH 2n–2. Название образуется от соответствующего углеводорода с добавлением суффикса -ин. В табл. 12.4 приведены первые пять алкинов. Источник |