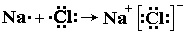Ионная связь
Ионная связь – это связь между ионами, осуществляемая электростатическим притяжением. Она образуется между элементами, которые резко отличаются по электроотрицательности (типичные металлы с типичными неметаллами). Атомы металлов отдают свои валентные электроны и превращаются в положительно заряженные ионы, а атомы неметаллов принимают электроны и превращаются отрицательно заряженные ионы. Положительно и отрицательно заряженные ионы притягиваются, образуя ионные соединения. Например, при образовании хлорида натрия атом натрия отдает один электрон и приобретает электронную конфигурацию перед ним стоящего инертного элемента (10Ne 1s 2 2s 2 2p 6 ; 11Na + 1s 2 2s 2 2p 6 ), а атом хлора принимает его и приобретает электронную конфигурацию за ним стоящего инертного элемента:
Между ионами Na + и Сl – возникают силы электростатического притяжения, в результате чего и образуется хлорид натрия:
Следует отметить, что валентность элемента в соединениях с ионными связями равна его степени окисления, т. е. числу отданных или принятых электронов. Согласно современной теории химической связи механизм образования ионной связи такой же, как и ковалентной (путем перекрывания электронных облаков), но с последующим переходом общей электронной пары к резко электроотрицательному элементу, например:
Следовательно, природа химической связи едина, и ионную связь рассматривают как предельный случай ковалентно–полярной связи. Поэтому говорят о степени ионности связи. Даже в таком соединении как CsF ионная связь выражена только на 89 %, т. е. молекул с чисто ионной связью нет. Степень ионности связи возрастает с увеличением разности электроотрицательности образующих ее атомов, табл. 9.
Таблица 9 – Зависимость степени ионности от разности ЭО атомов
Связи с разностью ЭО больше 1,7 относятся к ионным, а с меньшей – к ковалентным полярным.
Ионная связь, в отличие от ковалентной, не обладает направленностью и насыщаемостью. Электрическое поле иона имеет сферическую симметрию, поэтому взаимодействие между ионами осуществляется одинаково, независимо от направления.
Кроме того, взаимодействие двух противоположно заряженных ионов не приводит к полной компенсации их полей, они сохраняют способность притягивать ионы противоположного знака. Поэтому ионная связь не обладает насыщаемостью. Следствием особенностей ионной связи является соединение ионов с образованием ионной кристаллической решетки. Например, в кристалле Na + Cl – каждый ион Na + окружен ионами Cl – и наоборот. А молекулы хлорида натрия NaCl образуются только в газообразном состоянии.
Металлическая связь
Атомы металлов на внешнем энергетическом уровне имеют небольшое число электронов, но много свободных валентных орбиталей, кроме этого они обладают большими радиусами и низкой энергией ионизации. При сближении атомов в результате образования кристаллической решетки валентные орбитали соседних атомов перекрываются, в образовавшемся кристалле число электронов значительно меньше числа орбиталей и поэтому электроны свободно движутся из одной орбитали в другую, становятся общими и осуществляют связь между всеми атомами кристалла металла. Схематически для описания металлической связи используют модель «свободного электрона». Согласно этой модели атомы металлов отдают наружные электроны и превращаются в положительно заряженные ионы. Оторвавшиеся от атомов электроны образуют «электронный газ», который равномерно распределяется между всеми ионами и соединяет их.
Металлическая – это связь между положительными ионами металлов и оторвавшимися электронами. Она характерна для металлов в твердом и жидком состоянии, а в парообразном – атомы металлов связаны между собой ковалентной связью. Пары металлов состоят из отдельных молекул (Na2, K2, Сu2 и т.д.).
Металлическая связь имеет черты сходства и отличия с ковалентной и ионной связями. Как при ковалентной, так и при металлической, валентные электроны переходят в общее пользование. Но в случае металлической связи эти электроны связывают все атомы данного образца металла, а в случае ковалентной связи – два атома. В отличие от ковалентной связи металлическая связь не имеет направленного характера. Как при ионной связи, так и при металлической, имеются ионы. Но в металлах положительные ионы удерживаются свободно перемещающимися электронами, а в веществах с ионной связью – отрицательно заряженными ионами.
Источник
Ионная связь
Природу ионной связи, структуру и свойства ионных соединений можно объяснить электростатическим взаимодействием ионов. Способность элементов образовывать простые ионы обусловлена электронной структурой их атомов. Эту способность можно оценить энергией ионизации и сродством атомов к электрону. Понятно, что легче всего образуют катионы элементы с малой энергией ионизации – щелочные и щелочноземельные металлы. Образование же в условиях обычных химических превращений простых катионов других элементов менее вероятно, так как это связано с затратой большой энергии на ионизацию ионов.
Простые анионы легче всего образуют p-элементы VII группы вследствие их высокого сродства к электрону. Присоединение одного электрона к атомам кислорода, серы, углерода, некоторым другим элементам сопровождается выделением энергии. Присоединение же последующих электронов с образованием свободных многозарядных простых анионов места не имеет, поэтому соединения, состоящие из простых ионов, немногочисленны. Они легче всего образуются при взаимодействии щелочных и щелочноземельных металлов с галогенами. Однако в этом случае электронная плотность между ионами не равна нулю, поэтому можно говорить лишь о преимущественном проявлении ионной связи. Радиусы же одноатомных ионов представляют собой чисто условные величины. Представление об ионных кристаллах – это идеализированная модель.
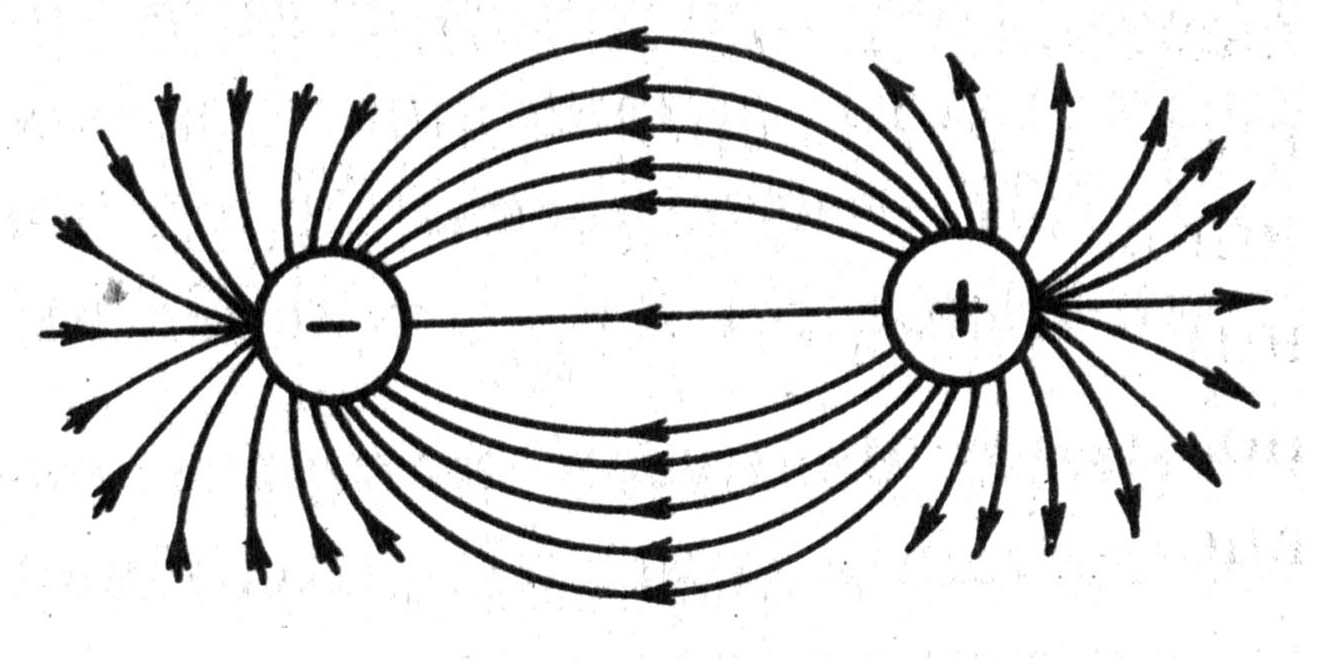
Ненаправленность и ненасыщаемость ионной связи. Электрические заряды ионов обуславливают их притяжение и отталкивание и в целом определяют стехиометрический состав соединения. Ионы можно представить как заряженные шары, силовые поля которых равномерно распределяются во всех направлениях в пространстве. Поэтому каждый ион может притягивать к себе ионы противоположного знака в любом направлении. Иначе говоря, ионная связь в отличие от ковалентной характеризуется ненаправленностью.
Понятно, что взаимодействие друг с другом двух ионов противоположного знака не может привести к полной взаимной компенсации их силовых полей (рис. 3.32). В силу этого у них сохраняется способность притягивать ионы противоположного знака и по другим направлениям. Следовательно, в отличие от ковалентной, ионная связь характеризуется также ненасыщаемостью.
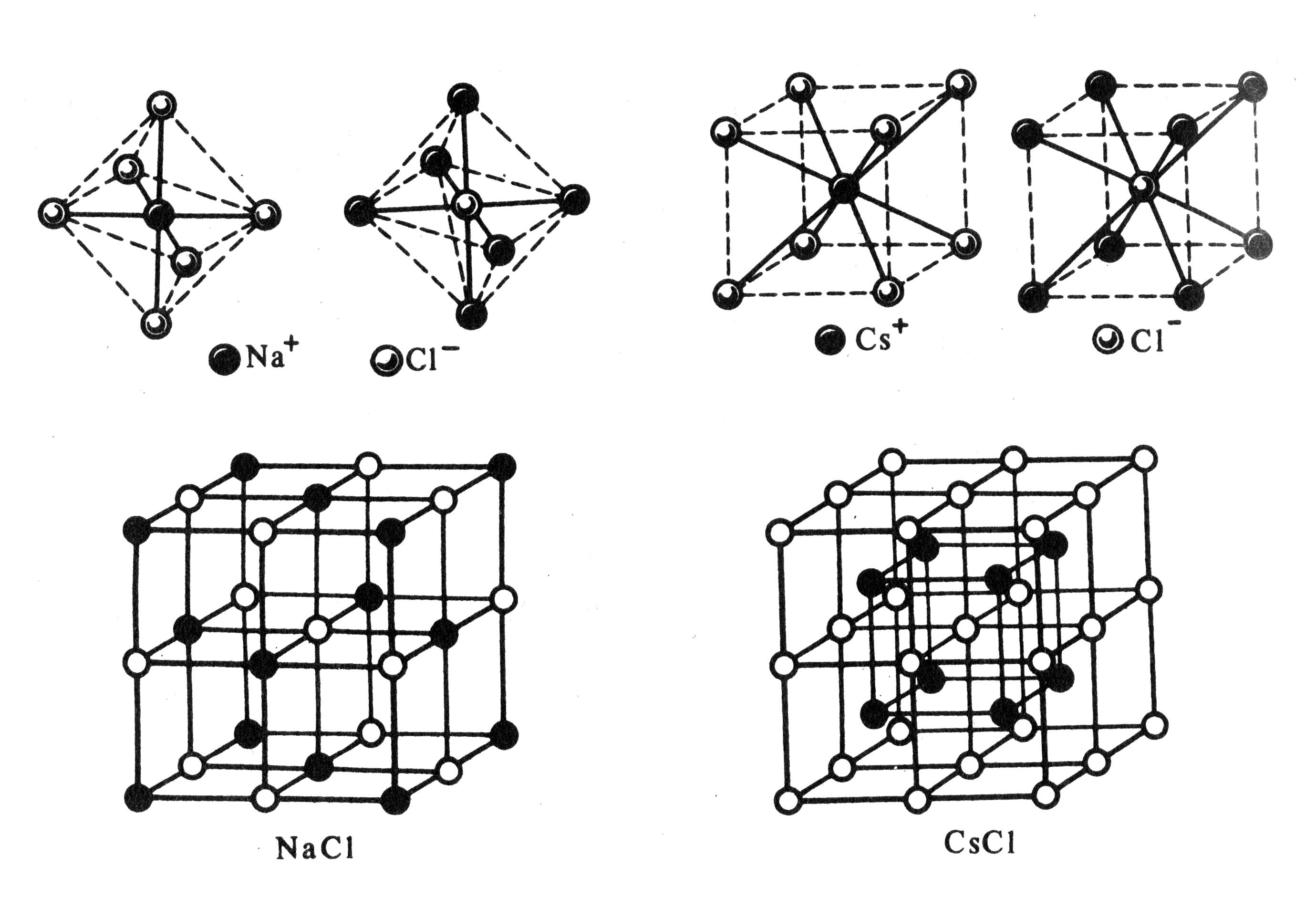
Структура ионных соединений. Вследствие ненапрвленности и ненасыщаемости ионной связи энергетически наиболее выгодно, когда каждый ион окружен максимальным числом ионов противоположного знака. Однако из-за отталкивания одноименных ионов друг от друга устойчивость системы достигается лишь при определенной взаимной координации ионов.
Рис. 3.32. Распределение электрических силовых полей двух разноименных ионов
В отличие от ковалентных соединений координационное число (к.ч.) в «чисто» ионных соединениях не зависит от специфики электронной структуры элементов, а определяется соотношением размеров ионов. Так, при соотношении ионных радиусов в пределах 0,41 – 0,73 имеет место октаэдрическая координация ионов, при соотношении 0,73 – 1,37 – кубическая координация и т.д. Например, при взаимодействии ионов Na + (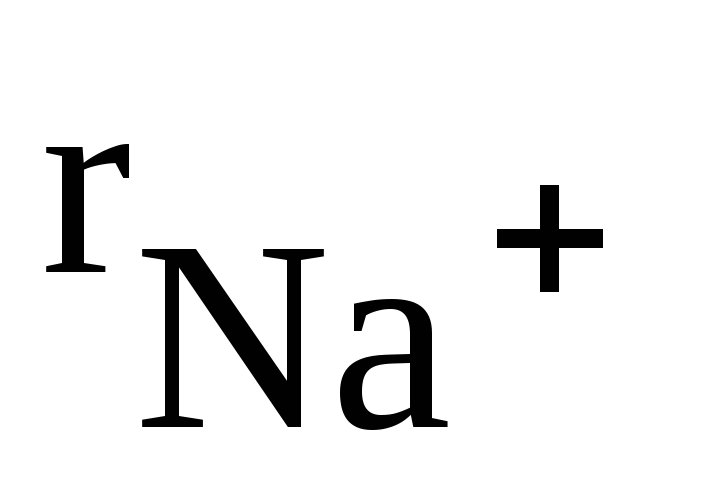
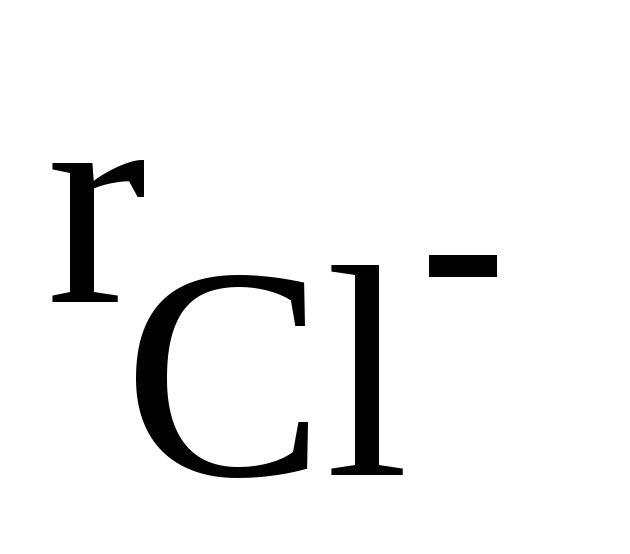
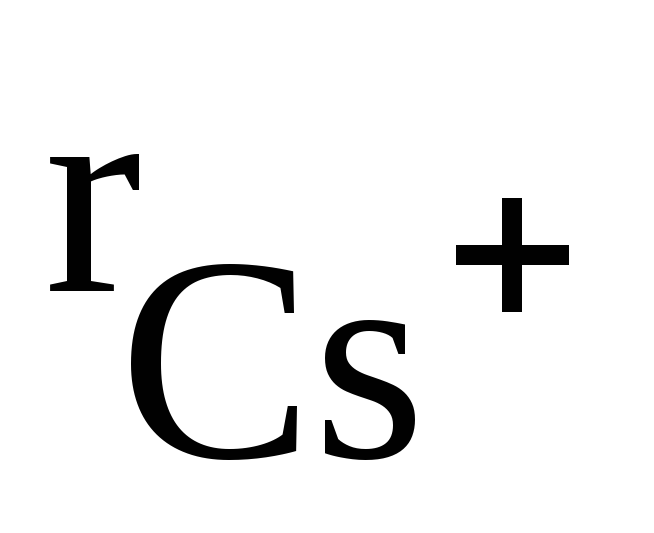
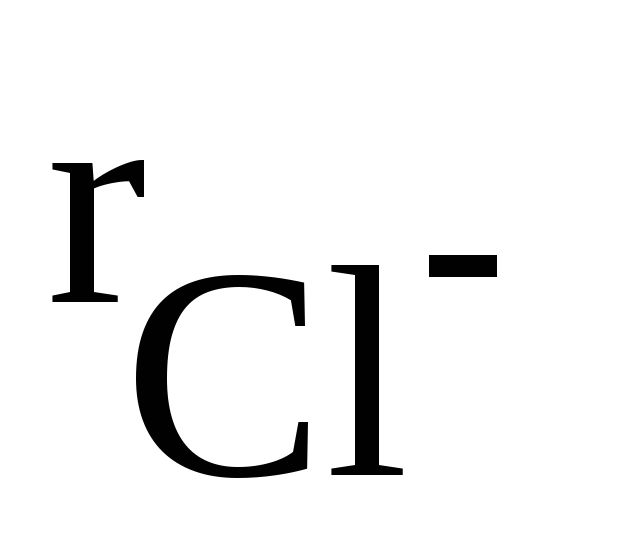
Таким образом, в обычных условиях ионные соединения представляют собой кристаллические вещества.
Рис. 3.34. Структурный тип хлорида цезия CsCl
Рис. 3.33. Структурный тип хлорида натрия NaCl
Источник
4.2. Ионная связь
При образовании любой молекулы, атомы этой молекулы «связываются» друг с другом. Причина образования молекул состоит в том, что между атомами в молекуле действуют электростатические силы. Образование молекул из атомов приводит к выигрышу энергии, так как в обычных условиях молекулярное состояние устойчивее, чем атомное.
Если на внешнем уровне содержится максимальное число электронов, которое атом может вместить, то такой уровень называется завершенным. Завершенные уровни характеризуются большой прочностью. Такие уровни имеют атомы инертных газов. Это и служит причиной того, что инертные газы при обычных условиях не вступают в химические реакции с другими элементами. Атомы других элементов имеют незавершенные энергетические уровни. В процессе химического взаимодействия они их завершают, т. е. приобретают структуру инертных газов.
Ионный тип связи возможен только у элементов, атомы которых резко отличаются по относительной электроотрицательности (см. раздел 3.3.), т.е. способности атомов смещать электронную плотность в молекуле к себе.
Рассмотрим электронное строение атомов некоторых металлов. неметаллов и инертного газа неона.
Электронная формула атома
натрия Is 2 2s 2 2p 6 3s 1 или [Ne] 3s 1
кальция Is 2 2s 2 2p 6 3s 2 3p 6 4s 2 или [Ar] 4s 2
хлора Is 2 2s 2 2p 6 3s 2 3p 5 или [Ne] Зs 2 3p 5
кислорода Is 2 2s 2 p 4 или [He ]2s 2 2p 4
Как видно из электронного строения, атом неона имеет завершенный внешний энергетический уровень, состоящий из восьми электронов, а атомы металлов (натрия и кальция) и неметаллов (хлора и кислорода) — незавершенные энергетические уровни. В процессе химических реакций они стремятся завершить их, т. е. принять конфигурацию инертных газов.
Для завершения энергетических уровней атомам натрия и кальция легче отдать один и два электрона, а атомам хлора и кислорода легче принять один или два электрона. Это и происходит при образовании молекул.
Образование молекул хлорида натрия (NaCI) и оксида кальция (СаО) происходит по схеме:
Na – ē → Na + [Ne]
Cl + ē →Cl – [Ar]
Атом натрия теряет электрон и превращается в ион натрия, который приобретает конфигурацию инертного газа (Ne), а атом хлора присоединяет электрон, превращается в ион хлора, приобретая конфигурацию инертного газа аргона (Аг).
Аналогично происходит и образование молекулы оксида кальция
Ионы, вследствие сил электростатического притяжения, образуют молекулы. Соединения, которые образовались путем притяжения ионов, называются ионными.
Химическая связь между ионами, осуществляемая электростатическим притяжением, называется ионной связью. Ионных соединений сравнительно немного. Современная теория связи объясняет возникновение ионной связи из ковалентной предельной односторонней поляризацией (смещением) общей электронной пары, когда последняя переходит во владения одного из соединяющихся атомов, т. е. ионная связь — крайний случай ковалентной связи.
Таким образом, нет принципиального различия в механизме возникновения неполярной ковалентной, полярной ковалентной и ионной связей. Они различаются лишь степенью поляризации молекулярного электронного облака. Природа химической связи едина.
Для соединений с ионной связью характерны высокая температура кипения и плавления, электропроводностью обладают только в расплавленном состоянии, в воде легко диссоциируют на ионы.
Ионная связь характеризуется ненаправленностью и ненасыщаемостью.
Ненаправленность ионной связи. Ионы можно представить как заряженные шары, силовые поля которых равномерно распределены во всех направлениях в пространстве. Поэтому каждый ион может притянуть к себе ионы противоположного знака в любом направлении (рис. 5).
Ненасыщаемость ионной связи. Взаимодействие двух ионов противоположного знака друг с другом не может привести к полной взаимной компенсации их силовых полей. В силу этого, у них сохраняется способность притягивать ноны противоположного знака и по другим направлениям (рис. 6).
Рис.5 Ненаправленность ионной связи Рис.6 Ненасыщаемость ионной связи
Источник