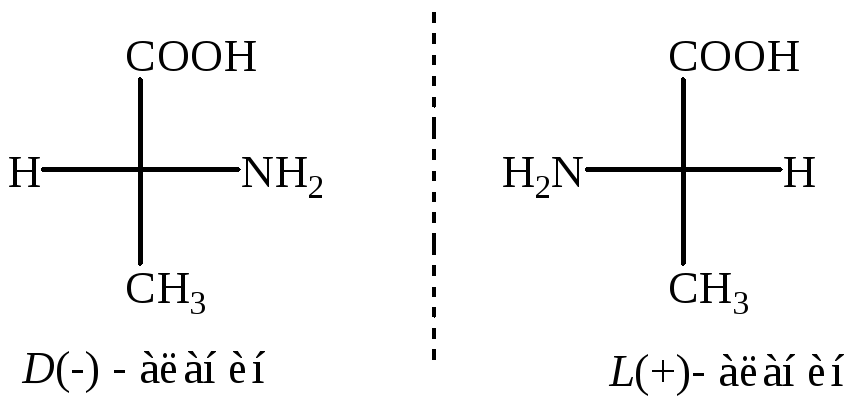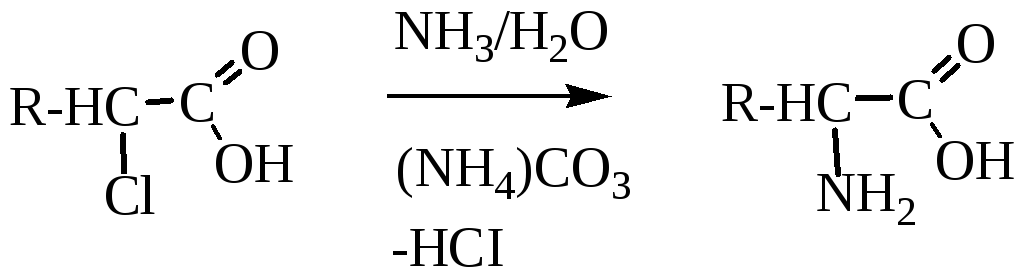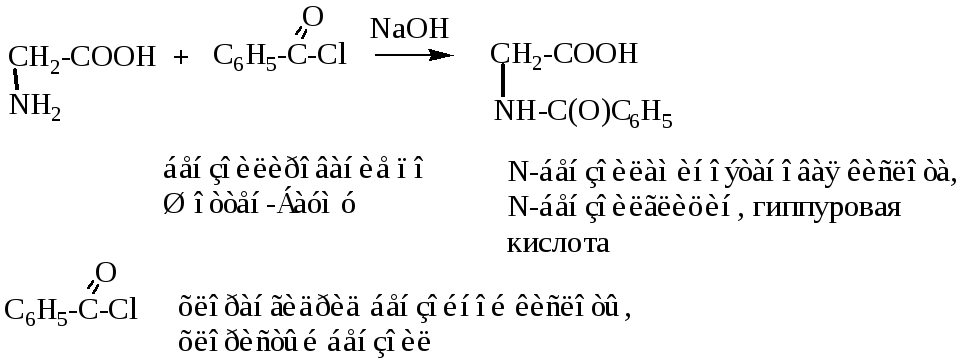- Оптическая изомерия аминокислот
- Методы получения аминокислот
- Реакционная способность
- Амфотерность аминокислот
- Аминокислоты, содержащие в радикале дополнительную аминогруппу или гуанидильный остаток.
- Оптическая изомерия аминокислот
- Методы получения аминокислот
- Реакционная способность
- Амфотерность аминокислот
- оксо-,окси-,_аминокислоты
Оптическая изомерия аминокислот
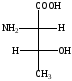
Все -аминокислоты, кроме глицина, имеющие один асимметрический - углеродный атом существуют в виде пары энантиомеров. Природные - аминокислоты с одним асимметрическим атомом углерода С * относятся к L-ряду (S-конфигурация).
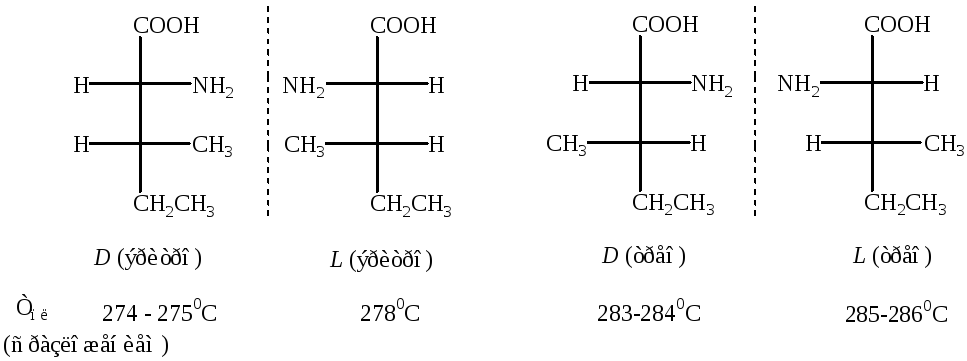
Гидроксипролин, треонин и изолейцин имеют два асимметрических атома углерода и существуют в виде двух D,L — пар.
Конфигурация D,L– пар для изолейцина
Природная аминокислота имеет конфигурацию L— трео:
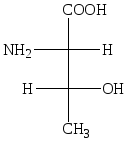
Аналогично изолейцину может быть описан треонин, ниже приводится конфигурация природного треонина.
L (трео) треонин (природная аминокислота)
Tпл 253 0 С (с разложением), []D 26 — 28,3 0 в H2O
Методы получения аминокислот
Оптически активные аминокислоты получают из белкового гидролизата, микробиологическим и ферментативным методами. При химических способах получения образуются рацематы, которые используют, либо как таковые, либо разделяют.
1. Аммонолиз галогенкарбоновых кислот
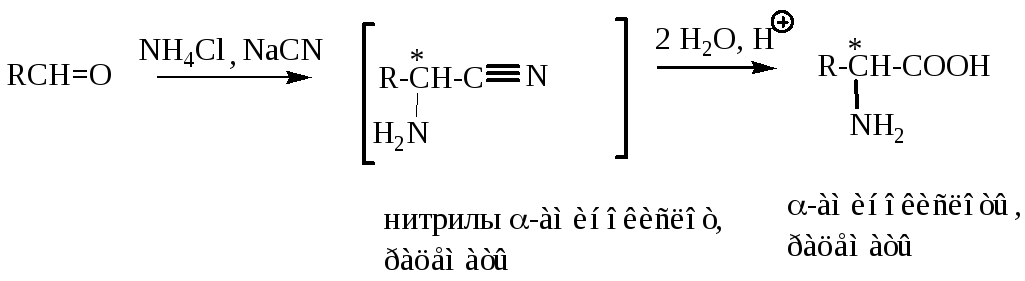
2. Синтез по Штекеру – Зелинскому (модификация циангидринного синтеза оксикислот)
Реакционная способность
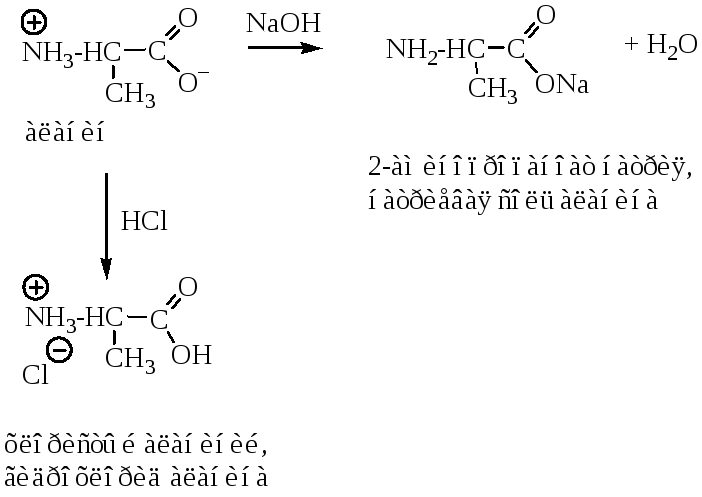
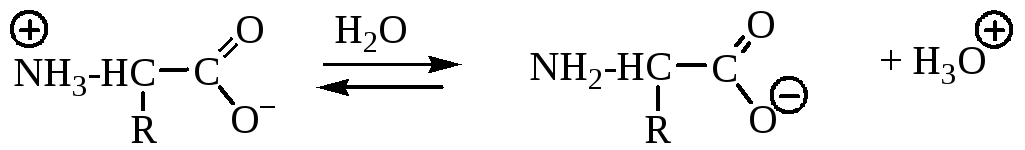
Аминокислоты, имея кислотную (карбоксильную) и основную (аминную) группу, являются амфотерными соединениями. Аминокислоты реагируют с кислотами и основаниями, при этом образуются соли.
Наличие кислотной и осно́вной групп в одной молекуле приводит к внутримолекулярному протонированию аминогруппы, поэтому аминокислоты существуют в виде внутренних солей – диполярных ионов, называемых цвиттер-ионами (от нем. cлова zwei — два).
Диполярный ион (цвиттер-ион)
За счет ионного строения аминокислоты являются кристаллическими веществами с высокими температурами плавления, хорошо растворимы в воде и плохо растворимы в органических растворителях.
Амфотерность аминокислот
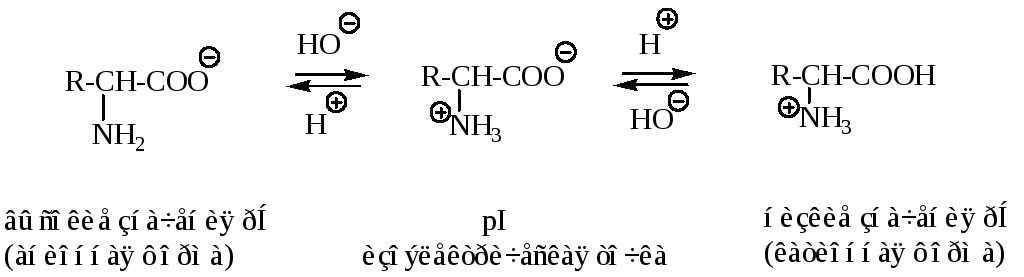
Значение рН, при котором аминокислота является электрически нейтральной (существует только в виде цвиттер-ионов), называется изоэлектрической точкой, рI.
В большинстве случаев водные растворы аминокислот имеют слабокислую реакцию, т.к. кислотность NH3 + выше основности группы СОО —
В воде аминогруппу протонируют молекулы воды.
Аминокислоты более сильные кислоты, чем карбоновые, но более слабые основания, чем первичные амины.
Реакции по амино- и карбоксильной группам
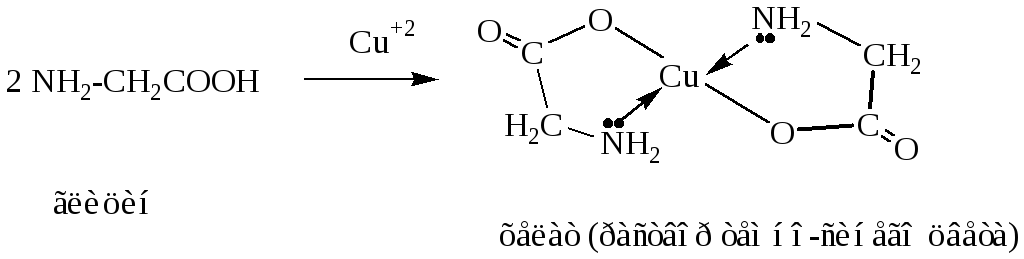
1. Образование хелатов с ионами тяжелых металлов, реакция относится к качественным.
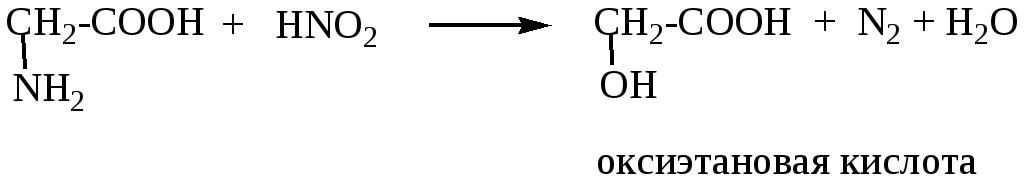
2. Реакция с NaNO2/HCl (HNO2)
По объему выделившегося азота определяют количество аминокислот в растворе.
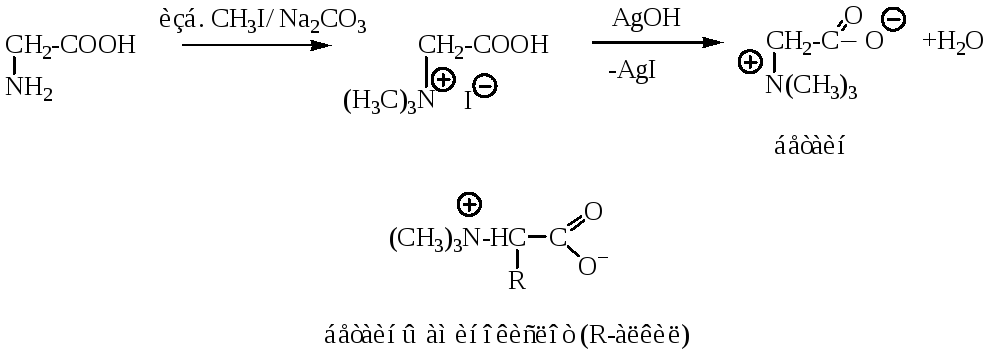
Исчерпывающее метилирование – первая стадия синтеза бетаинов, специфических производных -аминокислот, имеющих цвиттер-ионное строение. Бетаины имеют сладкий вкус и содержатся в некоторых растениях, например в свекле.
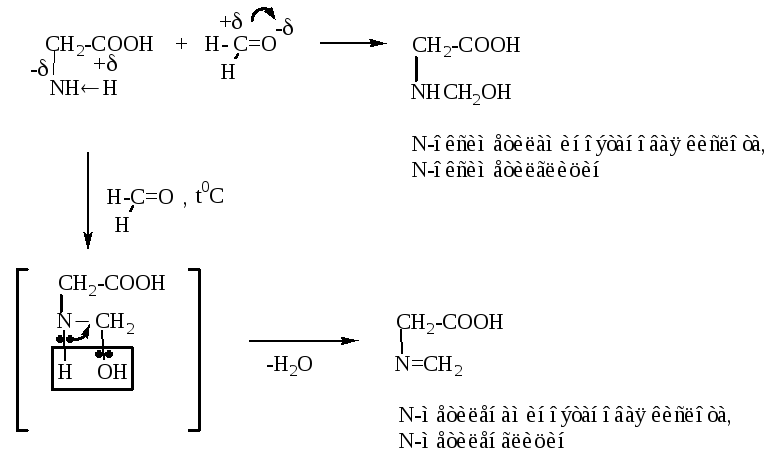
5. Реакция с формальдегидом
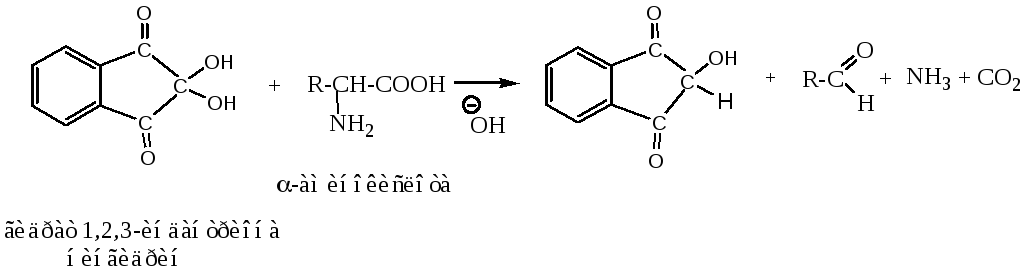
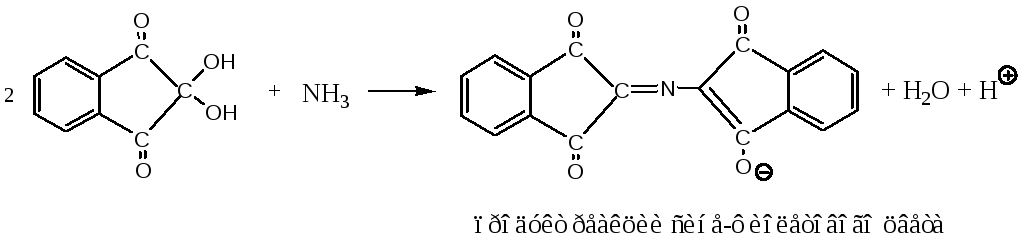
6. Нингидринная реакция (качественная)
Пролин и гидроксипролин, у которых нет — аминогрупп, в реакции с нингидрином образуют производное желтого цвета. Реакцию используют для колориметрического количественного определения аминокислот, в том числе в автоматических аминокислотных анализаторах.
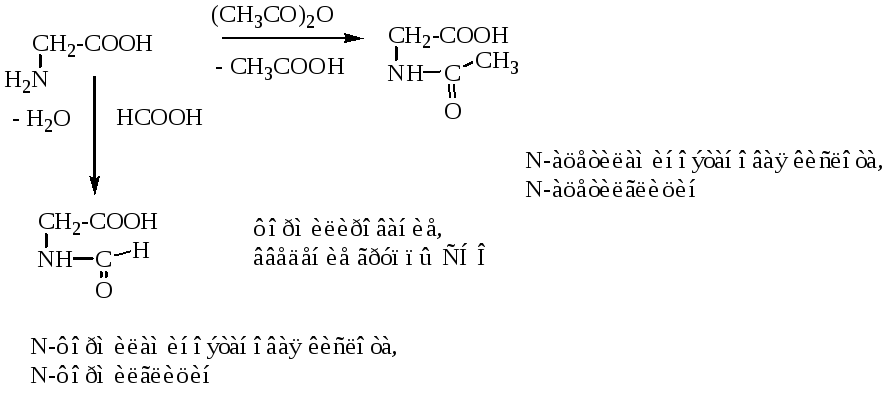
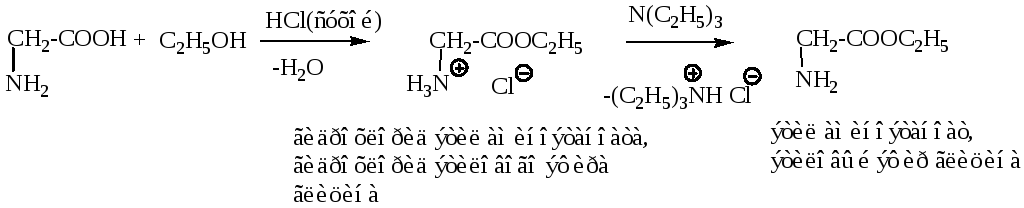
Этерификация аминокислот идет в два этапа. Сначала в присутствии хлористого водорода в качестве катализатора получают соль сложного эфира, а затем действием более сильного основания, например триэтиламина, выделяют сложный эфир аминокислоты.
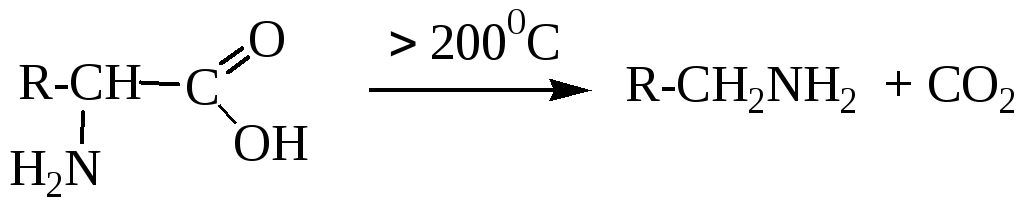
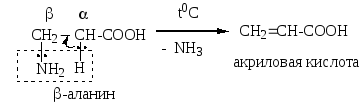
8. Декарбоксилирование (для -аминокислот)
9. Термическое поведение аминокислот
а) — аминокислоты
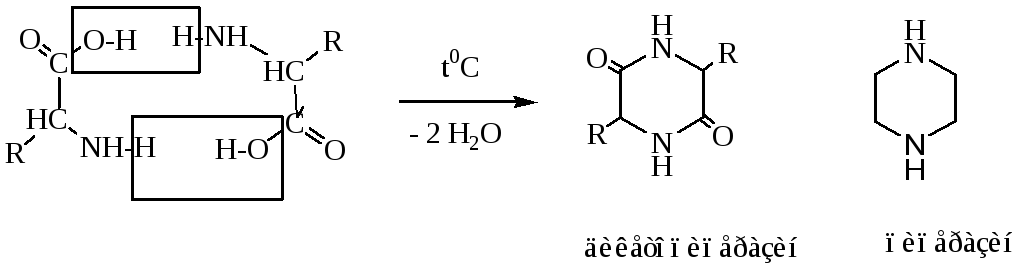
Межмолекулярная циклизация —аминокислот приводит к образованию 6-членного цикла — дикетопиперазина, содержащего два амидных фрагмента.
б) — аминокислоты
в) , , — аминокислоты
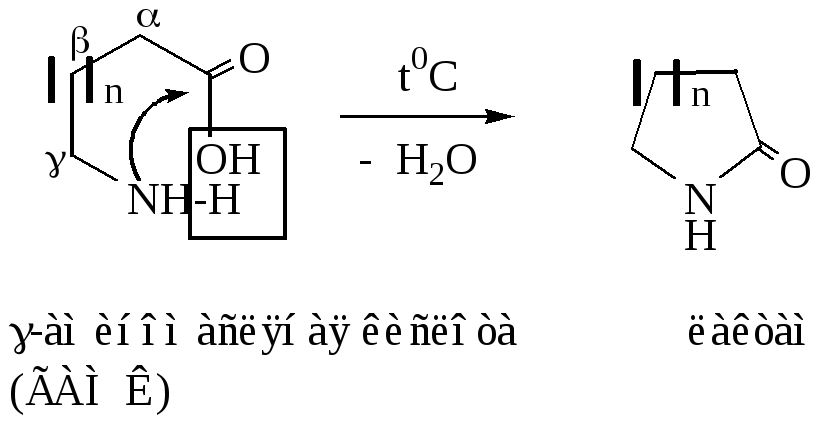
Внутримолекулярная циклизация , , — аминокислот с выделением молекулы воды дает очень важные производные аминокислот – циклические амиды, которые называпют лактамами. Лактамный фрагмент присутствует в структуре ряда лекарственных препаратов (ноотропил, фенотропил), в структуре пуриновых и пиримидиновых оснований, алкалоидов (см. соответствующие темы).
n=1, бутиролактам; n=2, валеролактам; n=3, капролактам
Источник
Аминокислоты, содержащие в радикале дополнительную аминогруппу или гуанидильный остаток.
Ароматические и гетероциклические аминокислоты:
Строение радикала кислоты
1.2. Стереоизомерия аминокислот
Все природные α-аминокислоты, кроме глицина (NH2 — CH2 — COOH), имеют асимметрический атом углерода (α-углеродный атом), а некоторые из них даже два хиральных центра, например, треонин. Таким образом, все аминокислоты могут существовать в виде пары несовместимых зеркальных антиподов (энантиомеров).
За исходное соединение, с которым принято сравнивать строение
α-аминокислот принимают D- и L-молочные кислоты, конфигурации которых, в свою очередь, установлены по D- и L-глицериновым альдегидам.
Все превращения, которые осуществляются в этих рядах при переходе от глицеринового альдегида к α-аминокислоте, выполняются в соответствии с главным требованием — они не создают новых и не разрывают старых связей у асимметрического центра.
Для определения конфигурации α-аминокислоты в качестве эталона часто используют серин (иногда аланин). Конфигурации их так же выведены из D- и L-глицериновых альдегидов:
Природные аминокислоты, входящие в состав белков, относятся к L-ряду.
D-формы аминокислот встречаются сравнительно редко, они синтезируются только микроорганизмами и называются «неприродными» аминокислотами. Животными организмами D-аминокислоты не усваиваются. D- и L-аминокислот по разному действуют на вкусовые рецепторы: большинство аминокислот L-ряда имеют сладкий вкус, а аминокислоты D-ряда — горькие или безвкусные.
2.Физические свойства аминокислот
Присутствие в молекуле у одного атома углерода двух функциональных групп приводит к появлению ряда специфических свойств.
Аминокислоты представляют собой нелетучие кристаллические вещества, плавящиеся с разложением при близких и довольно высоких температурах, поэтому идентификации аминокислот по температурам плавления достаточно затруднительна.
Аминокислоты очень плохо растворимы в неполярных растворителях типа петролейного эфира, диэтилового эфира, бензола и хорошо растворимы в воде.
Аминокислоты существуют в виде диполярного иона, который образуется за счет отщепления протона от карбоксильной группы и присоединения его к аминогруппе. Диполярный ион часто называют внутренней солью.
При подщелачивании раствора аминокислоты диполярный ион I превращается в анион II, так как более сильное основание (гидроксильный ион) отрывает протон от иона аммония и образуется более слабое основание — амин.
Если подкислить раствор аминокислоты, ион I превратится в катион III, так как более сильная кислота Н3О + отдает протон карбоксилат-иону и образуется более слабая кислота:
Ионы II и Ш, содержащие свободную аминогруппу или свободную карбоксильную группу, находятся в равновесии с диполярным ионом:
3.Химические свойства аминокислот
Понравилась статья? Добавь ее в закладку (CTRL+D) и не забудь поделиться с друзьями:
Источник
Оптическая изомерия аминокислот
Все -аминокислоты, кроме глицина, имеющие один асимметрический - углеродный атом существуют в виде пары энантиомеров. Природные - аминокислоты с одним асимметрическим атомом углерода С * относятся к L-ряду (S-конфигурация).
Гидроксипролин, треонин и изолейцин имеют два асимметрических атома углерода и существуют в виде двух D,L — пар.
Конфигурация D,L– пар для изолейцина
Природная аминокислота имеет конфигурацию L— трео:
Аналогично изолейцину может быть описан треонин, ниже приводится конфигурация природного треонина.
L (трео) треонин (природная аминокислота)
Tпл 253 0 С (с разложением), []D 26 — 28,3 0 в H2O
Методы получения аминокислот
Оптически активные аминокислоты получают из белкового гидролизата, микробиологическим и ферментативным методами. При химических способах получения образуются рацематы, которые используют, либо как таковые, либо разделяют.
1. Аммонолиз галогенкарбоновых кислот
2. Синтез по Штекеру – Зелинскому (модификация циангидринного синтеза оксикислот)
Реакционная способность
Аминокислоты, имея кислотную (карбоксильную) и основную (аминную) группу, являются амфотерными соединениями. Аминокислоты реагируют с кислотами и основаниями, при этом образуются соли.
Наличие кислотной и осно́вной групп в одной молекуле приводит к внутримолекулярному протонированию аминогруппы, поэтому аминокислоты существуют в виде внутренних солей – диполярных ионов, называемых цвиттер-ионами (от нем. cлова zwei — два).
Диполярный ион (цвиттер-ион)
За счет ионного строения аминокислоты являются кристаллическими веществами с высокими температурами плавления, хорошо растворимы в воде и плохо растворимы в органических растворителях.
Амфотерность аминокислот
Значение рН, при котором аминокислота является электрически нейтральной (существует только в виде цвиттер-ионов), называется изоэлектрической точкой, рI.
В большинстве случаев водные растворы аминокислот имеют слабокислую реакцию, т.к. кислотность NH3 + выше основности группы СОО —
В воде аминогруппу протонируют молекулы воды.
Аминокислоты более сильные кислоты, чем карбоновые, но более слабые основания, чем первичные амины.
Реакции по амино- и карбоксильной группам
1. Образование хелатов с ионами тяжелых металлов, реакция относится к качественным.
2. Реакция с NaNO2/HCl (HNO2)
По объему выделившегося азота определяют количество аминокислот в растворе.
Исчерпывающее метилирование – первая стадия синтеза бетаинов, специфических производных -аминокислот, имеющих цвиттер-ионное строение. Бетаины имеют сладкий вкус и содержатся в некоторых растениях, например в свекле.
5. Реакция с формальдегидом
6. Нингидринная реакция (качественная)
Пролин и гидроксипролин, у которых нет — аминогрупп, в реакции с нингидрином образуют производное желтого цвета. Реакцию используют для колориметрического количественного определения аминокислот, в том числе в автоматических аминокислотных анализаторах.
Этерификация аминокислот идет в два этапа. Сначала в присутствии хлористого водорода в качестве катализатора получают соль сложного эфира, а затем действием более сильного основания, например триэтиламина, выделяют сложный эфир аминокислоты.
8. Декарбоксилирование (для -аминокислот)
9. Термическое поведение аминокислот
а) — аминокислоты
Межмолекулярная циклизация —аминокислот приводит к образованию 6-членного цикла — дикетопиперазина, содержащего два амидных фрагмента.
б) — аминокислоты
в) , , — аминокислоты
Внутримолекулярная циклизация , , — аминокислот с выделением молекулы воды дает очень важные производные аминокислот – циклические амиды, которые называпют лактамами. Лактамный фрагмент присутствует в структуре ряда лекарственных препаратов (ноотропил, фенотропил), в структуре пуриновых и пиримидиновых оснований, алкалоидов (см. соответствующие темы).
n=1, бутиролактам; n=2, валеролактам; n=3, капролактам
Источник
оксо-,окси-,_аминокислоты
Глицилаланин или Gly-Ala б) аланил-серил-аспаргил-фенилаланил-глицин или Ala – Ser – Asp – Phe – Gly. Здесь аланин N-концевая аминокислота, а глутамин – С-концевая аминокислота. Классификация пептидов 1. Гомомерные – при гидролизе образуются только аминокислоты. 2. Гетеромерные – при гидролизе кроме α -аминокислот, образуются неаминокислотные компоненты, например: а) гликопептиды; б) нуклеопептиды; в) фосфопептиды. 155
Пептиды могут быть линейными или циклическими. Пептиды, в которых связи между аминокислотными остатками только амидные (пептидные), называются гомодетными. Если, кроме амидной группы, имеются сложноэфирные, дисульфидные группы пептиды называются гетеродетным. Гетеродетные пептиды, содержащие гидроксиаминокислоты называются пептолидами. Пептиды, состоящие из одной аминокислоты называются гомополиаминокислотами. Те пептиды, которые содержат одинаковые повторяющиеся участки (из одного или нескольких аминокислотных остатков), называют регулярными. Гетеромерные и гетеродетные пептиды называются депсипептидами .
| Строение пептидной связи | ||
| В амидах связь | углерод-азот | является частично двоесвязанной |
вследствие р, π -сопряжения НПЭ атома азота и π -связи карбонила (длина связи С-N: в амидах — 0,132 нм , в аминах — 0,147 нм), поэтому амидная группа является плоской и имеет транс-конфигурацию. Таким образом, пептидная цепь представляет собой чередование плоских фрагментов амидной группы и фрагментов углеводородных радикалов соответствующих аминокислот. В последних вращение вокруг простых связей незатруднено, следствием этого является образование различных конформеров. Длинные цепи пептидов образуют α -спирали и β-структуры (аналогично белкам).
| O | |||
| R * | C | CH | R |
| * | |||
| CH | N | ||
| H |
Синтез пептидов В процессе синтеза пептида должна образоваться пептидная связь между карбоксильной группой одной аминокислоты и аминной группой другой аминокислоты. Из двух аминокислот возможно образование двух дипептидов: 156
Источник