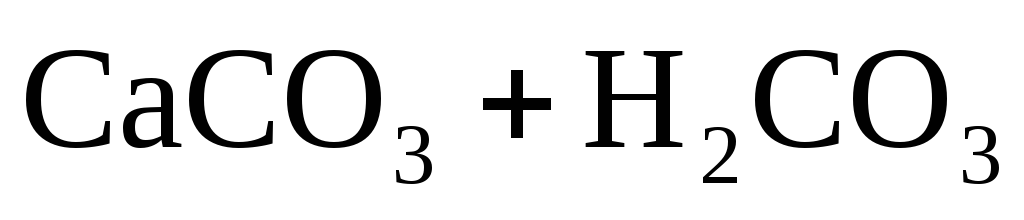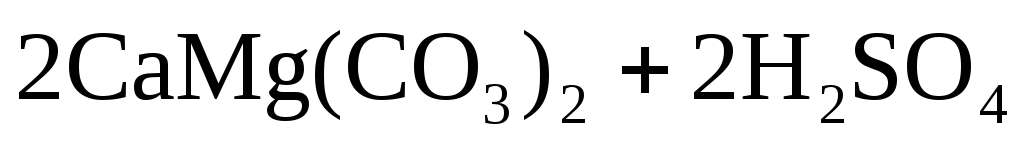Часть I. Водоподготовка Глава первая Основные характеристики природной воды
Природная вода, разделяемая условно на атмосферную (дождь, туман, снег), поверхностную (реки, озера, пруды, болота), подземную (артезианские скважины, шахтные колодцы) и морскую (моря, океаны), всегда содержит различные примеси. Характер и количество имеющихся в воде примесей определяет качество воды т.е. характеризует возможность использования ее для различных целей в промышленности и в быту.
Примеси поступают в воду, находящуюся в природном круговороте, из окружающей ее среды. Вода, занимающая около 70 % поверхности Земли, испаряясь, поступает в атмосферу, а после конденсации водяных паров в верхних слоях атмосферы возвращается на поверхность Земли в виде осадков, образуя поверхностные и подземные стоки и водоемы. Подземные стоки создаются при просачивании атмосферной воды в более или менее глубокие слои почвы, где вода собирается над водонепроницаемыми пластами, стекает по ним и выходит вновь на поверхность земли в местах выхода этих пластов, сливаясь с поверхностными стоками. Далее вода в руслах рек и ручьев перемещается к озерам, морям, водохранилищам, завершая этим свой природный круговорот.
Наряду с природным существует производственно-бытовой круговорот воды, создаваемый в результате потребления ее для различных целей (охлаждение, коммунальное водоснабжение и т.п.).
Примеси поступают в воду на всех этапах отмеченных круговоротов. При конденсации влаги в атмосфере в конденсате растворяется кислород, азот, углекислый газ в соответствии с их парциальными давлениями, а в промышленных районах – также значительное число оксидов серы и других продуктов, содержащихся в дымовых газах. Суммарное солесодержание атмосферных осадков составляет в среднем 10 мг/дм 3 . Просачиваясь через грунт, вода встречается с различными минеральными солями (NaCl,Na2SO4,MgSO4,CaCO3, силикатами и др.) и органическими веществами, растворяет или механически захватывает их. При одновременном присутствии в воде кислорода, органических веществ и микроорганизмов (бактерий), постоянно находящихся в поверхностных слоях почвы, создаются условия для перевода основных составляющих ряда органических веществ в минеральные кислоты (углерода в угольную, азота в азотную, серы в серную, фосфора в фосфорную и т.п.). Образующиеся в подпочвенных водах кислоты взаимодействуют с широко распространенными в природе известняками – карбонатами кальция, железа, доломитамиCaMg(CO3)2и другими породами, что приводит к поступлению в воду хорошо растворимых бикарбонатовCa,Mg,Fe, например:




Коренные горные породы – сложные силикаты (граниты, кварцевые породы), они весьма слабо растворимы в воде и лишь при длительном контакте обогащают воду растворимыми силикатами в небольшой концентрации (5–15 мг/дм 3 ).
При прохождении воды через толщу почвы, захваченные ею механические грубодисперсные примеси отфильтровываются, в связи с чем грунтовые (лежащие вблизи поверхности земли) и артезианские (лежащие более глубоко между двумя водонепроницаемыми пластами) воды характеризуются невысокой концентрацией взвешенных и органических примесей. В то же время десорбция углекислоты из таких вод затруднена в связи со слабым газообменом их с атмосферой, что приводит к интенсивному растворению карбонатных пород (см. уравнения реакций (1.1) – (1.3)) и большому насыщению подземных вод бикарбонатами.
Фильтрация воды через почву частично сопровождается ионообменной адсорбцией ионогенных примесей; так, почвенные комплексы хорошо задерживают фосфаты, происходит обмен адсорбированного почвой Na + на К + и т.п. Поэтому, несмотря на примерно одинаковую распространенность натрия и калия в природе, в поверхностной воде среднее соотношение концентраций [Na + ]:[К + ] составляет большей частью 10:1.
Существенно большим разнообразием примесей по сравнению с природными водами характеризуются производственно-бытовые стоки. По характеру загрязнений эти стоки подразделяют на три группы: бытовые сточные воды; производственные сточные воды; стоки, образующиеся при лесозащитных и растениеводческих работах.
Бытовые сточные воды и стоки лесозащитных и растениеводческих работ с применением реагентов имеют более или менее однообразный состав: белковые вещества и продукты их распада, жиры, мочевину, мыло, синтетические моющие средства, удобрения и т.п.
Эти примеси в основном относятся к классу органических веществ и в водной среде окисляются под действием кислорода и микроорганизмов.
Загрязнения производственных стоков определяются главным образом типом предприятия, на котором они образуются. Концентрация примесей (кислот, щелочей, нейтральных солей, нефтепродуктов, органических соединений) в сточных водах, подлежащих переработке и повторному использованию, может достигать несколько граммов на один кубичесий дециметр воды и оказывать резко отрицательное влияние на водно-химический и биохимический режимы водостока при аварийных сбросах: снижение концентрации кислорода, изменения рН, отравляющее действие, заиливание и т.п., поэтому бесконтрольный сброс сточных вод в природные водотоки запрещен в законодательном порядке.
Источник
Тема №3: основные показатели качества воды
Природная вода всегда содержит некоторое количество различных примесей.
Различают следующие виды природных вод:
Атмосферная – содержит кислород О2, азот N2, углекислый газ СО2, а в промышленных центрах пыль и другие загрязняющие вещества.
Подземная вода почти всегда прозрачна, свободна от взвешенных частиц, но содержит растворенные минеральные соли, характер которых зависит от того, какие подпочвенные слои вода омывала.
Поверхностные воды содержат минеральные и органические вещества, химический состав их не постоянный и зависит:
1)от химического состава питающего водоема поверхностных вод,
2)от времени года – зимой жесткость воды повышается, летом – уменьшается.
3)от количества атмосферных осадков (чем больше осадков, тем меньше жесткость)
Солесодержание от 200 до 1500 мг/кг. Солесодержание морских вод доходит до 15000-20000 мг/кг, а вода океанов имеет концентрацию различных солей около 35000 мг/кг.
Физические свойства воды.
Вода – прозрачная жидкость без цвета, запаха и вкуса.
Температура кипения = 100˚С, температура замерзания = 0˚С. При +4˚С вода имеет максимальную плотность.
Примеси в природной воде могут находиться в трех состояниях:
А) истинно-растворенном (диаметр частиц менее 1нм- нанометр=1/млн мм)
Б) коллоидно-растворенном (диаметр частиц от 1 до 100 нм)
В) грубодисперсном (диаметр частиц более 100 нм)
Основные показатели качества воды.
Совокупность свойств воды, обусловленная содержанием в ней примесей органического и минерального происхождения называется качеством воды.
Основными показателями качества природных вод являются: жесткость, щелочность, сухой остаток, окисляемость, прозрачность и др.
1.Прозрачность выражается в сантиметрах высоты столба воды, налитой в специальный стеклянный цилиндр, сквозь который еще возможно чтение стандартного шрифта (прозрачность по шрифту) или наблюдение крестообразно расположенных черных полосок толщиной 1мм на белом матовом фоне на дне цилиндра (прозрачность по кресту). Прозрачность приблизительно характеризует концентрацию взвешенных веществ.
2.Жесткость воды – суммарное содержание в воде катионов кальция 

Различают карбонатную (временную), некарбонатную (постоянную) и общую жесткость.
Карбонатная (временная) жесткость характеризуется присутствием в воде бикарбонатов кальция Ca(HCO3)2 и магния Mg(HCO3)2.
Эти соли при нагревании или кипячении воды в открытом сосуде распадаются, превращаясь в слаборастворимые соли – карбонат кальция СаСО3 и гидрат окиси магния Mg(OH)2, выпадающие в осадок.
Некарбонатная жесткость характеризуется содержанием в воде солей кальция и магния, которые удерживаются в ней после кипячения в открытых сосудах. Поэтому она называется постоянной жесткостью.
Солями постоянной жесткости являются:
Сернокислый кальций CaSO4,
и другие соли кальция и магния.
Общая жесткость воды равна сумме карбонатной (постоянной) и некарбонатной (временной) жесткости
В зависимости от общей жесткости воды делятся на:
2)средние – от 3 до 6 мг-экв/кг
3)жесткие – от 6 до 9 мг-экв/кг
4)очень жесткие – свыше 9 мг-экв/кг
3.Щелочностью воды называется общее содержание в ней гидрат-ионов 


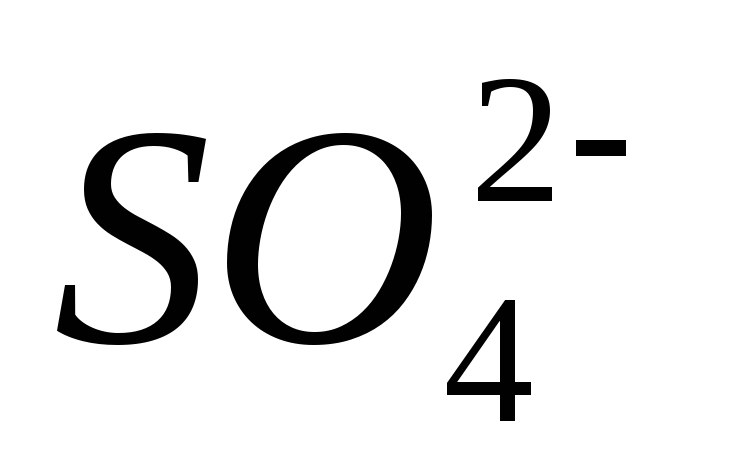
В зависимости от того, какой анион присутствует в воде, щелочность называют: бикарбонатной Щб, карбонатной Щк, гидратной Щг.
Единицы измерения: мг-экв/кг
4.Сухим остатком (общим солесодержанием) воды называется суммарное количество нелетучих веществ, присутствующих в воде в коллоидно- и истинно-растворенном состоянии, выраженное в мг/кг.
Сухой остаток определяют путем выпаривания 1л профильтрованной воды и последующего высушивания сухих веществ при температуре 102-110˚С до постоянной массы.
Следовательно, в понятие сухого остатка не входят растворенные в воде газы и взвешенные (грубодисперсные) вещества.
5.Окисляемость воды обычно выражается количеством мг кислорода, необходимых для окисления в определенных условиях органических веществ, содержащихся в 1 кг воды.
Источник