Общие свойства растворов
Очень многие химические реакции, в том числе технические и жизненно важные, протекают в жидкой фазе.
Растворы широко применяются в различных сферах деятельности человека. Они имеют большое значение для живых организмов. Человек, животные и растения усваивают питательные вещества в виде растворов. Растворами являются физиологические жидкости – плазма крови, лимфа, желудочный сок и др. Многие медицинские препараты являются растворами различных химических веществ в воде или в спирте.
Природная вода является раствором. В различных производственных и биологических процессах большую роль играют растворы электролитов. Свойства этих растворов объясняет теория электролитической диссоциации. Знание теории электролитической диссоциации является основой для изучения свойств неорганических и органических соединений и глубокого понимания механизмов химических реакций в растворах.
Растворами называют однородные системы, состоящие из двух или нескольких компонентов, состав которых можно изменять в определенных пределах без нарушения однородности.
Растворителем называется компонент, концентрация которого выше концентрации других компонентов.
Раствор это не механическая смесь, поскольку при растворении наблюдаются объемные и энергетические эффекты.
Раствор отличается от механической смеси гомогенностью, а от химического соединения:
a) переменным составом – от нуля до предела насыщения;
б) тем, что изменение свойств растворителя и растворённого вещества не носит радикальный характер.
Растворение – это самопроизвольный процесс, заключающийся во взаимодействии растворенного вещества с молекулами растворителя. Точка зрения Д. И. Менделеева:
раствор — это сложная равновесная химическая система, образованная растворителем, растворенным веществом и продуктами их взаимодействия.
Различают истинные и коллоидные растворы.
Истинные растворы — размер частиц ~10 -10 …10 -11 м, т.е. атомы или молекулы.
Коллоидные растворы — размер частиц ~ 10 -8 … 5×10 -10 м
твердое вещество – жидкость;
3) твердые: газ — твердое вещество,
твердое вещество — твердое вещество.
Жидкие растворы могут быть водные и неводные. Водные растворы – это растворы, в которых растворителем является вода.
Твёрдым раствором называется кристалл, кристаллическая решётка которого состоит из двух или более компонентов.
Растворы делятся на электролиты и неэлектролиты. Вещества, которые в растворе или расплаве полностью или частично распадаются на ионы и проводят электрический ток, называются электролитами.
Идеальным называется раствор, в котором не происходит химической реакции между компонентами, а силы межмолекулярного взаимодействия между взаимодействующими компонентами одинаковы.
Общие (коллигативные) свойства растворов те, которые не зависят от природы растворённых веществ, а зависит от количества растворенного вещества.
понижение давления насыщенного пара растворителя над раствором пропорционально мольной доле растворённого нелетучего вещества:
где и – давление насыщенного пара растворителя над чистым растворителем и над раствором, Па;
Первое следствие из закона Рауля: повышение температуры кипения DТкип пропорционально моляльной концентрации раствора:
где Кэ – эбулископическая постоянная растворителя,
Сm – моляльная концентрация, моль/1000 г.
Второе следствие из закона Рауля: понижение температуры замерзания DТзам пропорционально моляльной концентрации раствора:
где Кк – криоскопическая постоянная.
Кк и Кэ – зависят от природы растворителя:
где DНкип – удельная теплота испарения, ;
Ткип – температура кипения чистого растворителя, К;
где DНкриc. – удельная теплота кристаллизации, ;
Т крит . – температура кристаллизации чистого растворителя, К.
1.2.2 Осмотическое давление
Если система, разделённая мембраной, представляет собой растворы, в которых через мембрану способны проходить только молекулы растворителя, то свойства ее будут определяться разностью мольных долей (концентраций) растворителя по обе стороны мембраны.
Явление, связанное со способностью проходить через мембрану, в частности, только молекул растворителя, называется осмосом, а вызываемое им изменение давления по обе стороны мембраны – осмотическим давлением. Явление осмоса чрезвычайно разнообразно и во многом определяется природой мембраны и компонентов раствора.
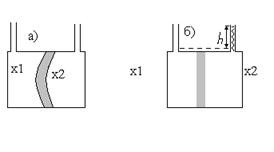
Представим, что сосуд с двумя горлами для добавления раствора разделён мембраной (рисунок 1). В каждую часть сосуда зальём растворы, отличающиеся только концентрацией. Поскольку мольные доли растворителя по обе стороны мембраны не совпадают, то стремление их к выравниванию приведёт к переходу части растворителя в ту часть сосуда, где концентрация растворённого вещества больше. Увеличение количества растворителя эквивалентно возрастанию давления, и если мембрана способна к деформации, она изогнётся в сторону с меньшей концентрацией растворённого вещества (рисунок 1а). Если мембрана жёсткая, то в отсеке с большой концентрацией количество растворителя будет возрастать до тех пор, пока гидростатическое давление h (рисунок 1а) не станет равным осмотическому давлению и не прекратит осмос.
Если внешнее давление больше атмосферного и приложено к более концентрированному раствору, то растворитель будет переходить в разбавленный раствор – обратный осмос.
Рисунок 10.1 — Схема разности осмотических давлений при концентрации x1
Осмотическое давление π – внутреннее давление растворенного вещества, численно равное тому внешнему давлению, которое нужно приложить, чтобы прекратить осмос; оно зависит от температуры и концентрации.
Согласно Вант-Гоффу осмотическое давление раствора численно равно тому газовому давлению, которое имело бы растворённое вещество, будучи переведенным в газообразное состояние в том же объёме и при той же температуре. Поскольку объем (разбавление) обратно пропорционален концентрации, то закон Вант-Гоффа можно записать в виде:
где СМ – молярная концентрация, моль/л.
Если растворы характеризуются одинаковыми осмотическими давлениями, то по Вант-Гоффу такие растворы называются изотоническими. Независимо от природы растворённого вещества, изотоничность является следствием одинакового числа частиц в растворе.
Поскольку при растворении реальное число частиц может отличаться от числа растворённых молекул, Вант-Гофф ввёл понятие изотонического коэффициента i. По определению это отношение числа всех частиц к числу растворённых молекул:
i = число частиц в растворе / число молекул в растворе. (10.7)
Если же в растворе преобладает не ассоциативный, а диссоциативный или ионизационный механизмы взаимодействия, то i > 1. Так, в одном растворе уксусная кислота диссоциирует:
и число частиц становится больше числа молекул.
1.2.3 Закон распределения Нернста – Шилова:
при постоянной температуре соотношение равновесных концентраций между несмешивающимися жидкостями является величиной постоянной, независимой от общего количества компонентов:
где Крас – коэффициент распределения;
Са и Сb – молярные концентрации веществ в растворах А и В, моль/л.
Источник
Природная и техническая вода
В методических указаниях рассмотрены показатели качества природной и технической воды, виды природных вод, их состав. Особое внимание уделяется методам водоподготовки, применяемым в технике для получения технической воды.
Указания предназначены для студентов Санкт-Петербургского государственного морского технического университета, обучающихся на технических специальностях.
ПРИРОДНАЯ И ТЕХНИЧЕСКАЯ ВОДА
Вода – самое распространеннное вещство на поверхности Земли (общий запас воды составляет 1.410 18 тонн). Она является наиболее важным и наименее понятным растворителем в природе.
Вода – оксид водорода, имеющий простейшую формулу Н2О. Однако молекулы воды сильно полярны, и между ними возникает сильное межмолекулярное взаимодействие – водородные связи. Их существование приводит к образованию ассоциатов – непрочных соединений переменного состава: (Н2О)n (n = 1 – 4, если n=1 – пар, n=2 – жидкость, n=3-4 – твердое тело). Образование ассоциатов обусловливает аномальные свойства воды:
Плотность воды возрастает при понижении температуры только до +4 о С и достигает при этой температуре максимального значения – 1г/см 3 (поэтому в водоемах холодная вода опускается вниз). При понижении температуры от +4 о С до 0 о С плотность немного уменьшается, а при замерзании она резко падает; плотность льда 0.91г/см 3 , т.е. он легче воды.
Температуры плавления (tпл) и кипения (tк) воды гораздо выше, чем у аналогичных соединений (H2S , H2Se – газы), поскольку сильное межмолекулярное взаимодействие затрудняет переход твердое тело жидкость газ.
Вода обладает максимальной среди жидкостей теплоемкостью. Благодаря этому она оказывает огромное влияние на климат и погоду на Земле.
Вода обладает отличной растворяющей способностью. Поскольку ее молекулы полярны, полярные вещества (соли, кислоты, щелочи) при растворении в ней подвергаются диссоциации, т.е. распадаются на ионы.
Природная вода
Природная вода – раствор многих веществ в воде. В природной воде содержатся соли, газы, органические вещества и т.д. Качество природной воды определяют путем химического анализа. Основными характеристиками природной воды являются ее соленость и жесткость.
Под соленостью природных вод понимают массу солей (в г), содержащихся в 1л природной воды. Содержание солей определяется составом грунтов, на которых расположен водоем. Из растворенных солей наиболее распространены сульфаты и хлориды натрия, кальция и магния.
По содержанию солей природные воды делятся: на пресные, соленость которых не превышает 1 г/л, на минерализованные, содержащие от 1 до 50 г/л, и на рассолы – свыше 50 г/л солей. На Земле содержится только 3% пресной воды, 97% — вода соленая.
Жесткость воды определяется количеством содержащихся в воде ионов кальция и магния. Она выражается в мэкв/л. Жесткость воды, обусловленная присутствием гидрокарбонатов кальция и магния (Ca(HCO3)2, Mg(HCO3)2), называется карбонатной (устранимой, временной). Сульфаты, хлориды, гидросиликаты (CaSO4, MgSO4, CaCl2, MgCl2, Ca(HSiO3)2, Mg(HSiO3)2) определяют некарбонатную (неустранимую, постоянную) жесткость. Вода считается мягкой, если ее жесткость менее 4 мэкв/л. У воды средней жесткости жесткость колеблется от 4 до 8 мэкв/л, у жесткой воды – от 8 до 12 мэкв/л. Если жесткость воды превышает 12 мэкв/л, то такая вода – очень жесткая. Масса 1 мэкв Ca 2+ составляет 20 мг, 1 мэкв Mg 2+ составляет 12 мг.
Щелочность воды обусловлена присутствием в воде солей слабых кислот и сильных оснований, которые в результате гидролиза создают щелочную среду:
Газы (О2, СО2, N2 и др.) появляются в природной воде вследствие растворения атмосферных газов и химических процессов, протекающих в водоемах. В 1л природной воды содержится от 2 до 8 мл кислорода, т.е. его в 160 раз меньше, чем в воздухе. Однако относительное содержание О2 в воде больше:
где С(O2), C(N2) – концентрации соответствующих газов.
Хорошо растворяется в воде углекислый газ, благодаря взаимодействию с водой: СО2 + Н2О = Н2СО3 = Н + + НСО3 — .
Различают три вида природных вод: атмосферная влага, материковые воды и морская вода.
Атмосферная влага (дождевая вода, снег, лед) содержит наименьшее количество примесей – это только пыль и растворенные газы.
Материковые воды (реки, озера) содержат вещества, попадающие в них из грунтов и почв. Так минеральный состав речной воды определяется химическим составом пород, слагающих бассейн реки, рельефом, климатом. Материковые воды делятся на поверхностные и подземные. Поверхностные воды содержат от 0.05 до 1.6 г/л солей. В основном это катионы Са 2+ , Mg 2+ и Na + и анионы НСО3 — , SO4 2- и Cl — . В материковых водах чаще всего наблюдается соотношение концентраций анионов: НСО3 — >SO4 2- > Cl — и катионов: Са 2+ > Mg 2+ > Na + . Особенно богаты Са 2+ и Mg 2+ (т.е. являются жесткими) воды рек (озер), протекающих по известковым породам (СаСО3 – известняк, СаСО3 MgСО3 – доломит). По значениям солености воды рек делятся следующим образом:
малая соленость – до 0.2 г/л;
Большинство рек нашей страны отличаются невысокой соленостью и содержанием Са 2+ и НСО3 — . Вода большинства рек мира имеет малую и среднюю соленость (Таблице1).
Источник