Природные агонисты дофаминовых рецепторов
Отравление стимуляторами дофаминовых рецепторов (агонистов) и его побочные эффекты
Дофамин — это катехоламин, являющийся непосредственным предшественником норадреналина. Его эффекты в организме напрямую связаны с воздействием на альфа-, бета-адренергические и дофаминергические рецепторы. При стимуляции этих рецепторов повышается уровень цАМФ, что усиливает поступление в клетку кальция.
Количество дофамина определяет, какой тип рецепторов преимущественно им стимулируется. Низкие дозы (0,5—1,5 мкг/кг в 1 мин) стимулируют в основном дофаминергические рецепторы. Умеренные дозы (2—4 мкг/кг в 1 мин) действуют в первую очередь на b1-рецепторы миокарда. В результате возрастают сила и частота сокращений последнего, что ведет к увеличению минутного сердечного выброса.
При скорости вливания 5—10 мкг/кг в 1 мин преобладает стимуляция a-рецепторов. Это ведет к периферическому сужению сосудов и повышению кровяного давления. Если доза превышает 20 мкг/кг в 1 мин, сосудосуживающий а-эффект преобладает над b1-эффектом.
Агонисты дофаминовых рецепторов средства стимулируют дофаминовые рецепторы. Действуя на постсинаптические рецепторы в полосатом теле, они позволяют ему функционировать независимо от ферментной системы синтеза дофамина в пресинаптических нейронах, начинающихся в черном веществе. Период полужизни у агонистов большой.
Они не повышают уровень самого дофамина и специфичны в отношении тех или иных подтипов дофаминовых рецепторов. Кроме того, они лишены свойств норадреналина и серотонина. Из этих агонистов в США официально доступны только бромокриптин и перголид.
а) Токсикокинетика стимуляторов дофаминовых рецепторов (агонистов):
— Взаимодействие лекарственных средств. Бикарбонат натрия инактивирует как дофамин, так и добутамин. Этой проблемы помогает избежать тщательное мытье сосудов для внутривенных вливаний. Недавнее введение бета-блокаторов снижает эффективность применения дофамина.
— Беременность. Ни одно из средств, перечисленных в таблице ниже, не рекомендуется применять во время беременности, если нельзя гарантировать, что потенциальная польза перевешивает риск для плода.
б) Клиническая картина отравления стимуляторами дофаминовых рецепторов:
— Гиповолемия. Гиповолемия может быть одной из главных причин низкого сердечного выброса. К такому состоянию потенциально предрасполагает интенсивное применение диуретиков. Перед назначением дофамина необходимо скорректировать водный баланс организма.
— Острый инфаркт миокарда. Дофамин способен стимулировать сократимость миокарда и тем самым увеличивать потребление им кислорода. Это в свою очередь грозит расширением пораженной инфарктом области.
— Применение при пороках сердечных клапанов. У пациентов с тяжелыми пороками легочного или аортального клапана стимуляция дофамином сердечной сократимости может затруднять прохождение через них крови.
— Транссудация дофамина. Транссудация дофамина из сосудов в окружающие ткани чревата некрозом и отторжением некротических участков. Вливание обычно проводят в центральную или другую крупную вену. Если происходит транссудация, в течение 12 ч с ее начала в пораженный участок нужно подкожно впрыснуть фентоламин (Regitin).
— Окклюзионная болезнь сосудов. Необходимо внимательно следить за изменением цвета кожи, чувствительности и температуры конечностей пациента. Вливание следует уменьшить или прекратить по показаниям.
— Феохромоцитома. Дофамин противопоказан пациентам с диагностированной или подозреваемой феохромоцитомой в связи с возможным развитием тяжелой гипертензии.
— Железо и дофаминовые D2-рецепторы. Железо модулирует работы D2-рецепторов и является их составной частью. Его низкий сывороточный уровень, приводя к гипофункции D2-рецепторов, чреват повышением риска акатизии у пациентов, принимающих антипсихотические средства.
— Агонисты дофаминовых рецепторов при паркинсонизме. Бромокриптин (Parlodel), лизергид и перголид (Реппах) являются дофаминергическими агонистами, получаемыми из спорыньи. Они быстро всасываются в пищеварительном тракте и в значительной мере метаболизируются печенью.
Период полужизни в плазме у бромокриптина равен 7, у лизергида — 2, а у перголида — более 7 ч. Все 3 вещества стимулируют D2-рецепторы, а перголид, кроме того, действует на D1-рецепторы. Клиническое значение этой разницы неясно. Все 3 средства могут вызывать спутанность сознания, галлюцинации, паранойю, тошноту и рвоту. Кроме того, эти алкалоиды спорыньи способны привести к периферической ишемии.
Бромокриптин в редких случаях вызывал плевральный, легочный или забрюшинный фиброз. Сходный эффект возможен при использовании высоких доз и других алкалоидов спорыньи. Все 3 названных вещества приводили также к постуральной гипотензии.
— Плеврально-легочная болезнь. Плеврально-легочная болезнь (ПЛБ) может возникнуть при лечении бромокриптином, мезулергином, лизуридом и каберголином; все они являются дофаминовыми агонистами. Другие алкалоиды спорыньи со сходной молекулярной структурой: метисергид, эрготамин и бромокриптин — связывают с развитием как ПЛБ, так и забрюшинного фиброза.
Все эти вещества — тетрациклические соединения. Большинство пациентов, у которых во время бромокриптиновой терапии развилась ПЛБ, получали высокие его дозы (>20 мг) в течение продолжительного времени (>6 мес). К частым симптомам ПЛБ относятся одышка, плевритическая боль и непродуктивный кашель.
Редактор: Искандер Милевски. Дата обновления публикации: 21.12.2022
Источник
Дофамин
Дофаминергическая теория патогенеза шизофрении пользовалась популярностью на протяжении последней четверти ХХ века. Представляется значимым познакомить читателя с основными положениями современного учения о дофамине.
Дофамин является не только предшественником норадреналина, но и сам выступает в роле трансмиттера. Локализация дофамина в нервной системе отличается от локализации других катехоламинов: норадреналина и адреналина.
Богатая сеть чувствительных к дофамину рецепторов выявлена во многих структурах центральной нервной системы.
Вся обширная зона срединного возвышения занята дофаминергическими терминалями, и только единичные окончания нервных клеток этой области чувствительны к норадреналину.
| | Для того, чтобы назначить правильное лечение при шизофрении, необходимо провести ее комплексную диагностику |
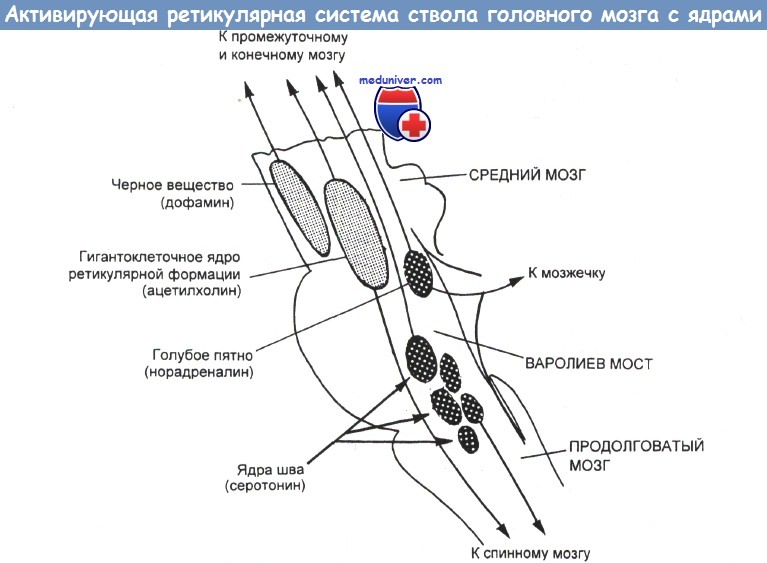
Нейроны, чувствительные к дофамину, в основном сконцентрированы в следующих структурах: черной субстанции, вентральной покрышке, полосатом теле, обонятельной луковице, гипоталамусе (аркуатное ядро), вокруг желудочков продолговатого мозга (перивентрикулярная область) и сетчатке.
Аксоны нейронов, чувствительных к дофамину, проецируются в лобную кору (окончания рецепторов, чувствительных к дофамину в коре мозга встречаются довольно редко), лимбическую систему, неостриатум, срединное возвышение.
Базальные ганглии состоят из хвостатого ядра и скорлупы (неостриатум), внутреннего и наружного сегментов бледного шара, ретикулярной и компактной частей черной субстанции и субталамического ядра.
Неостриатум считается основной частью базальных ганглиев, получающих информацию от всей коры в соответствии с соматотопической проекцией, а также от интраламинарных ядер таламуса. Информация поступает из базальных ганглиев через внутренний сегмент бледного шара и ретикулярную черную субстанцию, проходит через ядра таламуса (передневентральное и вентролатеральное), которые проецируются на премоторную область коры, дополнительную моторную зону и префронтальную кору. Проекция также распространяется на спинной мозг, особенно педункулопонтинное ядро, принимающее участие в локомоторных актах, а также к верхним бугоркам четверохолмия, принимающим участие в регуляции движений глаз. Базальные ганглии образуют несколько кругов нейронных сетей. В стрианигростриарном круге последнее звено — дофаминергическое. Неостриатум состоит из полос и стриосом, которые содержат небольшое количество ацетилхолинэстеразы (АцхЭ).
Основная масса постсинаптических рецепторов дофамина, как отмечалось выше, сосредоточена в полосатом теле, в области бледного шара и хвостатого ядра. К нейронам этих ядер подходят волокна клеток черной субстанции, в то время как аксоны бледного шара и хвостатого ядра идут в обратном направлении, образуя нигростриатную систему, играющую важную роль в регуляции психических и двигательных реакций.
Дофамин депонируется в крупных пузырьках синапса. После выброса (экзоцитоз) в синаптическую щель он взаимодействует с различными видами рецепторов. Затем инактивируется во внеклеточном пространстве или в клетках глии и, как другие катехоламины, разрушается с помощью двух ферментов — моноаминооксидазы (МАО) и катехол-о-метилтрансферазы (СОМТ). Описано два типа моноамиооксидаз (МАО-А и МАО-В).
В отличие от полосатого тела у префронтальной коры нет переносчиков, дофамина, последние являются белковыми соединениями, осуществляющими обратный захват. Кроме того, по своей структуре они напоминают белковые соединения, представляющие рецепторы серотонина. Белки обратного захвата могут быть блокированы, как в случае применения ингибиторов обратного захвата серотонина, или вообще отсутствовать, как в случае шизофрении в области префронтальной коры. Во всех этих случаях ферменты (СОМТ), расщепляющие нейротрансмиттеры начинают играть крайне важную роль. Таким образом, не подлежит сомнению влияние СОМТ на активность дофамина в области префронтальной коры.
Результаты исследований, проводимых на животных, показали, что СОМТ участвует в расщеплении более 60% дофамина, находящегося в области префронтальной коры. Подчеркнем, что дофамин префронтальной коры принимает участие в когнитивных процессах. Усиление активности дофамина в префронтальной коре, согласно исследованиям, проведенным на больных, страдающих болезнью Паркинсона, способствует улучшению когнитивных функций. Получается, что дофамин позволяет как бы сконцентрировать большую часть энергии в тех областях мозга, которые участвуют в обработке информации. Нарушение трансмиссии дофамина приводит к дефициту внимания.
В катехоламинергических нейронах и их аксонах доминирует МАО-В. Часть неразрушенного медиатора с помощью захвата специальной транспортной системой переносится обратно в окончание рецептора (внутринейрональный метаболизм) и может быть использована повторно.
Рецепторы, чувствительные к дофамину, представляют собой медленные метаботропные рецепторы. Длинная полипептидная цепь семь раз пересекает мембрану, гликозилированный N-конец обращен во внеклеточное пространство, а С-конец находится в цитоплазме. Рецепторы дофамина через G-белки сопряжены с аденилатциклазой.
Дофаминовые рецепторы могут быть локализованы как пост-, так и пре- синаптически, в частности, на норадренергических и дофаминергических нервных окончаниях, контролируя таким образом высвобождение медиаторов. Так, например, пресинаптические рецепторы D3 типа, могут регулировать выброс дофамина.
Выделяют четыре основных восходящих дофаминергических тракта:
- Нигростриатный
- Мезолимбический
- Мезокортикальный
- Тубероинфундибулярный
Первый нигростриатный путь начинается от нейронов черной субстанции (substantia nigra), ядра А9 (в зависимости от рострокаудальной локализации катехоламиновые нейроны классифицированы от А1 до А15). Аксоны нейронов, расположенных в черной субстанции, простираются до дорсальной части тела стриатума (corpus striatum). Нигростриатный путь имеет отношение к регуляции (координации) моторных (сенсомоторных) функций организма, когнитивной интеграции, формированию стереотипных действий и инициации двигательных актов, а блокада дофаминовой трансмиссии в этом тракте нейролептиками проявляется симптомами паркинсонизма.
Нигростриатный путь
- Когнитивная интеграция
- Стереотипные действия
- Сенсомоторная координация
- Инициация двигательных актов
Второй дофаминергический путь — мезолимбический — формируется от нейронов вентрального поля покрышки (А10) и идет к структурам лимбической области: прилежащему ядру, обонятельным луковицам, миндалине, периформной коре.
Третий — мезокортикальный начинается также от А10, но направляется к префронтальной коре.
Согласно одной из гипотез патогенеза шизофрении, начало болезни обусловлено снижением активности дофаминергической мезокортикальной системы, тогда как продуктивные симптомы психоза возникают в связи с усилением активности дофаминергической мезолимбической системы (возможно, и кортиколимбической)
Мезокортикальный тракт
Четвертый тубероинфундибулярный путь идет от ядер покрышки к гипоталамусу.
В таблице 10 в общем виде отражена роль дофаминергических трактов в патогенезе некоторых клинических симптомов шизофрении.
Таблица 10. Роль дофаминергических трактов в патогенезе симптомов шизофрении
Дофаминергический тракт
Источник

