- В большинстве реакций Si выступает в роли восстановителя:
- В реакциях с металлами Si — окислитель:
- Силан (моносилан) SiH4
- Оксид кремния (IV) (кремнезем) SiO2
- Физические свойства
- Химические свойства
- Кремниевые кислоты
- Способы по-лучения
- Химические свойства
- Силикаты — соли кремниевых кислот
- Стекло
- Цемент
- Кремний
- Природные соединения кремния:
В большинстве реакций Si выступает в роли восстановителя:
При низких температурах кремний химически инертен, при нагревании его реакционная способность резко возрастает.
1. С кислородом взаимодействует при Т выше 400°С:
Si + О2 = SiO2 оксид кремния
2. С фтором реагирует уже при комнатной температуре:
Si + 2F2 = SiF4 тетрафторид кремня
3. С остальными галогенами реакции идут при температуре = 300 — 500°С
4. С парами серы при 600°С образует дисульфид:
5. Реакция с азотом происходит выше 1000°С:
6. При температуре = 1150°С реагирует с углеродом:
По твердости карборунд близок к алмазу.
7. С водородом кремний непосредственно не реагирует.
8. Кремний стоек к действию кислот. Взаимодействует только со смесью азотной и фтороводородной (плавиковой) кислот:
9. реагирует с растворами щелочей с образованием силикатов и выделением водорода:
10. Восстановительные свойства кремния используют для выделения металлов из их оксидов:
В реакциях с металлами Si — окислитель:
Кремний образует силициды с s-металлами и большинством d-металлов.
Состав силицидов данного металла может быть различен. (Например, FeSi и FeSi2; Ni2Si и NiSi2.) Один из наиболее известных силицидов — силицид магния, который можно получать прямым взаимодействием простых веществ:
Силан (моносилан) SiH4
Силаны (кремневодороды) SinH2n + 2, (ср. с алканами), где п = 1-8. Силаны — аналоги алканов, отличаются от них неустойчивостью цепей -Si-Si-.
Моносилан SiH4 — бесцветный газ с неприятным запахом; растворяется в этаноле, бензине.
1. Разложение силицида магния соляной кислотой: Mg2Si + 4HCI = 2MgCI2 + SiH4
2. Восстановление галогенидов Si алюмогидридом лития: SiCl4 + LiAlH4 = SiH4↑ + LiCl + AlCl3
Силан — сильный восстановитель.
1.SiH4 окисляется кислородом даже при очень низких температурах:
2. SiH4 легко гидролизуется, особенно в щелочной среде:
Оксид кремния (IV) (кремнезем) SiO2
Кремнезем существует в виде различных форм: кристаллической, аморфной и стеклообразной. Наиболее распространенной кристаллической формой является кварц. При разрушении кварцевых горных пород образуются кварцевые пески. Монокристаллы кварца — прозрачны, бесцветны (горный хрусталь) или окрашены примесями в различные цвета (аметист, агат, яшма и др.).
Аморфный SiO2 встречается в виде минерала опала: искусственно получают силикагель, состоящий из коллоидных частиц SiO2 и являющийся очень хорошим адсорбентом. Стеклообразный SiO2 известен как кварцевое стекло.
Физические свойства
В воде SiO2 растворяется очень незначительно, в органических растворителях также практически не растворяется. Кремнезем является диэлектриком.
Химические свойства
1. SiO2 — кислотный оксид, поэтому аморфный кремнезем медленно растворяется в водных растворах щелочей:
2. SiO2 взаимодействует также при нагревании с основными оксидами:
3. Будучи нелетучим оксидом, SiO2 вытесняет углекислый газ из Na2CO3 (при сплавлении):
4. Кремнезем реагирует с фтороводородной кислотой, образуя кремнефтористоводородную кислоту H2SiF6:
5. При 250 — 400°С SiO2 взаимодействует с газообразным HF и F2, образуя тетрафторсилан (тетрафторид кремния):
Кремниевые кислоты
— ортокремниевая кислота H4SiО4;
— метакремниевая (кремниевая) кислота H2SiO3;
— ди- и поликремниевые кислоты.
Все кремниевые кислоты малорастворимы в воде, легко образуют коллоидные растворы.
Способы по-лучения
1. Осаждение кислотами из растворов силикатов щелочных металлов:
2. Гидролиз хлорсиланов: SiCl4 + 4Н2О = H4SiO4 + 4HCl
Химические свойства
Кремниевые кислоты — очень слабые кислоты (слабее угольной кислоты).
При нагревании они дегидратируются с образованием в качестве конечного продукта кремнезема
Силикаты — соли кремниевых кислот
Поскольку кремниевые кислоты чрезвычайно слабые, их соли в водных растворах сильно гидро лизованы:
SiO3 2- + Н2О = HSiO3 — + ОН — (щелочная среда)
По этой же причине при пропускании углекислого газа через растворы силикатов происходит вытеснение из них кремниевой кислоты:
Данную реакцию можно рассматривать как качественную реакцию на силикат-ионы.
Среди силикатов хорошо растворимыми являются только Na2SiO3 и K2SiO3, которые называются растворимым стеклом, а их водные растворы — жидким стеклом.
Стекло
Обычное оконное стекло имеет состав Na2O • СаО • 6SiO2, т. е. является смесью силикатов натрия и кальция. Его получают сплавлением соды Na2CO3, известняка СаСO3 и песка SiO2;
Цемент
Порошкообразный вяжущий материал, образующий при взаимодействии с водой пластичную массу, превращающуюся со временем в твердое камневидное тело; основной строительный материал.
Химический состав наиболее распространенного портланд-цемента (в % по массе) — 20 — 23% SiO2; 62 — 76 % СаО; 4 — 7 % Al2O3; 2-5% Fe2O3; 1- 5% МgО.
Источник
Кремний
Кремний — неметаллический элемент IVa группы периодической таблицы Д.И. Менделеева. Второй после кислорода элемент по распространенности в земной коре.
В чистом виде в природе практически отсутствует. Чаще всего встречается в виде кремнезема — SiO2 — песок, песчаник, кварц, глина.
Кремниевая (силиконовая) долина
Регион в штате Калифорния (США), отличающийся большой плотностью высоко технологичных компаний, связанных с производством компьютеров и микропроцессоров.
Кремний является природным полупроводником, используется как основной материал для производства микросхем. Кремний ближе, чем вы думаете: внутри гаджета, которым вы пользуетесь 😉
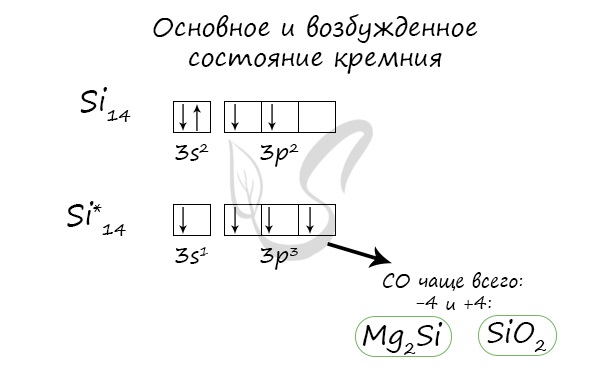
Основное и возбужденное состояние кремния
При возбуждении атома кремния электроны на s-подуровне распариваются и один из них переходит на p-подуровень.
Природные соединения
- SiO2 — кварц, кремнезем, гранит, песчаник, песок, глина
- SiO2 с примесью Fe 3+ — цитрин
- SiO2 с примесью Fe 2+ и Fe 3+ — аметист
Получение
В промышленности кремний получают путем восстановления кремнезема в электрических печах, алюминотермией.
В лабораторных условиях мелкий белый песок прокаливают с магнием:
Химические свойства
При обычных условиях без нагревания кремний реагирует только со фтором.
При нагревании кремний вступает в реакции с остальными галогенами (Cl, Br, I), углеродом, кислородом. При очень высоких температурах (1200 °C) кремний с кислородом образует оксид кремния II — несолеобразующий оксид.
В подобных реакциях кремния проявляет свои окислительные способности.
Ca + Si → Ca2Si (силицид кальция)
С целью травления (удаления поверхностного слоя материала) кремниевые изделия можно погружать в раствор щелочи.
Оксид кремния IV — SiO2
Оксид кремния IV имеет атомное строение, обладает высокой прочностью и твердостью. Плавится при температуре +1730 °C градусов.
В промышленности оксид кремния IV получают нагреванием кремния в атмосфере кислорода.
В лабораторных условиях проводят реакция силиката натрия с уксусной кислотой. Кремниевая кислота сразу же распадается на SiO2, который выпадает в осадок, и воду.
Химически SiO2 устойчив к действию кислот, однако вступает в реакцию с газообразным фтороводородом (газом) и плавиковой кислотой (жидкостью).
SiO2 является кислотным оксидом, соответствует кремниевой кислоте. Вступая в реакции с основными оксидами и щелочами, образует соли данной кислоты — силикаты.
Так как чаще всего кислотные оксиды с солями не реагируют, тем более необычной кажется реакция оксида кремния IV с карбонатами.
Кремниевая кислота
Слабая, малорастворимая в воде кислота. Ее соли носят название — силикаты.
Поскольку кремниевая кислота малорастворима, то банальной реакцией SiO2 с водой ее не получить. Эту задачу решают в две стадии через ее соли — силикаты.
Кремниевая кислота слабая, нестойкая, легко распадается на воду и оксид кремния IV.
© Беллевич Юрий Сергеевич 2018-2023
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
Блиц-опрос по теме Кремний
Источник
Природные соединения кремния:
Кремний применяется в силикатной промышленности: 


Источник