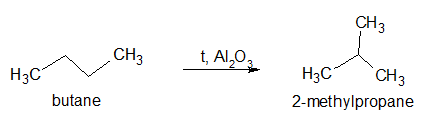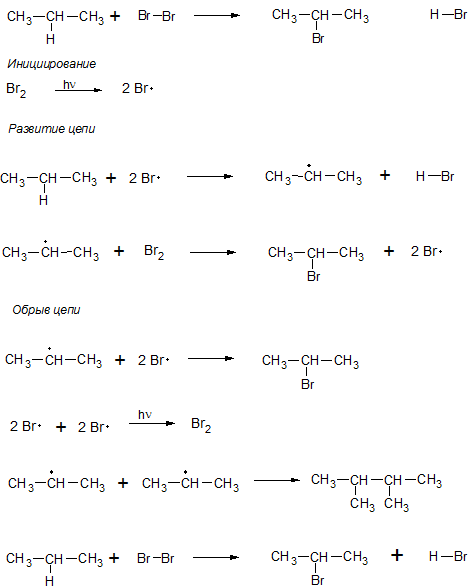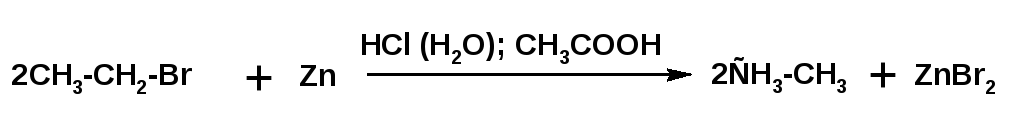Получение и химические свойства алканов
Рассмотрим получение и химические свойства алканов. В промышленности основным исходным сырьем для получения алканов служат такие природные источники как нефть и природный газ. Нефть – сложный природный объект, основную массу которого составляют углеводороды (УВ) трех гомологических рядов – алканы, циклоалканы и арены, однако наиболее широко представлены углеводороды смешанного гибридного строения. В составе различных фракций нефти содержатся алканы с числом углеродных атомов от 5 до 30. На 95% природный газ состоит из метана, остальные 5% — примесью этана и пропана.
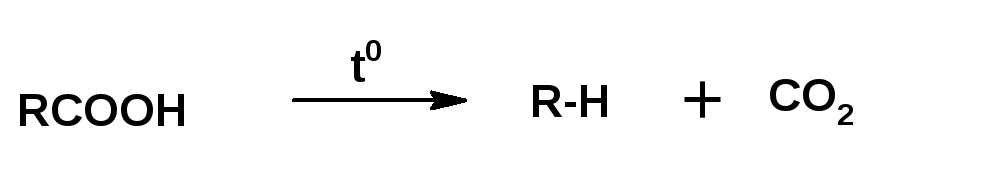
Алканы выделяют из сырья путем фракционной перегонки, основанной на разности температур кипения. Однако выделение чистых индивидуальных алканов является сложным процессом, поэтому чаще всего получают их смеси. Другим способом их получения является крекинг — термическое разложение углеводородов, в результате которого в углеводородной цепи соединений с более высокой молекулярной массой происходит разрыв углерод-углеродной связи с образованием соединений с более низкой молекулярной массой.
Различают термический крекинг и каталитический крекинг.
Термический крекинг был открыт русским инженером В.Г. Шуховым в 1891 г. Термический крекинг проводят при температуре 450–700 o С. При этом происходит разрыва С–С связей высококипящих алканов с образованием более низкокипящих алканов и алкенов:
При температуре более 1000°С происходит разрыв как С–С связей, так и более прочных С–Н связей.
Каталитический крекинг осуществляется при температуре 500°С, атмосферном давлении в присутствии катализаторов (чаще всего оксидов алюминия и кремния). В этом случае разрыв связей молекул сопровождается реакциями изомеризации и дегидрирования.
Синтетические методы получения алканов
1.Гидрирование ненасыщенных углеводородов.
Реакцию осуществляют в присутствии катализаторов (Ni, Pd) при нагревании:
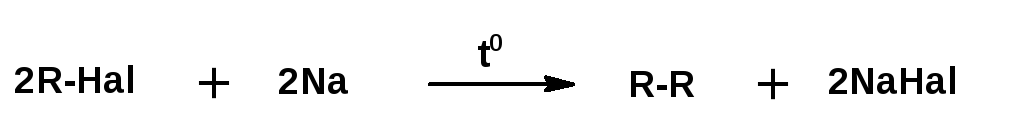
2.Дегалогенирование моногалогенпроизводных алканов.
В присутствии металлического натрия нагревание моногалогензамещенных алканов приводит к образованию алканов с удвоенным числом атомов углерода (реакция Вюрца):
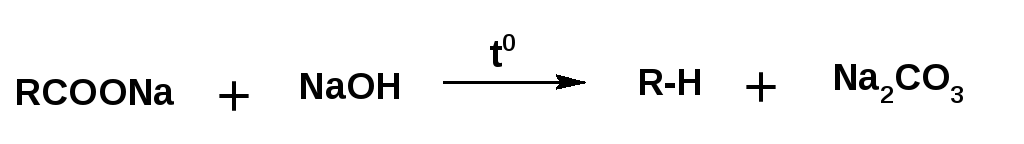
3.Сплавление безводных солей карбоновых кислот с щелочами. При получаются алканы, содержащие на один атом углерода меньше по сравнению с углеродной цепью исходных карбоновых кислот (реакция Дюма):
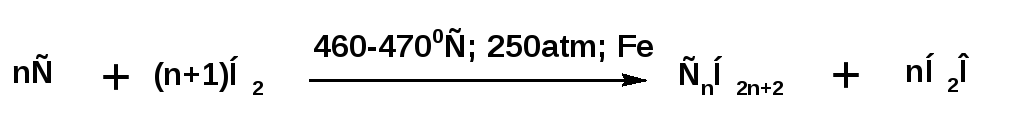
4.Получение смеси алканов из синтез-газа (СО + Н2):
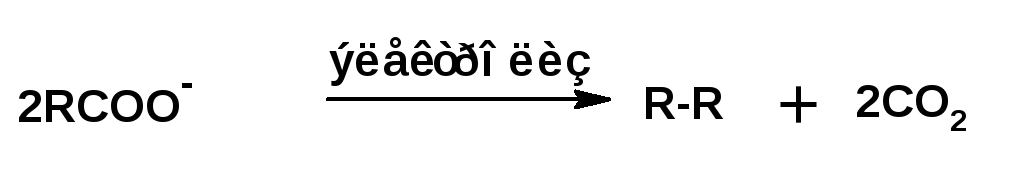
5.Электролиз раствора солей карбоновых кислот (синтез Кольбе).
При электролизе солей карбоновых кислот на аноде выделятся соответствующий алкан и углекислый газ, на катоде — водород и щелочь
Получение метана
1. Действие на раскаленную медь смеси сероводорода и сероуглерода:
2. Нагревание до 1200 градусов смеси водорода и углерода (а в присутствии никелевого катализатора до 475 градусов):
Та же самая реакция протекает в горящей в атмосфере водорода электрической дуге.
3. Взаимодействие карбида алюминия с водой:
4. Нагревание смеси щелочи и ацетата натрия:
5. Взаимодействие водорода и оксида углерода (II):
Химические свойства алканов
Алканы ввиду насыщенности связей при нормальных условиях являются инертными веществами (их еще называют «химические мертвецы»). Они не способны вступать в реакции восстановления, при комнатной температуре не окисляются даже под действием таких сильных окислителей как К2Cr2O7, KMnO4 и т.п. Однако в определенных условиях они могут вступать в реакции окисления (горения), дегидрирования, дегидроциклизации, изомеризации, разложения (крекинг), замещения.
1.Реакция дегидрирования (протекает при повышенной температуре в присутствии катализаторов Pt, Pd, Ni, Fe, Cr2O3, Fe2O3, ZnO):
2СН4 → CH≡CH+ H2 (катализатор — С, 1500°С)
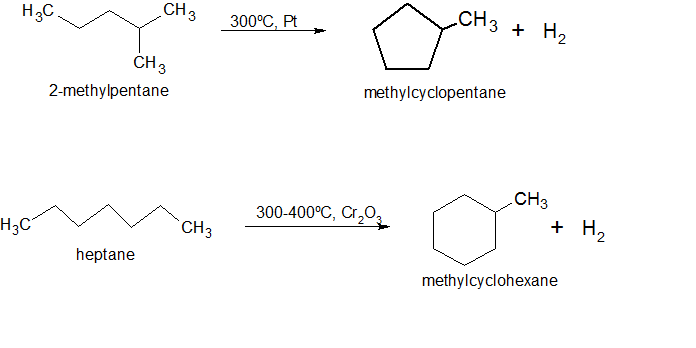
2.Реакция дегидроциклизации (протекает при повышенной температуре в присутствии катализаторов):
3.Реакция изомеризации (протекает при повышенной температуре в присутствии катализатора):
4.Крекинг (нагрев до высоких температур без доступа воздуха):
Неполное окисление алканов используют для получения карбоновых кислот, кетонов, альдегидов, спиртов:
Действие кислорода воздуха в присутствии солей марганца на алканы с числом атомов углерода в цепи более 25 приводит к образованию смеси карбоновых кислот, среднее число атомов углерода в цепи которых составляет 12-18.
Полное окисление алканов (горение) –это экзотермическая реакция, которая сопровождается разрывом всех С-С и С-Н связей:
Низшие алканы (метан, этан, пропан, бутан) – легко воспламеняются, увеличение углеродной цепи алканов ведет к затруднению их горения, что объясняется недостатком кислорода воздуха, необходимого для полного окисления всего углерода. При этом происходит горение с образованием копоти, угарного газа.
6.Реакция образования «синтез-газа»:
СН4 + H2O → CO + 3H2 (катализатор — Ni, 800°С)
7. Реакция замещения (SR)
Замещение атома водорода происходит по радикальному механизму. Вначале преимущественно замещается третичный атом углерода, затем вторичный и первичный.
- Реакция галогенирования алканов возможна только при действии света или высокой температуры. При этом образуются галогеналканы:
Реакция продолжается до тех пор, пока не израсходуется один из реагентов. При большом количестве галогена в результате реакции образуется смесь продуктов замещения 2-х, 3-х и т.д. атомов водорода
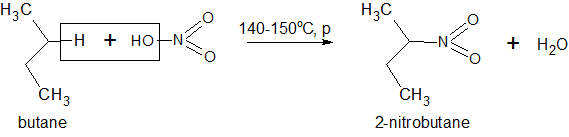
- Реакция нитрования алканов (реакция Коновалова) протекает при действии разбавленной азотной кислоты:
Применение алканов
Рубрики
- ОБЩАЯ ХИМИЯ
- Основные понятия и законы химии
- Строение атомов элементов
- Периодический закон Д.И.Менделеева
- Химическая связь и строение молекул
- Основы термодинамики
- Химическая кинетика и равновесие химической реакции
- Растворы
- Окислительно-восстановительные реакции
- Электролиз
- Коррозия металлов
- Комплексные соединения
- Дисперсные системы. Коллоидные растворы
- I группа (щелочные металлы)
- II группа (щелочноземельные металлы)
- III группа (алюминий)
- IV группа (углерод, кремний)
- V группа (азот, фосфор)
- VI группа (кислород, сера)
- VII группа (галогены)
- Краткая история органической химии
- Теория строения А.М. Бутлерова
- Классификация органических соединений
- Изомерия и номенклатура органических соединений
- Типы химических реакций
- Алканы
- Алкены, алкадиены
- Алкины
- Спирты
- Простые эфиры
- Альдегиды, кетоны
- Карбоновые кислоты и сложные эфиры
Источник
3. Способы получения.
Все способы получения делятся на промышленные и лабораторные.
Природные источники и промышленные способы получения алканов.
1. Предельные углеводороды снебольшим числом углеродных атомов (до 11) выделяют из природного газа или бензиновой фракции нефти. Основным способом переработки нефтяных фракций являются различные виды крекинга. Крекинг – это термическое разложение углеводородов и других составных частей нефти.
2. По методу Фишера-Тропшаалканы можно получать каталитичеким гидрированием окиси и двуокиси углерода:
3. Каталитическая гидрогенизация угля. Получила название «ожижение» угля. Твердый каменный уголь в ходе этого процесса превращают в смесь алканов. Эта реакция лежит в основе производства синтетического бензина:
Лабораторные способы получения алканов.
1. Предельные углеводороды, начиная с пентана, наиболее часто получают в лабораторных условиях каталитическим гидрированием непредельных углеводородовс тем же числом углеродных атомов и таким же строением цепи:
В качестве катализатора используют мелкодисперстные Рt,Pd,Ni. Процесс проводят при обычных температуре и давлении.
2. Предельные углеводороды в лабораторных условиях получают восстановлением галогенпроизводных действием цинка в водном растворе минеральной кислотыили уксусной кислоты:
При использовании в качестве субстрата йодистых алкилов можно получить алкан восстановлением йодистоводородной кислоты:
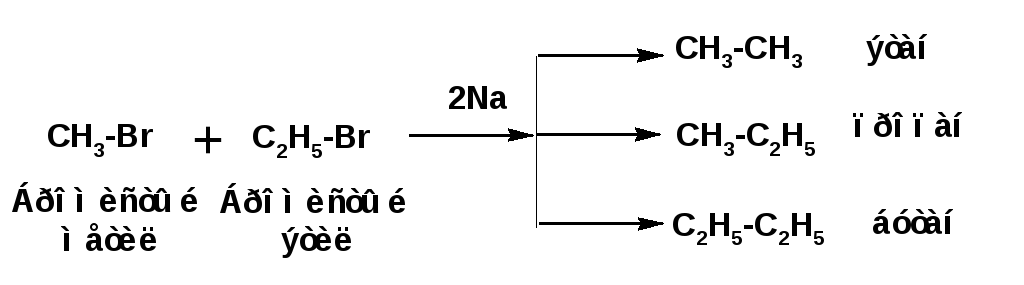
3. Синтез предельных углеводородов из соединений с меньшим числом углеродных атомов осуществляется действием натрия на галогенпроизводные – реакция Вюрца:
Особенностью синтеза Вюрца является то, что в случае использования в качестве исходных веществ различных галогеналкилов в результате реакции получается смесь трех углеводородов:
4. Общим способом получения углеводородов является декарбоксилирование карбоновых кислот:
Насыщенные углеводороды в ряде случаев удобнее получать нагреванием натриевой соли карбоновой кислоты с избытком едкого натра:
При нагревании натриевой соли карбоновой кислоты с едким натром получается углеводород с числом атомов углерода равным числу атомов углерода в радикале кислоты. Углеводород с удвоенным количеством атомов углерода получается при электролизе натриевой соли карбоновой кислоты:
4. Физические свойства и строение.
4.1. Физические свойства
Физические свойства алканов, как и всех других органических соединений определяются их составом и строением. Низшие алканы С1-С4при нормальных находятся в газообразном состоянии. Линейные алканы С5-С15являются жидкостями. Температуры кипения в гомологическом ряду возрастают, причем разность температур кипения ближайших гомологов все время уменьшается. (Относительное уменьшение изменения кинетической энергии). Изомеры с нормальной цепью углеродных атомов кипят при более высокой температуре, чем углеводороды с разветвленной цепью. Причина в меньшем взаимодействии между молекулами с разветвленной цепью. Ответвления от главной цепи создают пространственные препятствия для сближения молекул. Температуры плавления в гомологическом ряду предельных углеводородов медленно возрастают. При этом предельные углеводороды образуют два ряда. Один для гомологов с четным числом углеродных атомов в цепи. Другой – для гомологов с нечетным числом углеродных атомов. Температуры плавления у четных гомологов обычно выше, чем у нечетных. Объяснение данному факту дано из рассмотрения пространственного расположения. Молекулы с четным числом атомов углерода построены симметрично и плотнее упакованы в кристаллической решетке. Поэтому на разрушение более плотной упаковки необходимо затратить больше энергии, что выражается в больших температурах плавления.
Плотность предельных углеводородов вначале быстро, а затем все медленнее возрастает до 0.78.
Предельные углеводороды – вещества неполярные (аполярные) и трудно поляризуемые. Растворимость в воде очень малая.
Источник