31. Получение ароматических углеводородов. Природные источники
Сухая перегонка каменного угля. Ароматические углеводороды получаются главным образом при сухой перегонке каменного угля. При нагревании каменного угля в ретортах или коксовальных печах без доступа воздуха при 1000–1300 °C происходит разложение органических веществ каменного угля с образованием твердых, жидких и газообразных продуктов. Твердый продукт сухой перегонки – кокс – представляет собой пористую массу, состоящую из углерода с примесью золы. Кокс вырабатывается в огромных количествах и потребляется главным образом металлургической промышленностью в качестве восстановителя при получении металлов (в первую очередь железа) из руд. Жидкие продукты сухой перегонки – это черная вязкая смола (каменноугольный деготь), и водный слой, содержащий аммиак, – аммиачная вода. Каменноугольного дегтя получается в среднем 3 % от массы исходного каменного угля. Аммиачная вода – один из важных источников получения аммиака. Газообразные продукты сухой перегонки каменного угля носят название коксового газа. Коксовый газ имеет различный состав в зависимости от сорта угля, режима коксования и т. д. Коксовый газ, получаемый в коксовальных батареях, пропускают через ряд поглотителей, улавливающих смолы, аммиак и пары легкого масла. Легкое масло, получаемое путем конденсации из коксового газа, содержит 60 % бензола, толуол и другие углеводороды. Большая часть бензола (до 90 %) получается именно этим способом и лишь немного – путем фракционирования каменноугольного дегтя. Переработка каменноугольного дегтя. Каменноугольный деготь имеет вид черной смолистой массы с характерным запахом. В настоящее время из каменноугольного дегтя выделено свыше 120 различных продуктов. Среди них ароматические углеводороды, а также ароматические кислородсодержащие вещества кислого характера (фенолы), азотосодержащие вещества основного характера (пиридин, хинолин), вещества, содержащие серу (тиофен), и др. Каменноугольный деготь подвергают фракционной перегонке, в результате которой получают несколько фракций. Легкое масло содержит бензол, толуол, ксилолы и некоторые другие углеводороды. Среднее, или карболовое, масло содержит ряд фенолов. Тяжелое, или креозотовое, масло: из углеводородов в тяжелом масле содержится нафталин. Получение углеводородов из нефти Нефть – один из главных источников ароматических углеводородов. Большинство видов нефти содержит лишь очень небольшое количество углеводородов ароматического ряда. Из отечественной нефти богата ароматическими углеводородами нефть Уральского (Пермского) месторождения. Нефть «Второго Баку» содержит до 60 % ароматических углеводородов. В связи с дефицитностью ароматических углеводородов теперь пользуются «ароматизацией нефти»: нефтяные продукты нагревают при температуре около 700 °C, в результате чего из продуктов разложения нефти удается получить 15–18 % ароматических углеводородов.
32. Синтез, физические и химические свойства ароматических углеводородов
1. Синтез из ароматических углеводородов и гало-генопроизводных жирного ряда в присутствии катализаторов (синтез Фриделя—Крафтса). 2. Синтез из солей ароматических кислот. При нагревании сухих солей ароматических кислот с натронной известью происходит разложение солей с образованием углеводородов. Этот способ аналогичен получению углеводородов жирного ряда. 3. Синтез из ацетилена. Эта реакция представляет интерес как пример синтеза бензола из углеводородов жирного ряда. При пропускании ацетилена через нагретый катализатор (при 500 °C) происходит разрыв тройных связей ацетилена и полимеризация трех его молекул в одну молекулу бензола. Физические свойства Ароматические углеводороды представляют собой жидкости или твердые тела с характерным запахом. Углеводороды, имеющие в молекулах не более одного бензольного кольца, легче воды. В воде ароматические углеводороды растворимы мало. Для ИК-спектров ароматических углеводородов характерны в первую очередь три области: 1) около 3000 см -1 , обусловленная валентными колебаниями С—Н; 2) область 1600–1500 см -1 , связанная со скелетными колебаниями ароматических углерод-углеродных связей и значительно варьирующая по положению пиков в зависимости от строения; 3) область ниже 900 см -1 , относящаяся к деформационным колебаниям С—Н ароматического кольца. Химические свойства Важнейшими общими химическими свойствами ароматических углеводородов являются их склонность к реакциям замещения и большая прочность бензольного ядра. Гомологи бензола имеют в своей молекуле бензольное ядро и боковую цепь, например в углеводороде С 6 Н 5 -С 2 Н 5 группа С 6 Н 5 – бензольное ядро, а С 2 Н 5 – боковая цепь. Свойства бензольного ядра в молекулах гомологов бензола приближаются к свойствам самого бензола. Свойства боковых цепей, являющихся остатками углеводородов жирного ряда, приближаются к свойствам жирных углеводородов. Можно разделить реакции бензольных углеводородов на четыре группы.
33. Правила ориентации в бензольном ядре
При изучении реакций замещения в бензольном ядре было обнаружено, что если в бензольном ядре уже содержится какая-либо замещающая группа, то вторая группа вступает в определенное положение в зависимости от характера первого заместителя. Таким образом, каждый заместитель в бензольном ядре обладает определенным направляющим, или ориентирующим, действием. На положение вновь вводимого заместителя также оказывает влияние природа самого заместителя, т. е. электрофильная или нуклеофильная природа действующего реагента. Подавляющее большинство наиболее важных реакций замещения в бензольном кольце – это реакции электрофильного замещения (замена атома водорода, отщепляющегося в виде протона, положительно заряженной частицей) – реакции галогенирования, сульфирования, нитрования и др. Все заместители по характеру своего направляющего действия делятся на две группы. 1. Заместители первого рода в реакциях электро-фильного замещения направляют последующие вводимые группы в орто– и параположение. К заместителям этого рода относятся, например, следующие группы, расположенные в порядке убывания своей направляющей силы: —NH 2 , —OH, – CH3. 2. Заместители второго рода в реакциях электро-фильного замещения направляют последующие вводимые группы в метаположение. К заместителям этого рода относятся следующие группы, расположенные в порядке убывания своей направляющей силы: —NO 2 , —C≡N, – SO 3 H. Заместители первого рода содержат одинарные связи; для заместителей второго рода характерно наличие двойных или тройных связей. Заместители первого рода в подавляющем большинстве случаев облегчают реакции замещения. Например, для нитрования бензола нужно нагревать его со смесью концентрированных азотной и серной кислот, тогда как фенол С 6 Н 5 ОН можно успешно нитровать разбавленной азотной кислотой при комнатной температуре с образованием орто– и паранитрофенола. Заместители второго рода обычно вообще затрудняют реакции замещения. Особенно затруднено замещение в орто– и параположении и относительно легче происходит замещение в мета-положении. В настоящее время влияние заместителей объясняют тем, что заместители первого рода являются электронодонорными (отдающими электроны), т. е. их электронные облака смещаются в сторону бензольного ядра, что повышает реакционную способность атомов водорода. Повышение реакционной способности атомов водорода в кольце облегчает течение электрофильных реакций замещения. Так, например, при наличии ги-дроксила свободные электроны кислородного атома сдвигаются в сторону кольца, что повышает электронную плотность в кольце, причем особенно повышается электронная плотность у атомов углерода в орто-и параположениях к заместителю.
34. Правила замещения в бензольном ядре
Правила замещения в бензольном ядре имеют огромное практическое значение, так как дают возможность предсказать ход реакции и выбрать правильный путь синтеза того или другого нужного вещества. Механизм реакций электрофильного замещения в ароматическом ряду. Современные методы исследования дали возможность в значительной степени выяснить механизм замещения в ароматическом ряду. Интересно, что во многих чертах, особенно на первых стадиях, механизм электрофильного замещения в ароматическом ряду оказался сходным с механизмом электрофильного присоединения в жирном ряду. Первой стадией электрофильного замещения является (как при электрофильном присоединении) образование p-комплекса. Электрофильная частица Xd+ связывается со всеми шестью p-электронами бензольного кольца. Второй стадией становится образование р-комп-лекса. При этом электрофильная частица «вытягивает» из шести р-электронов два электрона для образования обычной ковалентной связи. Образовавшийся р-комплекс уже не обладает ароматической структурой: это нестабильный карбокатион, в котором четыре р-электрона в делокализованном состоянии распределены между пятью углеродными атомами, тогда как шестой углеродный атом переходит в насыщенное состояние. Вступивший заместитель X и атом водорода находятся в плоскости, перпендикулярной плоскости шестичленного кольца. S-комплекс – это промежуточный продукт, образование и структура которого были доказаны рядом методов, в частности спектроскопией. Третья стадия электрофильного замещения заключается в стабилизации S-комплекса, которая достигается путем отщепления атома водорода в виде протона. Два электрона, участвовавшие в образовании связи С-Н, после отделения протона вместе с четырьмя делокализованными электронами пяти углеродных атомов дают обычную стабильную ароматическую структуру замещенного бензола. Роль катализатора (обычно А 1 Сl 3 ) при этом процессе заключается в усилении поляризации галогеналкила с образованием положительно заряженной частицы, которая и вступает в реакцию электрофильного замещения. Реакции присоединения Бензольные углеводороды с большим трудом вступают в реакцию присоединения – не обесцвечивают бромной воды и раствора КМnO 4 . Однако в особых условиях реакции присоединения все же возможны. 1. Присоединение галогенов. Кислород при этой реакции играет роль отрицательного катализатора: в его присутствии реакция не идет. Присоединение водорода в присутствии катализатора: C 6 H 6 + 3H 2 → C 6 H 12 2. Окисление ароматических углеводородов. Сам бензол исключительно стоек к окислению – более стоек, чем парафины. При действии энергичных окислителей (КМпО4 в кислой среде и др.) на гомологи бензола ядро бензола не окисляется, тогда как боковые цепи подвергаются окислению с образованием ароматических кислот.
Источник
Природные способы получения бензола
Основным природным источником ароматических углеводородов является нефть и каменный уголь.
В промышленности
1.При коксовании (сухая перегонка) каменного угля образуется каменноугольная смола, из которой выделяют бензол, толуол, ксилолы, нафталин и многие другие органические соединения.
2.Ароматизация нефти
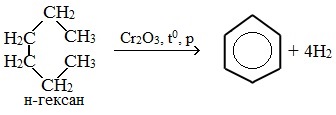
а) дегидроциклизация (дегидрирование и циклизация) алканов в присутствии катализатора (с числом атомов углерода больше 6):
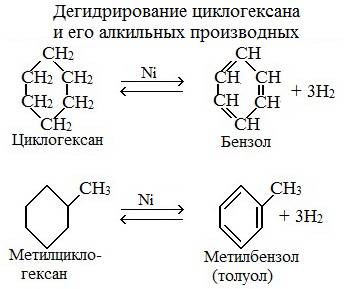
б) дегидрирование циклоалканов и его гомологов:
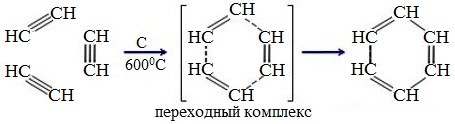
3.Тримеризация ацетилена
При пропускании ацетилена над активированным углем образуется бензол (реакция Зелинского):
В лаборатории
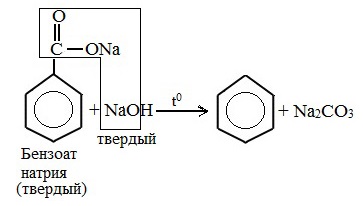
1.Декарбоксилирование солей бензойной кислоты (сплавление солей бензойной кислоты с твердой щелочью)
Соли бензойной кислоты называются бензоаты.
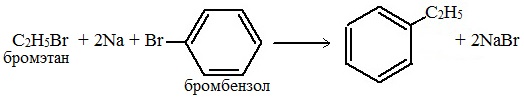
2.Гомологи бензола получают из галогенпроизводных (реакция Вюрца- Фиттига)
Реакции получения аренов указывают на взаимосвязь между различными группами углеводородов и на взаимное превращение их друг в друга.
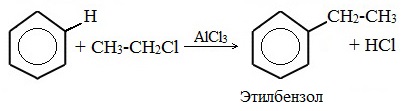
3.Алкилирование бензола (получение гомологов бензола)
Гомологи бензола получают его взаимодействием с галогеналканами или алкенами в присутствии безводного хлорида алюминия (реакция Фриделя-Крафтса):
При дегидрировании этилбензола образуется производное бензола с непредельной боковой цепью – винилбензол (стирол) C6H5-CН=СН2 (исходное вещество для получения ценного полимера полистирола).


Источник