Глава 1. ХИМИЯ БЕЛКОВ
Живой организм характеризуется высшей степенью упорядоченности составляющих его ингредиентов и уникальной структурной организацией, обеспечивающей как его фенотипические признаки, так и многообразие биологических функций. В этом структурно-функциональном единстве организмов, составляющем сущность жизни, белки (белковые тела) играют важнейшую роль, не заменяемую другими органическими соединениями.
Белки – это высокомолекулярные азотсодержащие органические вещества, молекулы которых построены из остатков аминокислот. Название «протеины» (от греч. protos – первый, важнейший), по-видимому, более точно отражает первостепенное биологическое значение этого класса веществ. Принятые в отечественной литературе термины «белки» и «белковые вещества» связаны с обнаружением в тканях животных и растений веществ, имеющих сходство с белком куриного яйца. В наше время, когда абсолютно достоверно установлено, что наследственная информация сосредоточена в молекуле ДНК клеток любых живых организмов, не вызывает сомнения, что только белки являются теми молекулярными инструментами, при помощи которых реализуется генетическая информация. Без белков, в частности ферментов, ДНК не может реплицироваться, не может самовоспроизводиться, т.е. лишена способности передавать генетическую информацию.
Живая природа характеризуется рядом свойств, отличающих ее от неживой природы, и почти все эти свойства связаны с белками. Прежде всего для живых организмов характерны широкое разнообразие белковых структур и их высокая упорядоченность; последняя существует во времени и пространстве. Удивительная способность живых организмов к воспроизведению себе подобных также связана с белками. Сократимость, движение – непременные атрибуты живых систем – имеют прямое отношение к белковым структурам мышечного аппарата. Наконец, жизнь немыслима без обмена веществ, постоянного обновления составных частей живого организма, т.е. без процессов анаболизма и катаболизма (этого удивительного единства противоположностей живого), в основе которых лежит деятельность каталитически активных белков – ферментов.
Таким образом, белки (белковые вещества) составляют основу и структуры, и функции живых организмов. По образному выражению одного из основоположников молекулярной биологии Ф. Крика, белки важны прежде всего потому, что они могут выполнять самые разнообразные функции, причем с необыкновенной легкостью и изяществом. Подсчитано, что в природе примерно 10 10 –10 12 различных белков, обеспечивающих существование около 10 6 видов живых организмов различной сложности организации начиная от вирусов и кончая человеком. Из этого огромного количества природных белков известны точное строение и структура ничтожно малой части (см. далее). Каждый организм характеризуется уникальным набором белков. Фенотипические признаки и многообразие функций обусловлены специфичностью объединения этих белков, во многих случаях в виде над- и мультимолекулярных структур, в свою очередь определяющих ультраструктуру клеток и их органелл.
В клетке Е.coli содержится около 3000 различных белков, а в организме человека насчитывается более 100000 разнообразных белков. Самое удивительное, что все природные белки состоят из небольшого числа сравнительно простых структурных блоков, представленных мономерными молекулами – аминокислотами, связанными друг с другом в полипептидные цепи. Природные белки построены из 20 различных аминокислот. Эти аминокислоты могут объединяться в самой разной последовательности, поэтому они могут образовывать громадное количество разнообразных белков. Число изомеров, которое можно получить при всевозможных перестановках указанного числа аминокислот в полипептиде, исчисляется огромными величинами. Так, если из 2 аминокислот возможно образование только двух изомеров, то уже из 4 аминокислот теоретически возможно образование 24 изомеров, а из 20 аминокислот – 2,4•10 18 разнообразных белков.
Нетрудно предвидеть, что при увеличении числа повторяющихся аминокислотных остатков в белковой молекуле число возможных изомеров возрастает до астрономических величин. Ясно, что природа не может позволить случайных сочетаний аминокислотных последовательностей и для каждого вида характерен свой специфический набор белков, определяемый, как теперь известно, наследственной информацией, закодированной в молекуле ДНК живых организмов. Именно информация, содержащаяся в линейной последовательности нуклеотидов ДНК, определяет линейную последовательность остатков аминокислот в полипептидной цепи синтезируемого белка. Образовавшаяся линейная полипептидная цепь сама теперь оказывается наделенной функциональной информацией, в соответствии с которой она самопроизвольно преобразуется в определенную стабильную трехмерную структуру. Таким образом, лабильная полипептидная цепь складывается, скручивается в пространственную структуру белковой молекулы, причем не хаотично, а в строгом соответствии с информацией, содержащейся в последовательности аминокислотных остатков. Учитывая ведущую роль белков в живой природе и тот факт, что белки, составляя почти половину сухой массы живого организма, наделены удивительным разнообразием функций, изучение курса биохимии в медицинских высших учебных заведениях обычно начинают с этого класса органических веществ.
Источник
Органические вещества клетки
Химический состав белков. Из органических веществ клетки на первом месте по количеству и значению стоят белки. В состав всех белков входят атомы водорода, кислорода, азота. Во многие белки входят, кроме того, атомы серы. Есть белки, в состав которых входят также атомы металлов – железа, цинка, меди.
В отличие от других органических соединений белки обладают рядом особенностей. Прежде всего белкам присуща громадная молекулярная масса. Сравните: молекулярная масса спирта – 46, уксусной кислоты – 60, бензола – 78. а альбумина (одного из белков яйца) – 36 000, гемоглобина (белка из красных кровяных клеток) – 152 000, миозина (одного из белков мышц) 500000. Ясно, что по сравнению с молекулами спирта, уксусной кислоты, бензола и другими молекулы белков великаны. В их построении участвуют тысячи атомов. Для того чтобы подчеркнуть гигантский размер таких молекул, их называют макромолекулами (греч. «макрос» – большой, гигантский).
Строение белков. Среди органических соединений белки самые сложные. Они относятся к соединениям, называемым полимерами. Молекула полимера представляет длинную цепь, в которой много раз повторяется одна и та же сравнительно простая структура, называемая мономером. Если обозначить мономер буквой А, то структуру полимера можно изобразить так: А–А–А–А–А.
Кроме белков в природе существует много других полимеров, например целлюлоза, крахмал, каучук. В химической промышленности создано много искусственных полимеров – полиэтилен, лавсан, капрон и др.
Большинство природных и искусственных полимеров построены из одинаковых мономеров. Белки же состоят из сходных, но не вполне одинаковых мономеров. Мономерами белков являются аминокислоты. Как видно на рисунке 70, молекула аминокислоты как бы состоит из двух частей. Одна часть (черными буквами) у всех аминокислот одинаковая. Это группировка 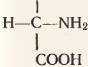
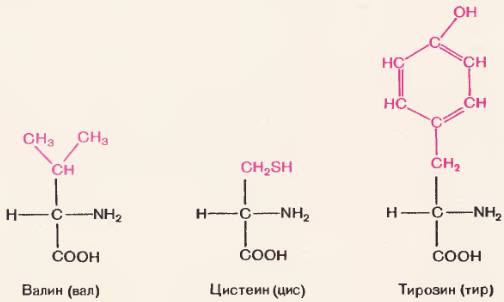
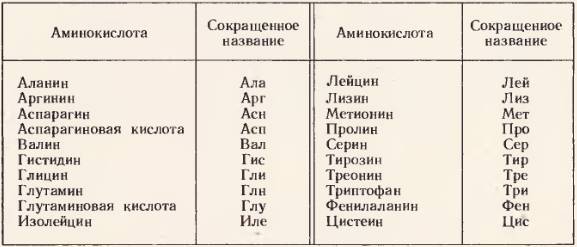
Известно много разных аминокислот. Но в качестве мономеров любых природных белков – животных, растительных„микробных, вирусных – известно только 20 аминокислот. Они получили название «волшебных». Их список представлен в таблице.
Тот факт, что белки всех организмов построены из одних и тех же аминокислот – еще одно доказательство единства живого мира на Земле.
Двадцать аминокислот, входящих в состав природных белков («волшебные» аминокислоты)
Соединение аминокислот при образовании белковой молекулы осуществляется через общую для всех аминокислот группировку. Чтобы лучше это понять, рассмотрите рисунок 71: из карбоксильной группы одной аминокислоты и аминогруппы соседней аминокислоты отщепляется молекула воды и за счет освободившихся валентностей остатки аминокислот соединяются. Между аминокислотами возникает прочная ковалентная связь 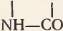
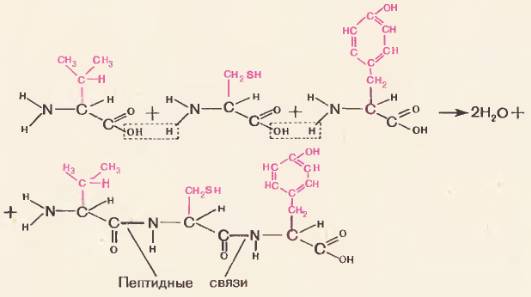
Каждый живой организм содержит большое число различных белков. При этом каждому виду присущи особенные, свойственные только данному виду белки. Даже белки, выполняющие у разных видов животных одну и ту же функцию, отличаются друг от друга. Например, у всех позвоночных животных– рыб, амфибий, птиц, млекопитающих – красные клетки крови содержат белок гемоглобин, выполняющий у всех животных одну и ту же функцию транспорт кислорода. Но гемоглобин у каждого вида животных свой, особенный, по структуре и свойствам отличающийся от гемоглобинов других животных.
Для того чтобы объяснить возможность существования такого громадного разнообразия белков, нужно учесть, что белки различаются по составу аминокислот, по числу аминокислотных звеньев, по порядку следования в цепи. Число структурных вариантов достигает при этом астрономических цифр.
В докладе индийского ученого Синга на биохимическом конгрессе в Москве был приведен следующий любопытный расчет. Белок с молекулярной массой 34 000 содержит около 300 аминокислотных звеньев (молекулярная масса одного аминокислотного звена в среднем равна 110). Пусть в состав этого белка входят не все 20 аминокислот, а только 12. При таких условиях число возможных изомеров для этого белка оказывается равным 10 300 . Для того чтобы ощутить громадность этой цифры, представим себе 10 300 однокопеечных монет. Такая груда монет весит 10 300 г (одна однокопеечная монета весит 1 г). Масса же земного шара 1027 г!
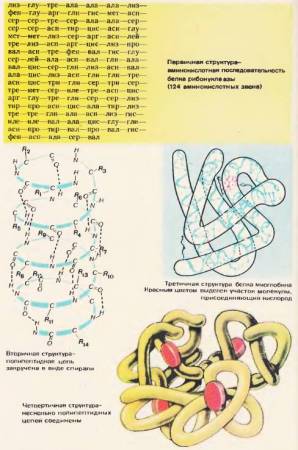
Если учесть, что размер одного аминокислотного звена равен 0,35 – 0,37 им, то очевидно, что макромолекула белка, которая состоит из сотен аминокислотных остатков, должна была бы иметь в длину несколько десятков нанометров. В действительности же размеры молекул белков гораздо меньше. Некоторые из них имеют вид шариков с диаметром всего 5 – 7 нм. Полипептидная цепь белка как-то скручена, как-то уложена. Каждому белку присущ строго определенный характер укладки. Для полной характеристики строения белковой молекулы требуется знание его первичной, вторичной и третичной структур.
Последовательность аминокислотных остатков в молекуле белка определяет его первичную структуру. Это как бы формула белка. На рисунке 72 представлена первичная структура белка рибонуклеазы. В состав этого белка входят 124 аминокислотных звена. Чаще всего полипептидная цепь полностью или частично закручивается в спираль. Это вторичная структура белка. Аминокислотные радикалы остаются при этом снаружи спирали. Витки спирали располагаются тесно. Между NH-группами, находящимися на одном витке, и CO-группами, находящимися на соседнем витке, образуются водородные связи [72]. Водородные связи значительно слабее ковалентных, но, повторенные многократно, они дают прочное сцепление. Полипептидная спираль, «прошитая» многочисленными водородными связями, представляет достаточно прочную структуру.
Рис. 72. Уровни структурной организации белка
Полипептидная спираль подвергается дальнейшей укладке. Она сворачивается причудливо, но для каждого белка вполне определенно и постоянно. В результате возникает конфигурация, называемая третичной структурой [72]. Третичную структуру поддерживают гидрофобные связи, которые возникают между радикалами гидрофобных аминокислот. Эти связи слабее водородных. В водной среде в клетке гидрофобные радикалы отталкиваются от воды и слипаются друг с другом. Таким образом, водная среда как бы принуждает белковую молекулу принять определенную упорядоченную структуру, и она становится биологически активной.
Третичная структура не является высшей формой структурной организации белка. В живой клетке обнаружено много других, еще более сложных ее форм, например четвертичные [72].
1. Каковы особенности строения белка как полимера? 2. Чем отличаются белки как полимеры от таких природных полимеров, как крахмал, целлюлоза, каучук? От искусственных полимеров (полиэтилена, лавсана и др.)? 3. Что представляет собой первичная структура белка? 4. Что представляет собой вторичная, третичная структуры белка?
Источник