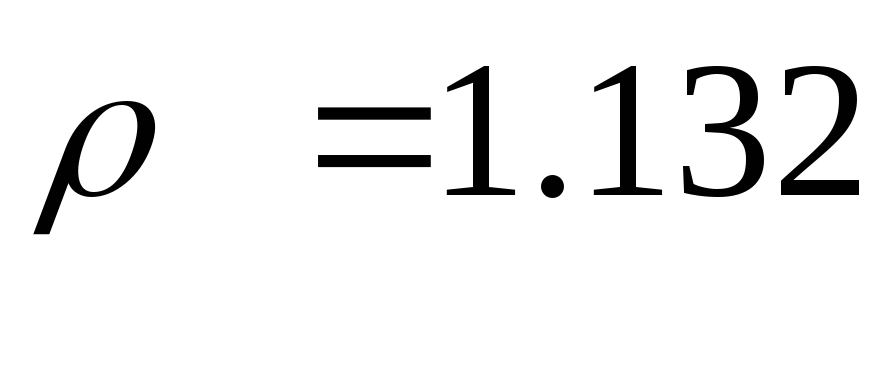Постановка задачи
Компрессорная станция закачивает природный газ в подземное хранилище газа (ПХГ). Объёмная производительность компрессоров равна VП. За время работы компрессорной станции избыточное давление в ПХГ повышается от начального Р1изб до конечного Р2изб, а температура изменяется от t1 до t2. Объём подземного хранилища равен V. Давление окружающего воздуха Ро.с.=0.1МПа.
Исходные данные:
| Природный газ (месторождение) | Р1изб, МПа | t1, 0 С | Р2изб, МПа | t2, 0 С | VП∙10 5 , нм 3 /ч | V∙10 6 , м 3 |
| Уренгойское (газоконденсатное) | 3,3 | 8,5 | 0,9 |
Состав природного газа:
Определить. Массу газа G, закаченного в ПХГ и время закачки .
1. Природный газ подчиняется закону Клапейрона.
Для G кг уравнение состояния идеального газа имеет вид:
Массу газа, закаченного в газохранилище можно определить по соотношению:
Характеристическая газовая постоянная смеси R зависит от кажущейся молекулярной массы смеси:
Молекулярные массы компонентов:
Характеристическая газовая постоянная смеси:
Учитывая, что абсолютные давления равны , абсолютные температуры , получаем:
Рассчитаем плотность газа при и , так как объемная производительность компрессорной станции задана при нормальных условиях:
Время закачки газа определяем как отношение массы газа к массовой производительности компрессорной станции:
2. Природный газ не подчиняется уравнению Клапейрона, то есть газ реальный.
2.1 Расчёт с использованием уравнения состояния , где z – это коэффициент сжимаемости газа. Масса закаченного в газохранилище газа определяется по соотношению: .
а) Проведем расчёт по СТО Газпром :
и — это приведённые значения давления и температуры.
Для смеси газов величины псевдокритического давления и псевдокритической температуры определяем по соотношениям:
, где , — критические давления и температура компонентов газовой смеси.
Определим приведённые значения давлений и температур:
Определяем значения коэффициентов сжимаемости:
Масса закаченного в газохранилище газа:
Плотность природного газа при нормальных условиях: .
Приведённые давления и температура природного газа при нормальных условиях:
б) Проведем расчёт по отраслевым нормам
Определяем значения коэффициентов сжимаемости:
Масса закаченного в газохранилище газа:
Определяем значения коэффициентов сжимаемости:
Масса закаченного в газохранилище газа:
2.2 Расчёт по уравнению Редлиха-Квонга:
Определим значения коэффициентов a и b:
Для определения массы закаченного в газохранилище газа необходимо из уравнения Редлиха-Квонга найти удельный объём, для этого воспользуемся методом простой итерации:
Первоначальное значение можно определить по уравнению Клапейрона и подставить в правую часть соотношения (*). Затем полученное значение вновь подставить в правую часть соотношения (*) и так до достижения требуемой точности.
По уравнению Клапейрона определяем начальное значение:
В результате итерационного расчёта получим последовательность:
С достаточной для расчёта точностью можно принять (м 3 /кг)
В качестве первого значения берем
Источник
Задача 4.
Природный газ Салаватского месторождения состоит из смеси газов:
Исходя из плотности отдельных компонентов газа, определить плотность природного газа Салаватского месторождения:
- при н.у.
- при давлении н.у. и t1 = -39 ºС
- при давлении н.у. и t1 = +30 ºС
Полученное значение плотности при н.у. сравнить со справочными данными для данного месторождения (кг/м 3 ). В какой зоне помещения будет скапливаться газ при утечке?
Решение.
Согласно ф-ле 15 при н.у.: 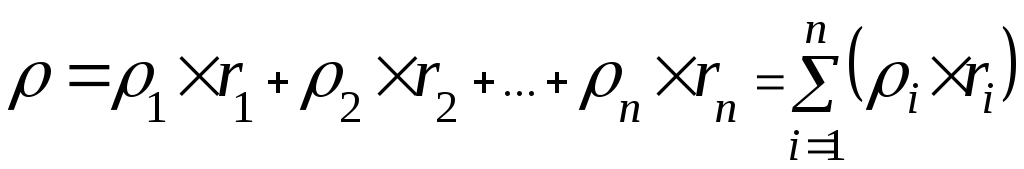
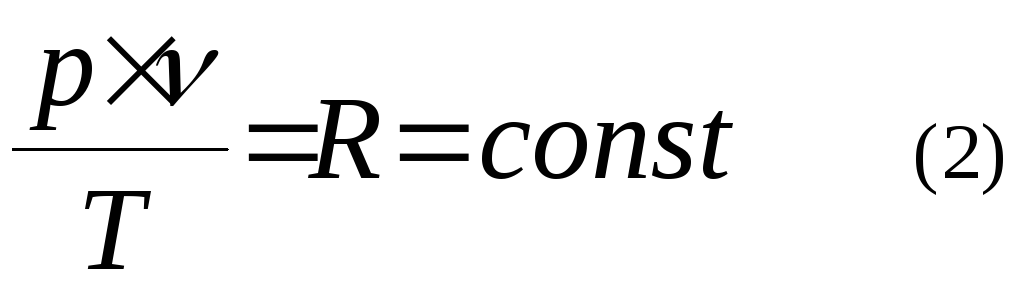
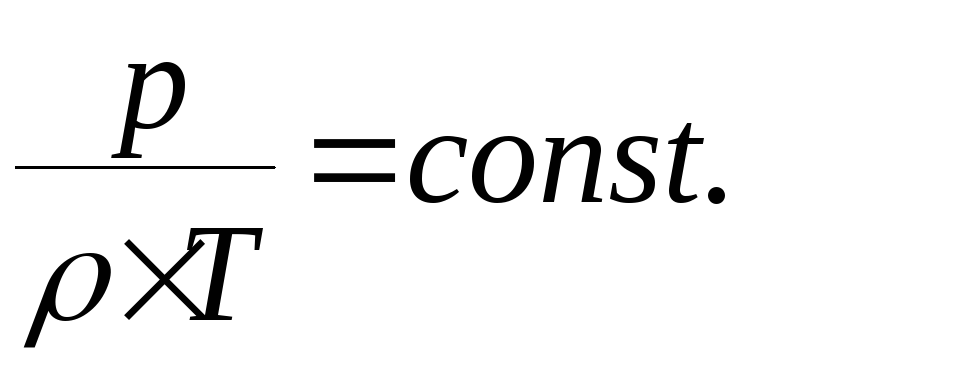
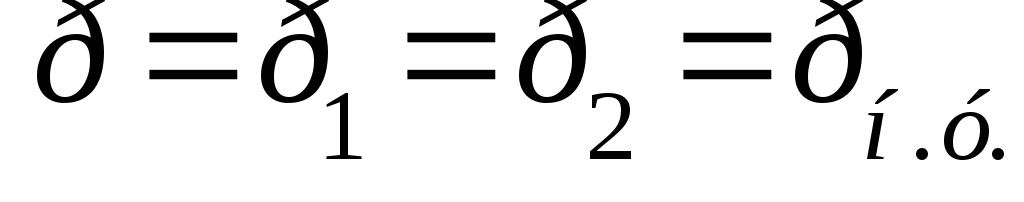

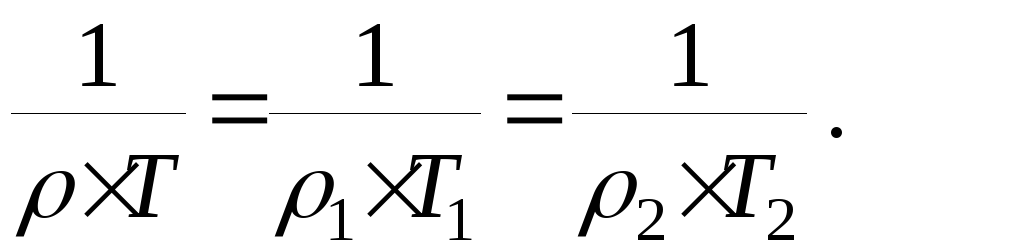
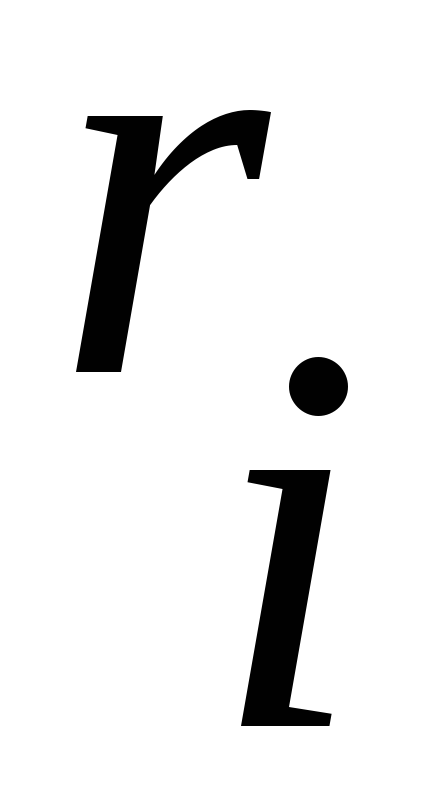 ,в долях ,в долях | 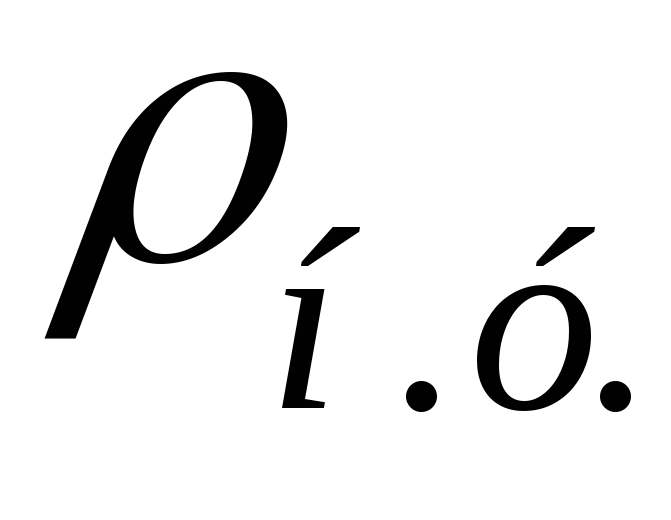 ,кг/м 3 ,кг/м 3 |
| метан СН4 — 0,365 | 0,72 |
| этан С2Н6 — 0,22 | 1,36 |
| пропан С3Н8 — 0,195 | 2,02 |
| бутан С4Н10 — 0,055 | 2,7 |
| пентан С5Н12 — 0,064 | 3,22 |
| углекислый газ СО2 — 0,001 | 1,98 |
| азот N2 — 0,1 | 1,25 |
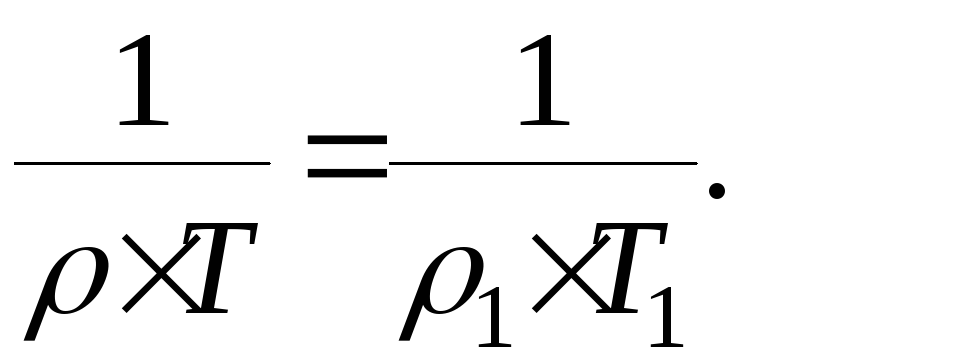
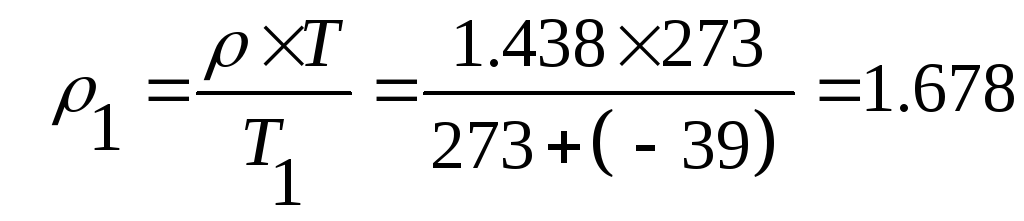
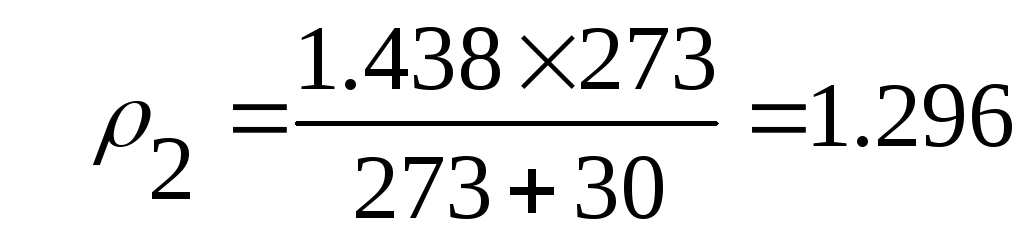
| Условия | Н.у. | Т1 = 234 К | Т2 = 303 К |
| Плотность, кг/м 3 | 1,438 | 1,678 | 1,296 |
При н.у. рассчитанное значение 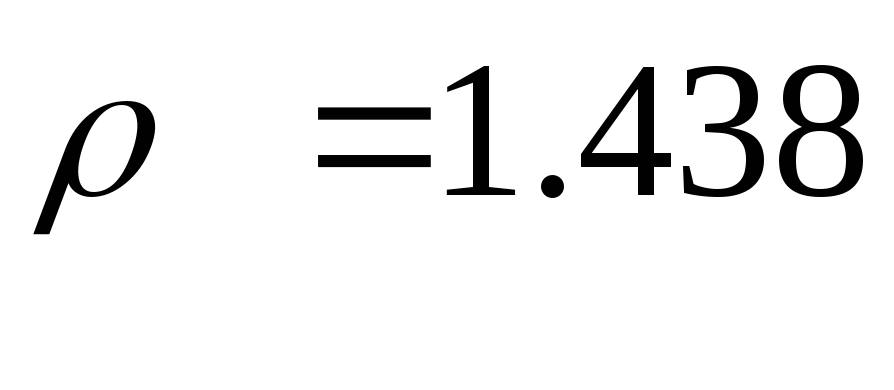
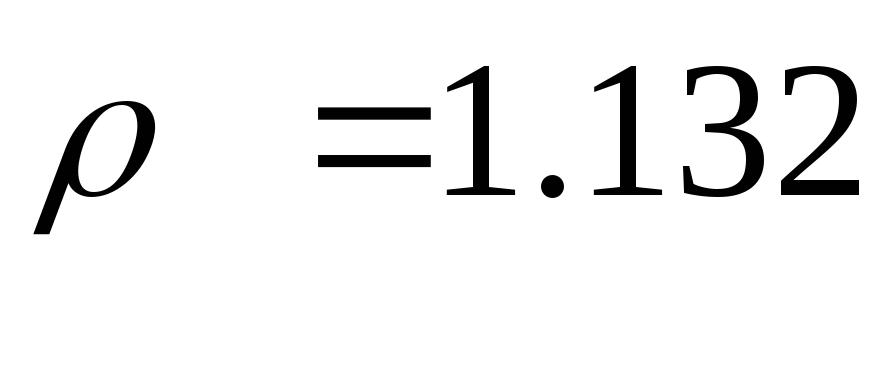
| № вар. | Месторождение газа | Состав газа в % по объему | Плотность при н.у., кг/м 3 | t1, ºС | t2, ºС | |||||||
| СН4 | С2Н6 | С3Н8 | С4Н10 | С5Н12 | СО2 | Н2 | N2 | |||||
| 1 | Степановское | 95,1 | 2,3 | 0,7 | 0,4 | 0,8 | 0,2 | — | 0,5 | 0,772 | -30 | 20 |
| 2 | Ленинградское | 86,9 | 6,0 | 1,6 | 1,0 | 0,5 | 1,2 | — | 2,8 | 0,833 | -31 | 21 |
| 3 | Северо-Ставропольское | 98,7 | 0,33 | 0,12 | 0,04 | 0,01 | 0,1 | — | 0,7 | 0,727 | -32 | 22 |
| 4 | Пунгинское | 86,1 | 2,06 | 0,6 | 0,34 | 0,35 | 8,5 | — | 2,05 | 0,869 | -33 | 23 |
| 5 | Медвежье | 99,0 | 0,1 | 0,005 | — | — | 0,095 | — | 0,8 | 0,723 | -34 | 24 |
| 6 | Оренбургское | 85,0 | 4,9 | 1,6 | 0,75 | 0,55 | 0,6 | 1,3 | 5,0 | 0,84 | -35 | 25 |
| 7 | Вуктыкское | 74,8 | 8,8 | 3,9 | 1,8 | 6,4 | — | — | 4,3 | 1,043 | -36 | 20 |
| 8 | Угерское | 98,3 | 0,45 | 0,25 | 0,3 | — | 0,1 | — | 0,6 | 0,732 | -37 | 21 |
| 9 | Шебелинское | 93,3 | 4,0 | 0,6 | 0,4 | 0,3 | 0,1 | — | 1,3 | 0,772 | -38 | 22 |
| 10 | Газлинское | 93,0 | 3,1 | 0,7 | 0,6 | — | 0,1 | — | 2,5 | 0,771 | -39 | 23 |
| 11 | Карадагское | 93,2 | 2,1 | 1,2 | 1,0 | 1,2 | 0,8 | — | 0,5 | 0,807 | -40 | 24 |
| 12 | Ачакское | 93,0 | 3,6 | 0,95 | 0,25 | 0,31 | 0,4 | — | 1,3 | 0,776 | -30 | 25 |
| 13 | Тенгенское | 89,4 | 6,0 | 2,0 | 0,7 | 0,4 | 1,0 | — | 0,5 | 0,82 | -31 | 20 |
| 14 | Заполярное | 98,5 | 0,2 | 0,05 | 0,012 | 0,001 | 0,5 | — | 0,7 | 0,729 | -32 | 21 |
| 15 | Уренгойское | 97,64 | 0,1 | 0,01 | — | — | 0,3 | — | 1,95 | 0,73 | -33 | 22 |
| 16 | Жирновское | 81,6 | 6,5 | 3,0 | 1,9 | 1,4 | 4,0 | 0,1 | 1,5 | 0,712 | -34 | 23 |
| 17 | Ромашкинское | 40,0 | 19,5 | 18,0 | 7,5 | 4,9 | 0,1 | — | 10,0 | 1,069 | -35 | 24 |
| 18 | Туймазинское | 39,6 | 20,0 | 18,5 | 7,7 | 4,2 | 0,1 | — | 10,0 | 1,065 | -36 | 25 |
| 19 | Шкаповское | 37,5 | 18,2 | 16,8 | 6,8 | 3,8 | 0,1 | — | 16,8 | 1,047 | -37 | 20 |
| 20 | Ключевское | 78,5 | 6,0 | 6,5 | 4,8 | 3,6 | 0,2 | — | 0,4 | 0,789 | -38 | 21 |
| 21 | Дмитриевское | 69,2 | 10,0 | 10,0 | 5,0 | 5,0 | 0,7 | — | 0,1 | 0,91 | -39 | 22 |
| 22 | Небит-Дагское | 91,0 | 3,0 | 2,3 | 1,3 | 1,8 | 0,5 | — | 0,1 | 0,65 | -40 | 23 |
| 23 | Верхнеомринское | 82,7 | 6,0 | 3,0 | 1,0 | 0,2 | 0,1 | — | 7,0 | 0,661 | -30 | 24 |
| 24 | Ямбургское | 98,3 | 0,4 | 0,03 | 0,022 | 0,011 | 0,5 | — | 0,7 | 0,731 | -31 | 25 |
| 25 | Александровское | 86,5 | 1,86 | 0,5 | 0,34 | 0,25 | 8,5 | — | 2,05 | 0,834 | -32 | 20 |
| 26 | Астраханское | 84,0 | 4,9 | 1,6 | 0,7 | 0,6 | 0,6 | 0,6 | 2,5 | 0,85 | -33 | 21 |
| 27 | Западное | 68,4 | 12,0 | 10,6 | 4,8 | 3,2 | 0,4 | — | 0,6 | 0,792 | -34 | 22 |
| 28 | Северное | 5,0 | 9,0 | 2,9 | 2,4 | 6,2 | 0,1 | — | 4,4 | 1,051 | -35 | 23 |
| 29 | Азерское | 89,6 | 5,0 | 2,6 | 0,9 | 0,6 | 1,2 | — | 2,8 | 0,841 | -36 | 24 |
Исходя из плотности отдельных компонентов газа (таблица 4), определить Задача 4 (для решения студентами)плотность природного газа заданного месторождения при н.у.; при давлении н.у. и t1, ºС; при давлении н.у. иt1, ºС. Полученное значение плотности при н.у. сравнить со Таблица 4 справочными данными для заданного месторождения. В какой зоне помещения будет скапливаться газ при утечке? Критические параметры характеризуют критическое состояние газа, при котором плотность жидкой и паровой фазы газа одинакова. Сжатием и охлаждением до определенной температуры газы могут быть переведены в жидкое состояние. Однако для каждого газа существует определенная критическая температура, выше которой газ никаким давлением не может быть сжижен. Давление, необходимое для сжижения газа при критической температуре, называют критическим давлением. Чем температура газа ниже критической, тем при меньшем давлении это газ может быть сжижен. Объем газа, занимаемый при критических давлении и температуре, называют критическим объемом. Критические параметры отдельных компонентов газа определяем по справочной литературе: — Скафтымов, табл. II.1, стр.19; — Стаскевич, табл. 1.2, стр. 8; — Кулаков, табл. 2, стр. 6. Теплотой сгорания газа называют количество тепла, выделяющееся при полном сгорании 1м 3 или 1 кг газа. Различают низшую теплоту сгорания, когда не учитывается скрытая теплота, выделяющаяся при конденсации водяных паров из продуктов сгорания, и высшую, когда эта теплота учитывается. Теплоту сгорания отдельных компонентов газа определяем по справочной литературе: — Скафтымов, стр. 21; — Стаскевич, табл. 1.2, стр. 8; — Кулаков, табл. 2, стр. 6.
Источник
Природный газ содержит метан, азот, оксид углерода
Природный газ содержит метан (объемная доля 95%), азот (2%), оксид углерода (IV) (3%). Образец этого газа объемом 4,48 л (объем приведен к нормальным условиям) сожгли, а всю газовую смесь пропустили через избыток раствора гидроксида кальция. Рассчитайте массу образовавшегося осадка.
Определить: m(CaCO3)
Решение
Вычисляем объем и количество вещества метана в смеси:
2. Составляем уравнение реакции горения метана:
3. Определяем объем и количество вещества CO2, который содержится в природном газе:
4. Общее количество вещества CO2, которое будет содержаться в газовой смеси, составит:
5. При пропускании газовой смеси через избыток раствора гидроксид кальция в осадок выпадает карбонат кальция:
6. Рассчитаем массу образовавшегося осадка:
Ответ: 19,6 г
Оставьте комментарий Отменить ответ
Новые задачи
Словарь
Популярные задачи
Свинец массой 6,9 г растворили в концентрированной азотной кислоте. Из полученного раствора выделили нитрат свинца (II). Определите объем оксида азота (IV), измеренный при нормальных условиях, который образуется при термическом разложении полученного нитрата свинца (II). Ответ: 1,49 […]
Рассчитайте число молекул водорода, который занимает объем 5 л водорода (объем приведен к нормальным условиям). Ответ: 1,34*10^23. […]
Источник
Природный газ решение задач
2023-03-04
Природный газ одного из месторождений содержит метан (объемная доля 92%), этан (3%), пропан (1,6%), бутан (0,4%), азот (2%), оксид углерода (IV), пары воды и другие негорючие газы (1%). Какой объем воздуха потребуется для сжигания газа объемом 5 $м^$ (нормальные условия)? Объемная доля кислорода в воздухе составляет 21 %. Объем воздуха рассчитайте при нормальных условиях.
Природный газ содержит четыре горючих компонента: метан $CH_$, этан $C_H_$, пропан $C_H_$ и бутан $C_H_$. Записываем уравнения реакций горения газов:
$CH_ + 2O_ -\rightarrow CO_ + 2H_O$ (а)
$C_H_ + 3,5O_ \rightarrow 2CO_ + 3H_O$ (б)
$C_H_ + 5O_ \rightarrow 3CO_ + 4H_O$ (в)
$C_H_ + 6,5O_ \rightarrow 4CO_ + 5H_O$ (г)
Определяем их объемы в природном газе объемом 5 $м^$:
$V(CH_)= V \phi (CH_); V(CH_) = 5 \cdot 0,92 м^ = 4,6 м^$;
$V(C_H_)= V \phi (C_H_); V(C_H_) = 5 \cdot 0,03 м^ = 0,15 м^$;
$V(C_H_)= V \phi (C_H_); V(C_H_) = 5 \cdot 0,016 м^ = 0,08 м^$;
$V(C_H_)= V \phi (C_H_); V(C_H_) = 5 \cdot 0,004 м^ = 0,02м^$;
Аналогично, используя уравнения реакций (б), (в) и (г), получаем:
$V_(O_) = 3,5V(C_H_); V_(O_) = 3,5 \cdot 0,15 м^ = 0,525 м^$;
$V_(O_) = 5V(C_H_); V_(O_) = 5 \cdot 0,08 м^ = 0,4 м^$;
$V_(O_) = 6,5V(C_H_); V_(O_) = 6,5 \cdot 0,02 м^ = 0,13 м^$.
Общий объем кислорода, требуемый для реакции, составляет:
Вычисляем необходимый объем воздуха:
Источник