Очередной природный индикатор — сок красной капусты
Наконец-то я смогла продолжить свои цветные опыты с растениями-индикаторами. О них я писала в статье про индикаторы из китайской розы (гибискуса), а также в статье про сок смородины и вишни в качестве индикатора.
Тогда мне не удалось найти классический природный индикатор – краснокочанную капусту, а вот позавчера совершенно случайно увидела ее на рынке, причем, забрала уже последнюю, чему сильно удивилась: так мало привозят или так быстро разбирают?
И, придя домой, сразу же решила попробовать, как сок красной капусты меняет цвет в кислотах и щелочах. Можно ли в домашних условиях сделать индикатор и определить кислотность с помощью сока красной капусты? Помогать мне в экспериментах, как всегда, вызвался сын, он любит цветные реакции.
Я измельчила капусту в блендере и выдавила сок. Он получился темно-фиолетовым, почти черным при электрическом освещении.
Что будет при добавлении обычной воды? В нейтральной среде он синий.
Пробуем на растворенной в воде лимонной кислоте. Капаем несколько капель самодельного индикатора из сока красной капусты в кислоту. Раствор становится красным.
То же самое происходит и с уксусом.
Теперь щелочная среда – пищевая сода и аммиак.
С раствором соды раствор становится сине-зеленым:
С аптечным 10%-ным раствором аммиак четко видна зеленая окраска:
На этом наши реактивы закончились, жаль, «Крота» не было. Впрочем, вы самостоятельно можете проделать самые разные опыты, например, с соком различных фруктов – тот же лимон или киви, с растворами мыла и стирального порошка.
Интересно будет проверить и другую бытовую химию, например, средства для очистки плит – на них ведь есть предупреждение о том, что работать с ними нужно в перчатках, вот и будет интересно посмотреть, какая там среда – кислая или щелочная.
А какую реакцию среды будет иметь бытовая химия с надписью «экологичная»? Есть в ней кислоты или щелочи?
Вот такая коротенькая статья на сегодня, но сколько интересного можно сделать на ее основе. Если, конечно, у вас нет такой проблемы, как у меня, с покупкой этой неуловимой красной капусты
Всем удачи и хорошего настроения! До встречи в следующей статье!
KidsChemistry теперь есть и в социальных сетях. Присоединяйтесь прямо сейчас! Google+ , В контакте , Одноклассники , Facebook , Twitter
Источник
Приготовление индикаторов из природного сырья


Остроух, А. А. Приготовление индикаторов из природного сырья / А. А. Остроух, Т. Н. Некрасова. — Текст : непосредственный // Юный ученый. — 2023. — № 2 (65). — С. 69-74. — URL: https://moluch.ru/young/archive/65/3354/ (дата обращения: 19.08.2023).
В статье автор описывает получение растворов индикаторов из природного сырья (различных растений), определяет с их помощью реакцию среды, делает вывод о применении этих индикаторов в повседневной жизни.
Ключевые слова: природные индикаторы, приготовление раствора индикатора, краснокочанная капуста, раствор, шелуха лука, индикатор, раствор моркови, среда раствора.
Тема данной работы является актуальной, так как в последнее время возрос интерес к растениям в связи с их применением в различных областях (химия, биология, экология, медицина). Широкое применение растения нашли в пищевой промышленности (пищевые добавки, пищевые красители). По окраске растений и её интенсивности экологи определяют наличие вредных веществ в атмосферном воздухе и почве. На основании проведенных исследований можно дать рекомендации по использованию отваров растительного сырья для примерной оценки величины рН, что актуально в случае отсутствия специального оборудования. По окраске приготовленных растворов и её интенсивности возможно определить наличие избытка кислот или щелочей в продуктах питания и моющих средствах. Информацию, полученную в этой работе, можно использовать как на уроках химии, так и на уроках биологии. Эта работа полезна и в узко прикладном направлении, например в домашнем хозяйстве и на даче, когда потребуется привести в порядок одежду или определить кислотность почвы на участке, которая влияет на урожайность овощей и фруктов.
Задачи: приготовить растворы индикаторов из различного сырья, определить среду растворов растительными индикаторами, сравнить индикаторы, полученные различными способами.
Предметы исследования: овощи (морковь, свёкла, укроп, лук, краснокочанная капуста), ягоды (черника, вишня).
Гипотеза: растения можно использовать в качестве индикаторов.
Химические индикаторы — это вещества, изменяющие свою окраску в зависимости от среды раствора.
В химических лабораториях чаще всего используются три индикатора. Это фенолфталеин, лакмус и метиловый оранжевый (метилоранж). Они изменяют цвет в зависимости от кислотности среды (показателя pH) и называются кислотно-основными индикаторами, или pH-индикаторами.
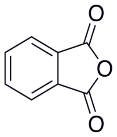
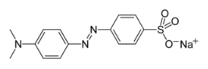
Фенолфталеин и метилоранж — это сложные органические вещества. Первый получается путём конденсации фенола и фталевого ангидрида (рис.1) при температуре 105–110 0 С в присутствии ZnCl 2 или концентрированной серной кислоты. Второй содержит в своём составе азот и является солью натрия (рис. 2).
Рис. 1 Фталевый ангидрид Рис. 2 Строение метилоранжа
Лакмус производится из растительного сырья, а именно, из некоторых видов лишайника: Roccella tinctoria (о-ва Кабо-Верде, Канарские о-ва, Мадейра, Азорские о-ва, западное побережье Южной Америки), Roccella fuciformis (Ангола и Мадагаскар), Roccella pygmaea (Алжир), Roccella phycopsis , Lecanora tartarea (Норвегия, Швеция), Variolaria dealbata (Пиренеи и Аверн), Ochrolechia parella (северо-запад Атлантического побережья Европы), Parmotrema tinctorum (Канарские острова), из различных видов рода Parmelia , Dendrographa leucophoea (США, Калифорния). Основными производителями лакмуса являются Мозамбик и США. [4]
Соки некоторых овощей и фруктов также обладают свойствами индикаторов и могут служить показателем pH среды.
Для начала я подготовила ягоды и натёрла овощи. Часть из них я залила кипятком, а часть — отложила для приготовления спиртовых растворов (рис. 3). Я дала водным растворам настояться в течение двух дней, чтобы овощи и ягоды достаточно окрасили воду. Затем я профильтровала растворы и разлила по пробиркам. Каждый раствор был налит в три пробирки (рис. 4): пробирка № 1 использовалась в качестве образца для сравнения, в пробирку № 2 я добавила раствор NaOH (гидроксид натрия), № 3 — раствор HCl (соляная кислота) и пронаблюдала за изменением окраски индикаторов.
Продукт для приготовления водного раствора индикатора
Источник