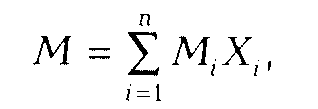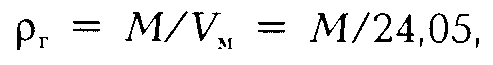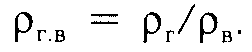4. Основные физико-химические свойства нефтяного и природного газов.
Газы газовых месторождений называются природными газами. Природные углеводородные газы представляют собой смесь предельных УВ. Основным компонентом является метан СН4. Наряду с метаном в состав природных газов входят более тяжелые УВ, а также неуглеводородные компоненты: азот N, углекислый газ СО2, сероводород H2S, гелий Не, аргон Аr.
Попутным или нефтяным газом называется газ нефтяных месторождений, добываемый вместе с нефтью.
Попутный нефтяной газ (ПНГ) представляет смесь газов. Основными составляющими ПНГ являются предельные углеводороды — гомологи метана от СН4 до С6Н14. Суммарное содержание гексана и более тяжелых углеводоро дов в попутном газе, как правило, не превышает 1 %, содержание пентана находится в пределах 2 %. Кроме того, в ПНГ присутствуют инертные газы, в основном, азот и углекислый газ.
На месторождениях нефти Удмуртской Республики и ряде месторождений Пермского края в составе ПНГ преобладает азот (до 80 %), содержание метана составляет 12-15%. Калорийность газа — 1,46 МДж/м 3 . Давления насыщения нефти газом высокие и близки к начальным пластовым давлениям (от 2,7 до 11,5 МПа).
Газовые смеси характеризуются массовыми или молярными концентрациями компонентов. Для характеристики газовой смеси необходимо знать ее среднюю молекулярную массу, среднюю плотность или относительную плотность по воздуху.
где Мi — молекулярная масса i-го компонента; Xi — объемное содержание i-го компонента, доли ед. Для реальных газов обычно М = 16-20.
где Vм — объем 1 моля газа при стандартных условиях. Обычно значение ρг находится в пределах 0,73-1,0 кг/м 3 .
Чаще пользуются относительной плотностью газа по ρг.в, которая определяется по следующей формуле:
,
где ρг- — плотность газа;
ρ в -плотность воздуха при тех же давлении и температуре
Уравнения состояния газов
Уравнения состояния газов используются для определения многих физических свойств природных газов. Уравнением состояния называется аналитическая зависимость между давлением, объемом и температурой.
Состояние газов в условиях высоких давления и температуры определяется уравнением Клайперона — Менделеева:
pV = NRT,
V — объем идеального газа;
N — число киломолей газа;
R — универсальная газовая постоянная;
Эти уравнения применимы для идеальных газов.
Идеальным называется газ, силами взаимодействия между молекулами которого пренебрегают. Реальные углеводородные газы не подчиняются законам идеальных газов. Поэтому уравнение Клайперона — Менделеева для реальных газов записывается в виде
pV=ZNRT,
где Z — коэффициент сверхсжимаемости реальных газов, зависящий от давления, температуры и состава газа и характеризующий степень отклонения реального газа от закона для идеальных газов.
- Коэффициент сверхсжимаемостиZ реальных газов — это отношение объемов равного числа молей реального V и идеального Vи газов при одинаковых термобарических условиях (т.е. при одинаковых давлении и температуре):
Z = V/Vи
Значения коэффициентов сверхсжимаемости наиболее надежно могут быть определены на основе лабораторных исследований пластовых проб газов.
где Pкрi, и Tкрi — критические давление и температура i-го компонента;
Xi — доля i-го компонента в объеме смеси (в долях единицы).
- Влагосодержание природных газов связано с тем, что природные газы и газоконденсатные смеси контактируют с пластовыми водами различных форм и вследствие чего содержат определенное количество паров воды.
Концентрация водяных паров в газе зависит от его состава, давления, температуры.
Объемный коэффициент пластового газа bг представляет собой отношение объема газа в пластовых условиях Vпл.г к объему того же количества газа Vст, который он занимает в стандартных условиях, можно найти с помощью уравнения Клайперона — Менделеева:
bг = Vпл.г/Vст = Z(Pcт×Тпл/(Рпл×Тст),
где Рпл, Тпл, Pcт,××Тст — давление и температура соответственно в пластовых и стандартных условиях.
Значение величины bг имеет большое значение, так как объем газа в пластовых условиях на два порядка (примерно в 100 раз) меньше, чем в стандартных условиях.
Источник: Эксплуатация магистральных газопроводов: Учебное пособие. (Под ред. Ю.Д. Земенкова) Изд-во «Вектор Бук» Тюмень, 2002
Источник
Нефтяные газы и их свойства
Природные углеводородные газы находятся в недрах земли или в виде самостоятельных залежей, образуя чисто газовые месторождения, либо в растворенном виде содержится в нефтяных залежах. Такие газы называются нефтяными или попутными, так как их добывают попутно с нефтью.
Природные нефтяные газы – смеси предельных углеводородов, главной составляющей которой является метан. В виде примесей в природном газе присутствуют азот, углекислый газ, сероводород, меркаптаны, гелий, аргон и пары ртути.
Физические свойства природного газа зависят от его состава, но в целом они близки к свойствам метана, как основного компонента смеси.
Попутные газы месторождений Муравленковского региона содержат от 59,7 % до 84 % метана.
Молекулярная масса газа: 16-20 кг/кмоль.
Плотность газа: 0,73 – 1 т/м 3 .
При расчетах пользуются относительной плотностью -плотность газа, взятая по отношению к плотности воздуха.Относительная плотность нефтяных газов колеблется от 0.554 для метана до 2.49 для пентана и выше. Чем больше в нефтяном газе легких углеводородов — метана СН4 и этана С2Н6 (относительная плотность — 1.038), тем легче этот газ. При нормальных условиях метан и этан находятся в газообразном состоянии. Следующими за ними по относительной плотности являются пропан С3Н8 (1.522) и бутан С4Н0 (2.006), которые также относятся к газам, но легко переходят в жидкость даже при небольших давлениях.
Относительная плотность попутных газов Муравленковского региона варьируется от 0,763 до 1,029.
Вязкость нефтяного газа при давлении 0,1 МПа и температуре 0 0 С обычно не превышает 0,01 МПа·с. С повышением давления и температуры она незначительно увеличивается. Однако при давлениях выше 3 МПа увеличение температуры вызывает понижение вязкости газа, причем газы, содержащие более тяжелые углеводороды, как правило, имеют большую вязкость.
Теплоемкость газа. Теплоемкостью называется количество тепла, необходимое для нагревания единицы веса или объема этого вещества на 1 0 С. Весовая теплоемкость газа измеряется в кДж/кг∙град, а объемная в кДж/м 3 ∙град.
Теплота сгорания газа. Теплота сгорания какого-либо вещества определяется количеством тепла, выделяющимся при сжигании единицы веса или единицы объема данного вещества. Теплота сгорания газов выражается в кДж/кг и кДж/м 3 и является основным показателем, характеризующим газ или топливо. Если при постоянной температуре повышать давление какого-либо газа, то после достижения определенного значения давления этот газ сконденсируется, т.е. перейдет в жидкость. Для каждого газа существует определенная предельная температура, выше которой ни при каком давлении газ нельзя перевести в жидкое состояние.
Наибольшая температура, при которой газ не переходит в жидкое состояние, как бы велико ни было давление, называется критической температурой.
Природный газ — смесь газов. Компонентами природного газа являются углеводороды парафинового ряда: метан, этан, пропан, изобутан, а также неуглеводородные газы: сероводород, углекислый газ, азот. При эксплуатации газовых и газоконденсатных месторождений в скважинах, газосборных сетях, магистральном газопроводе при определенных термодинамических условиях образуется кристаллогидраты. По внешнему виду они похожи на сажеобразную массу или лед. Гидраты образуются при наличии капельной влаги и определенных давлениях и температурах. В зависимости от преобладания в нефтяных газах легких (метан, этан) или тяжелых (пропан и выше) углеводородов газы разделяются на:
Сухие -природный газ, который не содержит тяжелых углеводородов или содержит их в незначительных количествах.
Жирные — газ, содержащий тяжелые углеводороды в таких количествах, когда из него целесообразно получать сжиженные газы или газовые бензины.
На практике принято считать жирным газом такой, в 1 м 3 которого содержится более 60 гр газового бензина. При меньшем содержании газового бензина газ называют сухим. С тяжелыми нефтями добывают преимущественно сухой газ, состоящий главным образом из метана. В нефтяных газах, кроме углеводородов, содержатся в незначительных количествах углекислый газ, сероводород и др. Важной характеристикой природного газа является растворимость его в нефти.
Понравилась статья? Добавь ее в закладку (CTRL+D) и не забудь поделиться с друзьями:
Источник
6. Природный углеводородный газ, попутный или нефтяной газ. Их физико-химические свойства, различие состава.
Углеводородные газы, генерируемые в осадочной оболочке земной коры, могут находиться в различных состояниях: свободном, растворенном, твердом и др. В свободном состоянии они образуют газовые скопления. Углеводородные газы хорошо растворимы в подземных водах и нефтях. При определенных условиях они вступают в соединение с водой и переходят в твердое состояние.
Химический состав газов. Газы газовых скоплений представлены в основном метаном (до 98,8 % ) с примесью его гомологов, а также неуглеводородных компонентов: углекислого газа, азота и сероводорода. Ввиду резкого преобладания метана и небольшого (до 0,2%) количества жидких его гомологов эти газы относят к так называемым сухим газам.
Газы, растворенные в нефтях, называются попутными нефтяными газами. Состав нефтяных попутных газов резко отличается от сухих значительным содержанием этана, пропана, бутана и высших углеводородов (в сумме до 50 %). Поэтому они получили название жирных или богатых газов. В составе газов, растворенных в подземных водах, основное значение имеют метан, азот и углекислый газ. Концентрация метана в растворенном газе может достигать 80—95 % и составлять тысячи кубических сантиметров на литр, концентрации углеводородов имеет иногда промышленное значение.
Диффузия газа—это явление взаимного проникновения одного вещества в другое (при их соприкосновении), обусловленное движением молекул. Диффузия газов в осадочных толщах в естественных условиях осуществляется преимущественно через водонасыщенные поры и трещины пород. Диффузия вызывается в основном разностью концентраций газа в смежных частях горных пород и протекает в направлении от большей концентрации к меньшей. Коэффициенты диффузии D зависят как от состава диффундирующего газа, так и от свойств среды, через которую происходит диффузия, и от термодинамических условий (коэффициенты диффузии увеличиваются с температурой).
Явления диффузии газов имеют существенное значение в процессах формирования и разрушения залежей газа.
Растворимость углеводородных газов в нефти примерно в 10 раз больше, чем в воде. Жирный газ лучше растворим в нефти, чем сухой, более легкая нефть растворяет больше газа, чем тяжелая.
Газ, растворяясь в нефти, увеличивает ее объем и уменьшает плотность, вязкость и поверхностное натяжение. Если объем газовой фазы значительно превышает объем нефти, то при давлении 200—250 кг/см 2 и температуре 90—95 °C наступает обратная растворимость—жидкие углеводороды начинают растворяться в газе, и при определенных давлении и температуре смесь флюидов полностью превратится в газ. Это явление называется ретроградным или обратным испарением. Физические свойства природных газов, которые были рассмотрены выше, играют заметную роль в процессах формирования залежей нефти и газа и в размещении их в земной коре. Например, нефть сама по себе практически не может мигрировать через труднопроницаемые породы, в то время как в растворенном состоянии в газе для нее эти породы не являются такой преградой на пути миграции.
При понижении давления из газа начинает выпадать конденсат в виде жидких углеводородов. Это явление называется обратной конденсацией. При повышении давления конденсат снова превращается в газ.
Для каждого газа существует температура, выше которой газ не переходит в жидкое состояние, как бы велико ни было давление. Так же для каждого газа существует предельное давление, ниже которого, как бы ни низка была температура, газ не переходит в жидкое состояние. Эти предельные температура и давление называются критическими.
Источник