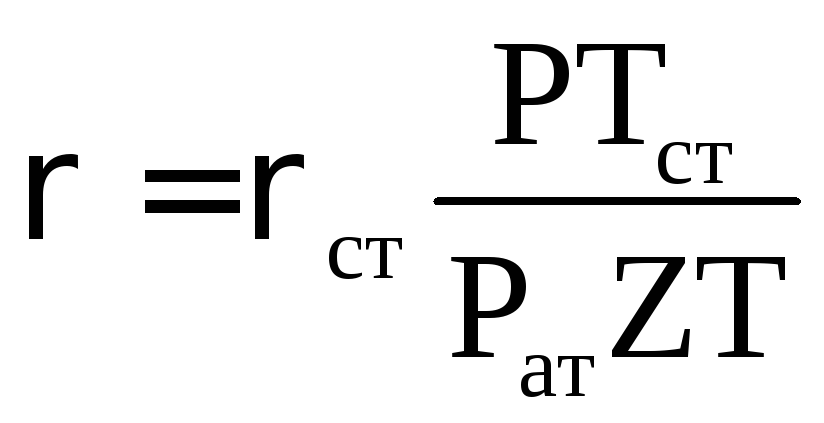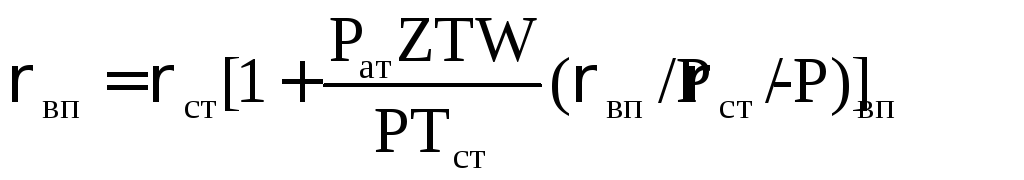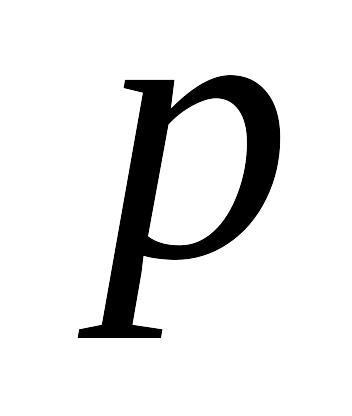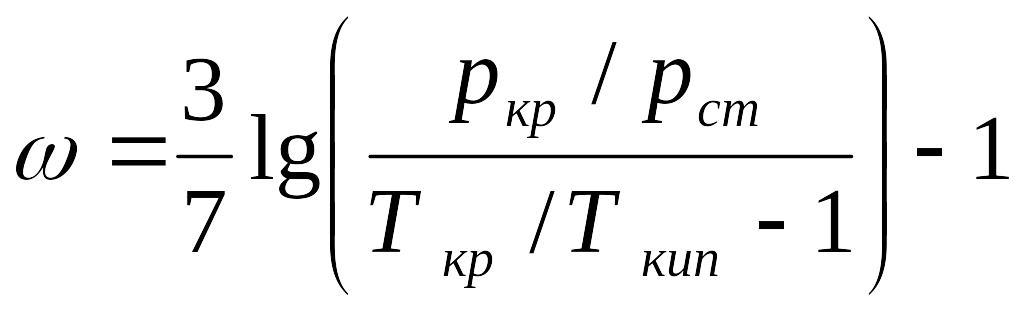- 2.3 Гидратообразование газов (рис 97-107)
- Вязкость газа (m)
- 2.2.3 Приведенные параметры природных газов (рис 39-40)
- 2.2.4 Плотность газа (рис стр 40-43)
- 3.2.3. Критические и приведённые термодинамические параметры
- 3.3. Уравнения состояния
- 3.3.1. Уравнения состояния природных газов
- 3.3.2. Обобщённое уравнение состояния
2.3 Гидратообразование газов (рис 97-107)
Природные газы, представляющие собой смесь различных компонентов, при определенных давлениях и температурах в присутствии воды образуют белые кристаллические вещества, названные гидратами.
Из компонентов природных газов самостоятельно образуют гидраты: метан, этан, пропан, изобутан, азот, диоксид углерода, сероводород, а также меркаптаны.
Известны две структуры гидрата: структура I состоит из 46 молекул воды, а структура II – из 136. Число молекул воды в гидрате, приходящемся на одну молекулу газа при полном заполнении всех полостей, равно: для структуры I –n=5,75, для структуры II – n=5,667.
Как правило, природные газы образуют гидраты II структуры. При содержании пропана и изобутана в составе природных газов в 0,1% образуются гидраты структуры II, а в остальных случаях – структуры I. Гидраты структур I и II различаются между собой только их кристаллографическими данными (см. таблицу 2.11).
Экспериментально установлено, что гидраты, как правило, образуются на поверхности контакта воды с газом.
Механизм гидратообразования газов заключается в следующем, На поверхности раздела фаз происходит выпрямление искривленных водородных связей между молекулами воды в поверхностном слое жидкости. Мольный объем воды увеличивается. В результате полости квазикристаллической структуры воды оказываются доступными для адсорбции ими молекул газа. Когда количество адсорбпроводных молекул газа достигает их критической величины, происходит фазовый переход. Максимальное число молей газа в полостях структуры поверхностного слоя воды, требующееся для начала процесса гидратообразования, соответствует числу его молей в больших полостях элементарной ячейки гидратной решетки.
Таблица 2.11 – Параметры элементарных ячеек газовых гидратов
Источник
Вязкость газа (m)
Критическим состоянием вещества (газа) является такое состояние, при котором исчезает граница между его газовой и жидкой фазой и свойства этих фаз становятся равными друг другу.
Для природного газа (смеси углеводородных и не углеводородных компонентов) критические параметры – давление, температура, плотность, объем и т.д. –определяются как псевдокритические по составу газа расчётным путём.
Графический способ определения псевдокритических параметров состоит в определении величин (Рп.кр., Тп.кр.) по графической зависимости от относительной плотности газа по воздуху r.
Расчетный способ определения псевдокритических параметров применяется при известном составе газа, когда определены все компоненты природного газа, по формулам:
| Состав | Содерж. % | Критические параметры | Псевдокритические | ||
| Рк | Тк | Рпк | Тпк | ||
| СН4 | 74,1 | 4,69 | 190,5 | 3,4 | 141,2 |
| С2Н6 | 7,48 | 4,97 | 306,4 | 0,37 | 22,85 |
| ….. | |||||
| å | 4,76 Мпа 218,3 0 К |
Приведенными параметрами называют отношение соответствующих параметров к их критическим значениям. Приведённые параметры природного газа определяются как отношение давления и температуры к их псевдокритическим значениям:
Коэффициент сверхсжимаемости газа ( z ).
Коэффициент сверхсжимаемости является отношением объема V газа, при заданных давлениях и температуре, к объему этого газа, определённому при идентичных Р и Т по законам «идеального» газа:
Z = V/Vид., (2.8)
Коэффициент сверхсжимаемости характеризует отклонение объёма реального газа от объёма «идеального» газа. Он зависит от состава газа, давления и температуры и может быть определён аналитическим или графическим способом. На практике (для текущих технических расчетов, в том числе и при обработке данных по исследованиям скважин) применяется графический способ – по зависимости z от Тпр. и Рпр.
Плотность – отношение массы газа к его объему (кг/м 3 ).
Плотность газа при нормальных условиях (Р = 760 мм рт.ст. и Т = 273 0 К) определяется по формуле:
r = М/22.4, (2.9)
где М – молекулярная масса газа.
Плотность п. газа зависит от состава, давления и температуры. Плотность газа при заданных (пластовых) условиях Р и Т определяется по известной плотности при нормальных (стандартных) условиях по формуле:
r = rст. (РТст/РатZТ) (2.10)
При наличие влаги (водяных паров) вносится в расчет поправка на влагосодержание. Для практических расчетов часто используется относительная плотность газа по воздуху ` r:
`r = r / rвозд., (2.11)
rвозд н 273 гр.К = 1.293 кг/м 3
r ст 293 гр.К = 1.205 кг/м 3
Вязкость – физическое свойство вещества, которое проявляется при движении и характеризует сопротивляемость скольжению и сдвигу одной части относительно другой.
Вязкость газа оценивается через коэффициент вязкости который зависит от давления, температуры и состава природного газа. При повышении в составе природного газа тяжелых углеводородов вязкость его увеличивается.
Влагосодержание газа (W) – это количество паров воды, растворенной в единице объема природного газа при заданных (например пластовых) условиях. Влагосодержание газа зависит от состава газа, Т, Р, физико – химических свойств конденсационной воды с которой с которой газ находится в термодинамическом равновесии.
где W0,6 – влагосодержание с `r = 0,6;
Сс – поправка на соленность воды;
Ср – поправка на отклонение плотности данного газа от 0,6.
Понравилась статья? Добавь ее в закладку (CTRL+D) и не забудь поделиться с друзьями:
Источник
2.2.3 Приведенные параметры природных газов (рис 39-40)
Приведенными параметрами называются отношения любых значений давления, температуры, объема и плотности к их критическим значениям и определяются формулами:
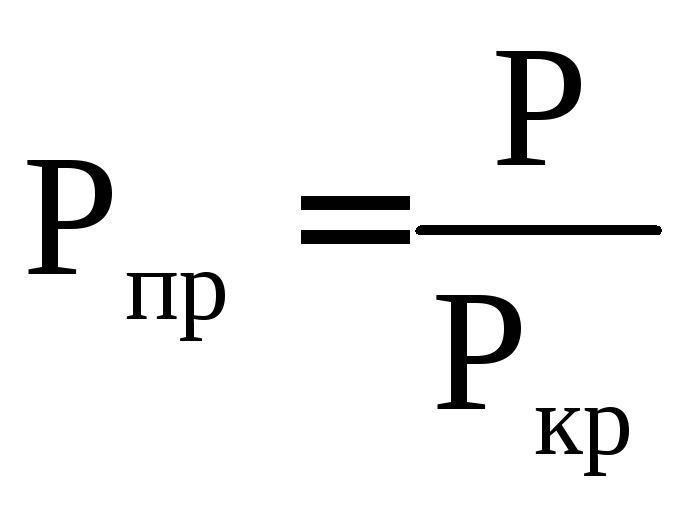



Эти параметры позволяют использовать принципы соответственных состояний для определения физических и теплофизических свойств газов. Наибольшее распространение получила двух- и трехпараметрическая форма принципа соответственных состояний. При двухпараметрической форме, т.е. без фактора ацентричности молекул, равенство физических свойств сравниваемых веществ достигается при равенстве двух приведенных параметров Рпри Тпр. При трехпараметрической форме равенства теплофизических свойств, кроме двух приведенных параметров Рпри Тпр, учитывается и ацентрический фактор ω.
2.2.4 Плотность газа (рис стр 40-43)
Плотность это отношение массы газа к единице его объема. Единица измерения плотности кг/м 3 . Плотность газа при стандартных условиях, т.е. при Р=0,1013МПа и Тст=293 К, может быть определена по формуле:
где М молекулярная масса газа. Для более точного определения плотности отдельных компонентов и смеси газов следует использовать равенства:

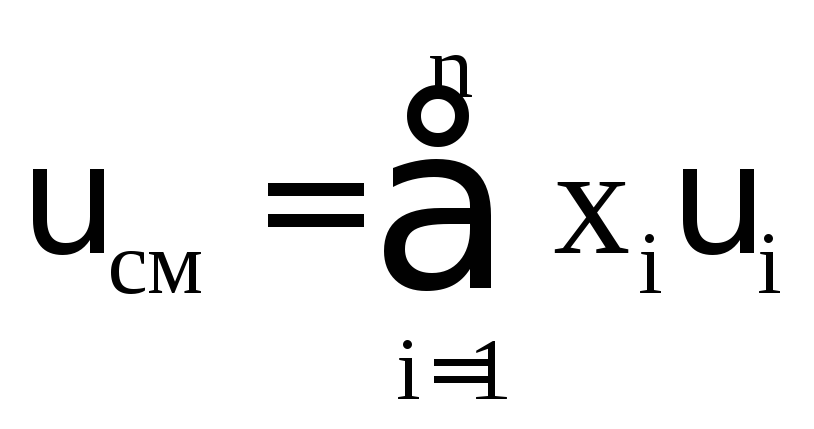
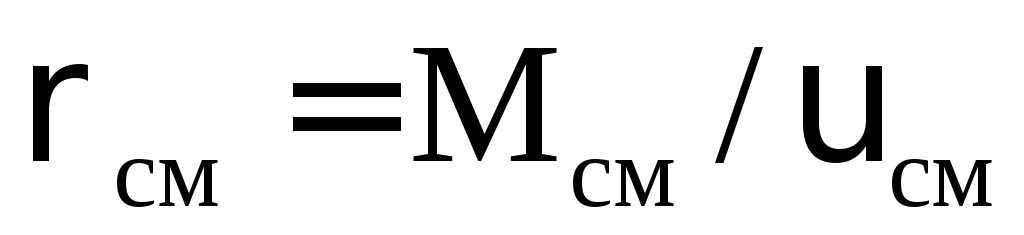
где xi мольная доля i-го компонента; Мi молекулярная масса i-го компонента; υi объем одного моля i-го компонента.
Значения Мi и υi, приведены в таблице 2.2. Как видно из этой таблицы объем одного моля различных компонентов, входящих в состав природных газов, меняется от 20,87·10 -3 м 3 /моль для пентана до 22,71·10 -3 м 3 /моль для октана.
Плотность газов зависит от их состава, давления и температуры. Плотность газа при заданных давлении и температуре определяется по известной плотности при нормальных или стандартных условиях по формуле:
(в рабочих условиях) (2.12)
где ρст плотность газа при стандартных условиях, т.е. при Р=0,1013 МПа и Тст=293 К, значение которой для отдельных компонентов берется из таблицы 2.2, а при известном составе газа ρст определяется по формуле:
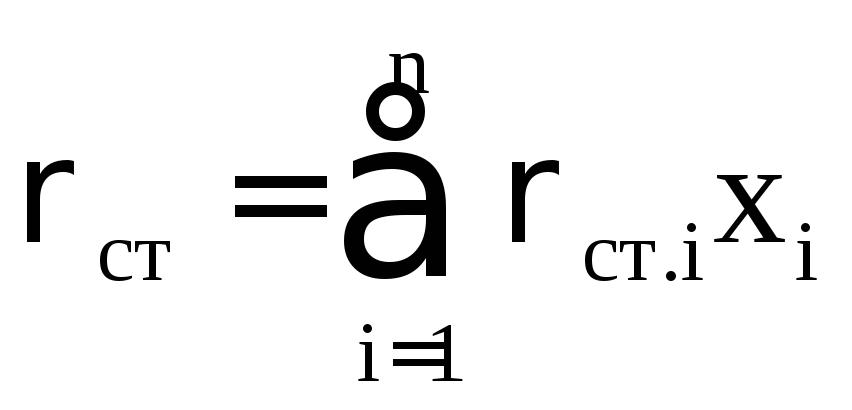
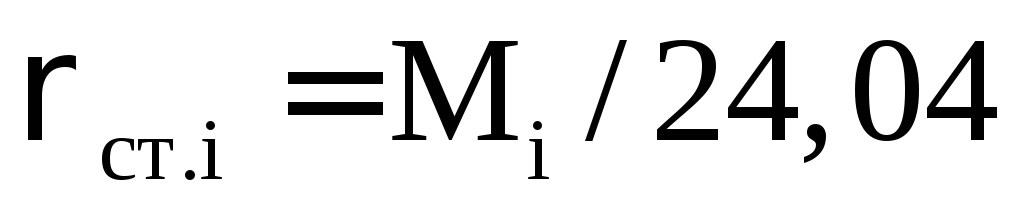
где Tст стандартная температура, К; Рат атмосферное давление, МПа; Z коэффициент сверхсжимаемости газа при заданных Р и Т.
Пример: 
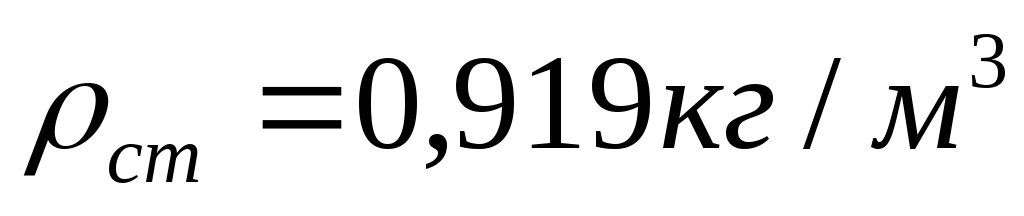
При наличии влаги водяных паров в газе, его плотность определяется по формуле:
(2.14)
где W влагосодержание газа при условиях Р и Т, определяется согласно методам, изложенным в пункте 2.2.7; рвп плотность насыщенного водяного пара; Рвп давление насыщенного водяного пара.
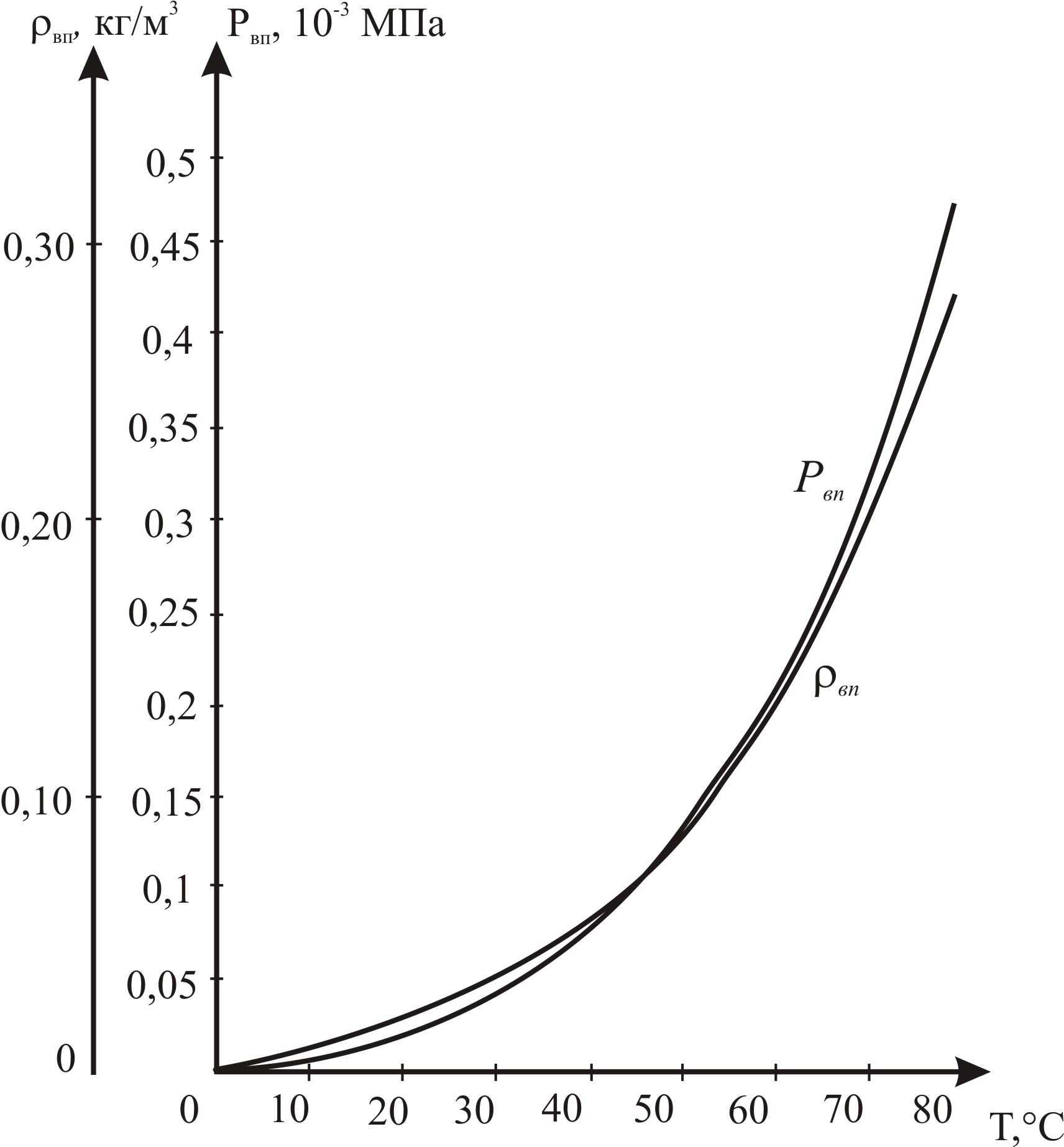
Значения ρвп и Рвп приведены в таблице 2.3 и показаны на рисунке 2.3. При использовании формулы (2.14) значение Z должно быть определено без учета наличия паров воды в газе.
Рисунок 2.3 Зависимости плотности ρвп и давления Рвп насыщенного водяного пара от температуры.
Таблица 2.3 Зависимости плотности и давления насыщенного пара воды от температуры.
ρвп, кг/м 3
ρвп, кг/м 3
ρвп, кг/м 3
Источник
3.2.3. Критические и приведённые термодинамические параметры
Критическим состоянием называется такое состояние вещества, при котором плотность вещества и его насыщенного пара равны друг другу. Параметры, соответствующие этому состоянию, называются критическими параметрами.
Критической называется такая температура, выше которой газ под действием давления любого значения не может быть превращён в жидкость.
Критическое давление — это давление необходимое для сжижения газа при критической температуре.
Критическим объёмом называют объём, равный объёму одного моля газа при критических значениях давления и температуры.
Для природных газов значения и при известных параметрах компонент хi, , определяются как среднекритические (псевдокритические).
Если известна относительная плотность газа ` , то средние значения критических давления и температуры природного газа можно определить по графикам. При содержании в природном газе N2, СО2 или Н2S в значения и вводятся соответствующие поправки.
Когда содержание N2, СО2 или Н2S превышает 15 % об., вместо графиков для определения и следует пользоваться формулой (3.18).
Часто в расчетах, например при определении вязкости и коэффициента сверхсжимаемости газа, пользуются так называемыми приведенными давлениями и температурами.
Приведенным давлением называется отношение давления газа к его критическому давлению : .
Приведенной температурой газа называется отношение абсолютной температуры газа к его критическому значению: .
3.3. Уравнения состояния
3.3.1. Уравнения состояния природных газов
Уравнением состояния называется аналитическая зависимость между термодинамическими параметрами, описывающими поведение вещества. В качестве таких параметров используются: давление , температура и плотность ρ.
Уравнение состояние идеального газа
Идеальный газ — это газ в котором можно пренебречь объёмом молекул и взаимодействием их между собой
Подходы в описании уравнений состояния реальных газов:
— в уравнение реального газа вводится один коэффициент , который учитывает отклонение данных газов от идеального и называется коэффициентом сверхсжимаемости, а само модифицированное уравнение называют обобщённым газовым законом;
— получают эмпирические уравнения состояния с числом параметров больших двух.
3.3.2. Обобщённое уравнение состояния
Коэффициент сверхсжимаемости является функцией приведенных значений давления , температуры и для тяжелых углеводородов С5+ — ацентрического фактора ω.
Ацентрический фактор — учитывает нецентричность сил притяжения и рассчитывается по формуле Эдмистера:
, (3.21)
где отношение критической температуры к температуре кипения можно определить по формуле Гуревича (до С7, включительно)
где 540 ≤ Tкр ≤ 775 К, 372 ≤ Tпр ≤ 625 К, для смесей газов , 0 < ω < 0,4.
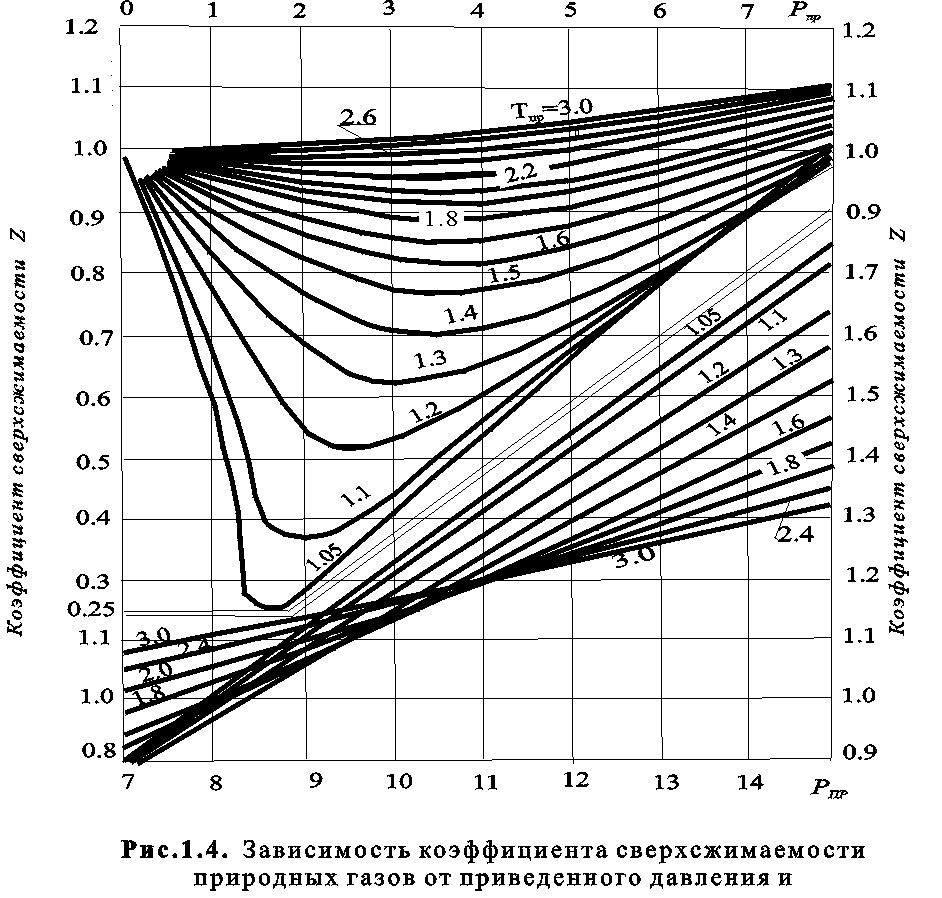
Коэффициент сверхсжимаемости определяется графически (рис. 7) или приближенно аналитически.
График действителен для газа, не содержащего значительных количеств неуглеводородных компонентов. Большую часть неуглеводородных компонентов составляет азот. Поэтому коэффициент сжимаемости газа можно рассчитать по правилу аддитивности:
где уа – мольная доля азота, zа – коэффициент сжимаемости азота, zу — коэффициент сжимаемости углеводородной части газа.
Для определения величин zа используются специальные графики (рис. 8).
Зная коэффициент сверхсжимаемости (z) и объём, занимаемый газом при нормальных условиях, можно оценить его объём при пластовых условиях по закону Бойля–Мариотта:
. (3.24)
Рис. 7. Зависимость коэффициентов сверхсжимаемости природных газов от приведенного давления
Рис. 8. Зависимость коэффициента сжимаемости азота zа от давления и температуры
Отношение объёма газа при пластовых условиях (Vпл.) к объёму газа при нормальных условиях (Vo) называется объёмным коэффициентом (b) газа:
. (3.25)
Объёмный коэффициент газа используется при пересчёте объёма, занимаемого газом при нормальных условиях на пластовые условия и наоборот, например, при подсчёте запасов.
Источник