- Пиролиз метана из чего состоит и для каких целей применяется
- Разновидности пиролиза
- Как осуществляется реакция
- Продукты пиролиза
- Области применения пиролиза метана
- Пиролиз метана: понятие, реакция, уравнение, продукты
- Пиролиз метана реакция
- Пиролиз метана уравнение
- Продукты пиролиза метана.
- 2.1.3.1. Термоокислительный пиролиз природного газа.
- 2.1.3.2. Электрокрекинг природного газа.
- 2.1.3.3. Разложение жидких углеводородов в различных видах электрических разрядов [19,71].
Пиролиз метана из чего состоит и для каких целей применяется
Пиролиз метана – это процесс расщепления углеводородов на соединения с более низкой молекулярной массой. Для этого газ нагревают до высоких температур в специальной установке.
Разновидности пиролиза
Выделяют две основных разновидности пиролиза: низко- и высокотемпературный. В первом случае газ нагревают до 450-900°С. При высокотемпературном пиролизе установку разогревают выше 900°С. Главное отличие этого вида реакции – возможность получения с ее помощью ацетилена и диеновых углеводородов.
В зависимости от способа подвода тепла к пиролитической установке, выделяют такие виды превращения метана:
- Регенеративный – печь сначала подогревают топочными газами, а потом при помощи насадки пропускаю газ.
- Гомогенный – в горячий газ вводят сырье, которое поддается переработке.
- Электрокрекинг – для обработки используют электродуговые печи.
- Окислительный – горение углеводородов, сопровождающееся выделением кислорода, и реакция пиролиза с его поглощением соединены в одном устройстве.
Имеет значение скорость подвода тепла к установке. Быстрый пиролиз требует меньше энергии и не вредит окружающей среде. Продукты этого вида переработки чище, чем при медленной реакции.
Как осуществляется реакция
Кратко химическую реакцию можно описать следующим образом:
На первом этапе пиролитического превращения газ нагревают до 900-1000°К. Следующая стадия получила название конверсии. Она состоит из двух этапов. На первом за несколько миллисекунд метан нагревают до 2000°К. Далее смесь выдерживают под давлением от 2 до 5 МПа в течение 5 мс. Заключительный этап – закалка метана.
Продукты пиролиза
При высокотемпературном нагревании метана получают вещества из группы олефинов. К продуктам пиролиза газа относятся этилен и ацетилен. Помимо этих веществ, образуются такие соединения:
- бутан,
- окись углерода,
- водород,
- пропилен,
- диацетилен,
- венилацетилен.
Ацетилен – это горючий газ. Его химическая формула – С2Н2. Он легче воздуха, имеет резкий запах.
Фактором, характеризующим эффективность реакции, является устойчивость получаемых соединений к действию высоких температур. Стойкость ацетилена при нагревании увеличивается, а других продуктов – падает.
Недостаток ацетилена – неустойчивость. За минимальный промежуток он может превратиться в водород и углерод. Поэтому газы, образованные в результате пиролитической реакции, могут пребывать в реакционной зоне 0,01 секунду.
Технический углерод (сажа) вместе с водородом являются конечными продуктами высокотемпературной обработки метана. Пиролиз используют для получения сажи. В результате реакции образуется 1 атом углерода и 2 атома водорода.
Этилен – результат превращения ацетилена. Переработка последнего усложняет процесс и делает его более затратным. Важный углеводород получают также при прямом превращении метана. С этой целью изобрели комбинированную закалку.
Области применения пиролиза метана
Раньше ацетилен использовали для освещения улиц, устанавливая лампы с этим веществом. Сейчас газ применяют в химической промышленности. Из ацетилена изготавливают каучук, пластмассы, растворители, волокна химического происхождения – вот, для чего используют пиролиз метана.
Этилен добывают как мономер для полиэтилена, сополимеров. Их применяют в следующих областях:
- автомобилестроении,
- изготовлении транспортных лент,
- производстве оболочек для кабелей,
- изготовлении резины, шлангов.
Пиролиз метана – реакция, с помощью которой получают важные углеводороды ацетилен и этилен. Их используют в химической промышленности, автомобилестроении, производстве резины.
Источник
Пиролиз метана: понятие, реакция, уравнение, продукты
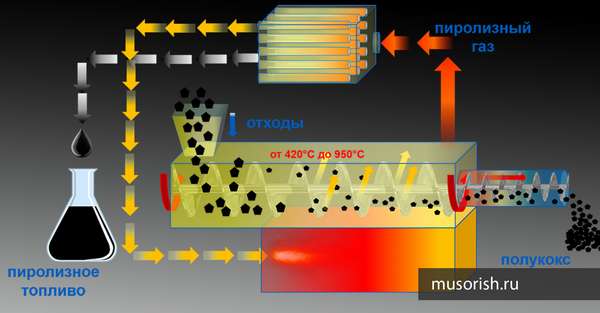
Какой станет наша планета через пару десятков лет – вот вопрос, который до сих пор мучает все человечество. Превратится ли наш дом в уютный уголок, или же постоянно расширяющаяся свалка скоро доберется до наших дворов? Переработка бытового мусора используется в развитых странах вот уже более 40 лет, но для России до сих пор являются чем-то новым. Тем более, что общественности практически ничего не известно о наиболее прогрессивных технологиях в сфере переработки мусора.
Так, далеко не все из нас знают о том, что из обычного бытового мусора, которым забит каждый полигон ТБО, вернее из его органической составляющей при помощи такого устройства как биореактор можно получить биогаз – газ, имеющий в своем составе метан.
Полученная путем сжигания биогаза электроэнергия способна не только удовлетворить собственные нужды мусороперерабатывающего завода, но и использоваться для последующей продажи. Представьте себе, как это удобно, ведь из обычных отходов можно получить доходы. Причем данная технология переработки мусора является абсолютно безопасной и экологически чистой.
Однако полученный из мусора метан можно не только сжигать для получения тепла и электричества. Из метана путем процесса пиролиза можно получать ацителен. Что же это за вещество, и для чего оно нужно? Об этом мы поговорим чуть позже, а пока сделаем основной упор на самом процессе пиролиза метана.
Пиролиз метана реакция
Пиролиз метана это процесс, осуществляемый при высокой температуре в 1200-1500°С с последующим ему быстрым охлаждением продуктов реакции. В результате пиролиза образуется ацитилен, который здесь является скорее не конечной целью, а промежуточным продуктом, необходимым для дальнейшего производства продуктов органического синтеза. Поскольку пиролиз метана только для получения ацетилена экономически невыгоден, данная технология обычно применяется на заводах, осуществляющих его дальнейшую переработку в такие продукты как, например, синтетический каучук. Важным фактором, определяющим степень эффективности процесса пиролиза метана, является стойкость получаемых и исходных углеводородов при высокой температуре.
Судить о термической стойкости углеводородов можно по изменению в зависимости от температуры свободной энергии их образования. Чем ниже при данной температуре будет свободная энергия, тем стабильнее углеводород. Исследования данной зависимости показали, что стабильность ацетилена увеличивается с повышением температуры у, в то время как у других углеводородов стабильность падает. Это означает, что они при соответствующих условиях способны превратиться в ацетилен. Поскольку свободная энергия образования ацетилена при температуре 1200 °С меньше чем свободная энергия образования метана, то это сделало возможным образование ацетилена непосредственно из метана.
Однако ацетилен при 1500°С является термодинамически неустойчивым веществом, и в весьма короткий промежуток времени может разложиться на водород и углерод (сажу). Во избежание разложения получившегося в процессе пиролиза метана ацетилена время пребывания пиролизных газов в реакционной зоне ни в коем случае не должно превышать сотой доли секунды.
Продукты, полученные в результате реакции пиролиза метана, быстро охлаждаются до температуры 90—200 «С. Делается это для того, чтобы сохранить ацитилен, поскольку при такой температуре реакция разложения ацетилена прекращается. Охлаждение ацитилена производят путем впрыскивания в газовый поток воды. Данный процесс называется закалкой ацитилена.
Пиролиз метана уравнение
В настоящее время подробной кинетической схемы процесса пиролиза метана не существует. Однако метод и реакции пиролиза можно представить в виде ряда химических уравнений. Ацетилен добывают из метана путем термического разложения (пиролиза) по реакции:
Для поддержания реакции пиролиза необходимо тепло, которое подводится путем нагрева исходных газов и образуется в результате сжигания непосредственно в реакционном объеме небольшого количества метана. В связи с тем фактом, что процесс пиролиза метана осуществляется в факеле, одновременно с образованием ацетилена протекает целый ряд побочных реакций, среди которых:
Помимо указанных, также протекают и реакции образования высших ацетиленовых углеводородов, например, таких как диацетилен, метил ацетилен, винилацетилен и др.
Продукты пиролиза метана.
Ацетилен это бесцветный горючий газ с формулой C2H2. Данное вещество, которое по своей массе легче воздуха, обладает резким запахом. Ацетилен был впервые получен в 1836 году химиком Эдмондом Дэви, который получил его путем обработки карбида калия водой. Тогда ацетилен было решено использовать для освещения улиц. Ацетиленовые горелки давали примерно в 15 раз больше света, нежели обычные газовые фонари на метане, которыми освещали улицы. С течением времени они были вытеснены электрическими фонарями, но еще долго использовались в отдельных местностях.
Данное вещество так и осталось бы забытым, если бы не развитие химической промышленности не нашло ему новое применение. В середине прошлого века ацетилен нашел все более широкое применение в качестве исходного сырья при производстве самых различных химических продуктов. Ацитилен используется для получения:
- мономеров для хлоропренового каучука
- различных пластических масс (поливинилхлорид, поливинилацет)
- химических волокон
- растворителей
Комментарии к статье
Вконтакте
Источник
2.1.3.1. Термоокислительный пиролиз природного газа.
Наиболее распространенный способ переработки природного газа в ацетилен. При работе по этому методу часть газа сжигается в токе кислорода с получением тепла, необходимого для конверсии оставшейся части сырья до ацетилена. Исходные продукты – метан и кислород – предварительно нагревают до температуры 550-600 0 С и направляют в реактор, состоящий из смесителя (СН4:О2 – 1:0,65), диффузора, горелки, реакционной камеры и закалочного устройства. Закалка способствует предотвращению разложения ацетилена на элементы. На 1 кг С2Н2 расходуется: природного газа – 4,5-6,5 кг; кислорода – 4,9 кг; водяного пара – 4 кг, электроэнергии — 1,5-2,0 кВт.ч. Выход сажи составляет — 3%, (такой же порядок, как при канальном способе ее производства). Состав газа (% объемные): С2Н2 – 7-9 %, Н2 – 45-55 %, СН4 – 5-25 %, СО – 26-27 %, СО2 – 3-4 % [65].
Сажи, получаемые в этом процессе, имеют довольно высокие значения удельной поверхности (60-120 м2/г), являются низкоструктурными (0,65-0,85 см 3 ДБФ/г).
2.1.3.2. Электрокрекинг природного газа.
Осуществляется в стальных охлаждаемых водой реакторах, в которых между двумя электродами, подключенными к высоковольтному (8000 В) источнику постоянного тока, возбуждается электрическая дуга. В зону ее действия, где средняя температура поддерживается на уровне 1600 0 С, вихревым потоком со скоростью 100 м/с подается природный газ. Выводимые из этой области продукты реакции, проходя через водоохлаждаемую трубу, остывают до температуры 600 о С, а затем, впрыскиванием воды, резко охлаждаются до 150 о С. После выделения сажи в нескольких последовательно установленных циклонах, пенном аппарате и электрофильтре, реакционные газы поступают на разделение. Их состав (% объемные): С2Н2 — 11-13 %, СН4 (неразложившийся) – 28-30 %, Н2 – 56-58 %, N2 – 3-7 %. Расход электроэнергии составляет 13000 кВт.ч/тонну С2Н2.. На тонну С2Н2 в зависимости от исходного состава газа получается от 60 до 180 кг сажи.
Сажи электрокрекинга метана имеют высокие значения удельной поверхности и являются высокоструктурными [65].
2.1.3.3. Разложение жидких углеводородов в различных видах электрических разрядов [19,71].
Общим для всех рассмотренных выше способов получения саж является то, что их реакционные устройства имеют высокотемпературную область, в которой происходит превращение сырья и образование целевых продуктов, направляемых далее в зону, где производится их закалка. Вся образовавшаяся сажа находится в объеме реакционных газов.
При разложении жидких углеводородов в электрических разрядах образующиеся газы мгновенно вытесняются в окружающую жидкую среду, где происходит их мгновенная закалка. Затем реакционные газы, пройдя слой сырья, удаляются из реактора, а сажа почти полностью в диспергированном виде остается в жидком продукте.
Исследования с использованием высоковольтной дуги [67], возбуждаемой от источника напряжением 15000 В промышленной частоты, позволили установить, что характер перерабатываемого сырья оказывает существенное влияние на составы и выходы продуктов распада. Из парафиновых углеводородов получается газ, содержащий (в объемных %) : С2Н2 – 31-33 %, С2Н4 — 9 %, СН4 — 2 %, Н2 – 57-58 %. Выход сажи составил — 14%, а расход электроэнергии – 9 кВт.ч/кг С2Н2. Из бензола получено: С2Н2 – 41,4 %, С2Н4 — 0,8 %, СН4 — 0,2 %, Н2 – 58%. Выход сажи составил 53,7%, а расход электроэнергии – 9,3 кВт.ч/кг С2Н2. При использовании высоковольтных дуговых разрядов можно работать под давлением до 0,5 МПа [68], осуществлять совместное разложение тяжелых и легких фракций нефтепродуктов, подавая последние в испаренном виде между электродами, находящимися в окружении высококипящего сырья [69].
Разложению в электрической дуге могут быть подвергнуты различные фракции углеводородов. Состав образующихся газов и выход сажи зависит от природы сырья, что иллюстрируется данными, приведенными в табл. 2.2. [71].
Составы и выходы продуктов, полученных при электрокрекинге нефтепродуктов и пиролизных смол [71].
Источник


 Комментарии к статье
Комментарии к статье Вконтакте
Вконтакте