Распространенность в природе серы
Сера довольно широко распространена в природе. Её содержание в земной коре составляет 0,0048 мас. %. Значительная часть серы встречается в самородном состоянии.
Также сера встречается в форме сульфидов: пирит, халькопирит и сульфатов: гипс, целестин и барит.
Много соединений серы содержится в нефти (тиофен C4H4S, органические сульфиды) и нефтяных газах (сероводород).
Окси́д се́ры (VI) (се́рный ангидри́д, трео́кись се́ры, се́рный га́з) SO3 — высший оксид серы, тип химической связи: ковалентная
Пространственная модель молекулы γ -SO3
полярная химическая связь. В обычных условиях легколетучая бесцветная жидкость с удушающим запахом. При температурах ниже 16,9 °C застывает с образованием смеси различных кристаллических модификаций твёрдого SO3.
Находящиеся в газовой фазе молекулы SO3 имеют плоское тригональное строение с симметрией D3h (угол OSO = 120°, d(S-O) = 141 пм.) При переходе в жидкое и кристаллическое состояния образуются циклический тример и зигзагообразные цепи.
Твёрдый SO3 существует в α-, β-, γ- и δ-формах, с температурами плавления соответственно 16,8, 32,5, 62,3 и 95 °C и различающихся по форме кристаллов и степени полимеризации SO3. α-форма SO3 состоит преимущественно из молекул триме́ра. Другие кристаллические формы серного ангидрида состоят из зигзагообразных цепей: изолированных у β-SO3, соединенных в плоские сетки у γ-SO3 или в пространственные структуры у δ-SO3. При охлаждении из парасначала образуется бесцветная, похожая на лёд, неустойчивая α-форма, которая постепенно переходит в присутствии влаги в устойчивую β-форму — белые «шёлковистые» кристаллы, похожие на асбест. Обратный переход β-формы в α-форму возможен только через газообразное состояние SO3. Обе модификации на воздухе «дымят» (образуются капельки H2SO4) вследствие высокой гигроскопичности SO3. Взаимный переход в другие модификации протекает очень медленно. Разнообразие форм триоксида серы связано со способностью молекул SO3 полимеризоваться благодаря образованию донорно-акцепторных связей. Полимерные структуры SO3 легко переходят друг в друга, и твердый SO3 обычно состоит из смеси различных форм, относительное содержание которых зависит от условий получения серного ангидрида.
Кислотно-основные: SO3 — типичный кислотный оксид, ангидрид серной кислоты. Его химическая активность достаточно велика. При взаимодействии с водой образует серную кислоту:
Однако в данной реакции серная кислота образуется в виде аэрозоли, и поэтому в промышленности оксид серы(VI) растворяют в серной кислоте с образованием олеума, который далее растворяют в воде до образования серной кислоты нужной концентрации.
.Загрязнение биосферы соединениями серы
Сернистый газ so2 Загрязнение атмосферы соединениями серы имеет важные экологические последствия. В атмосферу поступают главным образом сернистый газ и сероводород. В последнее время начинают привлекать внимание и другие соединения серы, образующиеся в результате микробиологических процессов. Главные естественные источники сернистого газа — вулканическая деятельность, а также процессы окисления сероводорода и других соединений серы. По некоторым расчетам, вследствие вулканической деятельности в атмосферу ежегодно попадает около 4 миллионов тонн сернистого газа. Но гораздо больше — около 200— 215 миллионов тонн сернистого газа — образуется из сероводорода, который поступает в атмосферу при разложении органического вещества.
Промышленные источники сернистого газа по интенсивности давно превзошли вулканы и сейчас сравнялись с суммарной интенсивностью всех естественных источников. В природе нет ископаемого топлива, которое состояло бы из одних углеводородов. Всегда имеется примесь других элементов, и один из них — сера. Даже природный газ содержит по крайней мере следы серы. В сырой нефти, в зависимости от месторождения, содержится от 0,1 до 5,5 процента серы, а уголь содержит от 0,2 до 7 процентов серы. Поэтому сжигание топлива дает 80—90 процентов всего антропогенного сернистого газа, причем больше всего (70 процентов и более) дает сжигание угля. Остальные 10—20 процентов приходятся на выплавку цветных металлов и производство серной кислоты. Сырьем для получения меди, свинца и цинка служат главным образом руды, содержащие большое количество серы (до 45 процентов). Те же самые руды и другие богатые серой минералы служат сырьем для получения серной кислоты.
Сернистый газ очень ядовит, он представляет угрозу здоровью и даже жизни человека и животных, наносит ущерб растительности. В СССР для сернистого газа в атмосфере предельно допустимые концентрации (ПДК) для разового воздействия — 0,5 миллиграмма на кубометр, средняя за сутки — 0,05, что в перерасчете на объемные концентрации дает 0,17 и 0,017 чнм, соответственно,
Обычная концентрация сернистого газа в нижней части атмосферы равна 0,2 чнб. Однако его распределение по земному шару очень неравномерно. По измерениям на станциях наблюдения за фоном (мониторинга), расположенных в различных районах мира и находящихся в удалении от непосредственных антропогенных источников этого газа, концентрации различаются в десятки и сотни раз. Наибольшие концентрации наблюдаются в Северном полушарии, причем максимальных значений они достигают в восточных и центральных районах США, в Центральной Европе (10—14 микрограммов на кубометр, или 3,4—4,8 чнб). В районах, где крупных городов и промышленных центров меньше (запад США, Европейская территория СССР и др.), концентрация сернистого газа на порядок меньше (1—4 микрограмма на кубометр, или 0,34—1,37 чнб), а в некоторых более чистых районах, как Кавказ и озеро Байкал, меньше 0,1 микрограмма на кубометр, или 0,034 чнб. В Южном полушарии концентрация сернистого газа в 1,5—2 раза ниже, чем в Северном, над океаном существенно ниже, чем над континентом, причем над океаном концентрация увеличивается с высотой, тогда как над континентами она уменьшается,
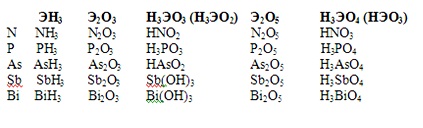
Общая характеристика элементов VA группы.
Главная подгруппа V группы периодической системы Д.И. Менделеева включает пять элементов: типичные p-элементы азот N, фосфорP, а также сходные с ними элементы больших периодов мышьяк As, сурьму Sb, и висмут Bi. Они имеют общее название пниктогены. Атомы этих элементов имеют на внешнем уровне по 5 электронов (конфигурация n s 2 n p 3 ).
В соединениях элементы проявляют степень окисления от -3 до +5. Наиболее характерны степени +3 и +5. Для висмута более характерна степень окисления +3.
При переходе от N к Bi радиус атома закономерно возрастает. С увеличением размеров атомов уменьшается энергия ионизации. Это значит, что связь электронов наружного энергетического уровня с ядром у атомов ослабевает, что приводит к ослаблению неметаллических и усилению металлических свойств в ряду от азота к Bi.
Азот и фосфор – типичные неметаллы, т.е. кислотообразователи. У мышьяка сильнее выражены неметаллические свойства. У сурьмы неметаллические и металлические свойства проявляются приближенно в одинаковой степени. Для висмута характерно преобладание металлических свойств.
У атома азота три неспаренных электрона. Поэтому валентность азота равна трем. Из-за отсутствия у него d-подуровня на внешнем уровне его электроны разъединиться не могут. Однако в результате донорно-акцепторного взаимодействия азот становится четырехвалентным.
У атомов фосфора и последующих элементов VА группы имеются свободные орбитали на d-подуровне и переходя в возбужденное состояние будут разъединятся 3s-электроны. В невозбужденном состоянии у всех элементов 5А группы валентность равна 3, а в возбужденном состоянии всех, кроме азота, равна пяти.
Элементы этой группы образуют газообразные водородные соединения (гидриды) типа ЭН3, в которых степень их окисления -3.
Источник
Сера, распространение в природе, способы получения, физические и химические свойства
Сера 16S расположена в 3 малом периоде, 6 группе, главной подгруппе.
Электронная конфигурация 1s 2 2s 2 2p 6 3s 2 3p 4
В основном состоянии у атома серы на внешнем энергетическом уровне находится 2 электрона. В возбужденном состоянии спаренные электроны s- и p – орбиталей могут переходить на свободные орбитали 3 d – подуровня.
Возможные степени окисления: -2, 0, +4, +6.
Распространение в природе
Сера достаточно широко распространена в природе: массовая доли этого элемента в земной коре составляет 0,05%. Сера встречается в природе в виде простого вещества (самородная сера) и входит в состав многих минералов — сульфидов. Из них наиболее распространенные: пирит FeS2, халькопирит FеСuS2, киноварь HgS, медный блеск CuS, свинцовый блеск PbS, мирабилит (глауберова соль) Na2SO4∙10Н2O, гипс CaSO4∙ 2H2O. Сера входят в состав нефти, каменного угля, содержится в растительных и животных организмов (в составе белков).
Добыча серы производится из природных ее залежей или выплавкой из серосодержащих горных пород.
В лаборатории серу можно получить при неполном сгорании сероводорода или при сливании растворов сероводородной и сернистой кислот:
Известны три аллотропные модификации серы: α- сера, или ромбическая, β-сера, или моноклинная, и пластическая, или каучукоподобная.
Это кристаллические вещества, которые различаются формой кристаллов и некоторыми физическими свойствами.
Наиболее устойчивая модификация — ромбическая, именно в таком виде сера встречается в природе в свободном состоянии. Ромбическая сера состоит из циклических молекул S8, в которых атомы серы соединены одинарными ковалентными связями.
Ромбическая сера – твердое кристаллическое вещество желтого цвета, не растворяется в воде, хорошо растворяется в сероуглероде CS2, и некоторых других органических растворителях, температура ее плавления +112,8 0 C, плотность 2,07 г/см 3
Моноклинная сера окрашена в темно- желтый цвет, температура плавления 119,3 0 С, плотность 1,96 г/см 3 .
При быстром охлаждении расплавленной серы образуется еще одна аллотропная модификация — пластическая сера, которая состоит из длинных молекул Sx (число x равно нескольким тысячам)
Сера – типичный активный неметалл. Она реагирует с простыми и сложными веществами. В химических реакциях может быть как окислителем, так и восстановителем. Это зависит от окислительно-восстановительных свойств, с которыми она реагирует.
S 0 +2e — → S -2 (окислитель, при взаимодействии с водородом, металлами, некоторыми неметаллами, имеющими меньшую ЭО)
1. взаимодействие с металлами
Сера, как типичный неметалл, взаимодействует со многими неметаллами, образуя сульфиды:
Эти реакции протекают, как правила, при нагревании.
2. взаимодействие с неметаллами
Сера реагирует со многими неметаллами (кислородом, водородом, углеродом, галогенами и др.). При взаимодействии с кислородом она образует оксид серы (IV) или диоксид серы, а с водородом – сероводород:
Реакции серы с неметаллами идут при нагревании.
3. взаимодействие с кислотами
Сера взаимодействует с кислотами, являющимися сильными окислителями, например с концентрированными азотной и серной кислотами:
4. взаимодействие со щелочами (ОВР, диспропорционирования)
Сера растворяется в водных растворах щелочей при нагревании, например:
Источник