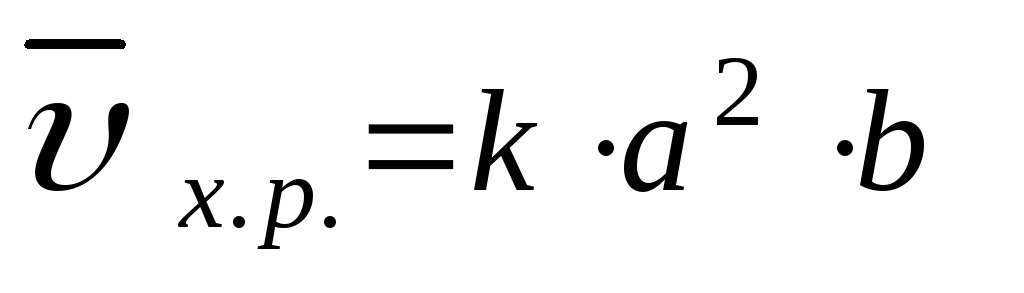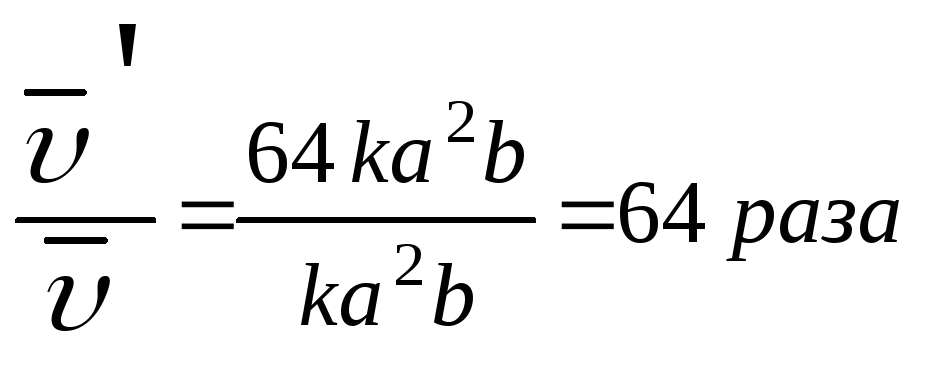- Скорость химических реакций. Зависимость скорости химических реакций от природы реагирующих веществ, концентрации, температуры, катализатора
- Понятие скорости химической реакции
- Факторы, влияющие на скорость химической реакции
- 2.1 Зависимость скорости реакции от природы реагирующих веществ
- 1. Зависимость скорости химической реакции от природы реагирующих веществ.
- 4. Зависимость скорости химической реакции от температуры.
Скорость химических реакций. Зависимость скорости химических реакций от природы реагирующих веществ, концентрации, температуры, катализатора
Скорость реакции – это число частиц образованных за единицу времени в единице объема.
Скорость химической реакции равна изменению количества вещества в единицу времени в единице реакционного пространства. Гомогенная реакция протекает в одной фазе. Гетерогенные реакции протекают на границе раздела фаз. [моль*м-3/с] не учитывая газы.
Все реакции можно подразделить на простые и сложные. Простые реакции протекают в одну стадию и называется одностадийными. Сложные реакции идут либо последовательно (многостадийные реакции), либо параллельно, либо последовательно-параллельно. В свою очередь, в каждой стадии реакции может участвовать одна молекула (мономолекулярные реакции), две молекулы (бимолекулярные) и три молекулы (тримолекулярные). Число молекул реагента, принимающих участие в простейшей (элементарной) стадии, называется её молекулярностью.
Порядок реакции — это сумма порядков реакции по реагентам.
Порядок реакции определяется суммой величин показателей степени при значениях концентраций исходных веществ в кинетическом уравнении:
Поэтому обе реакции первого порядка.
Молекулярность реакции определяется числом молекул, одновременным взаимодействием которых осуществляется акт химического взаимодействия. Реакция а) одномолекулярная, б) двухмолекулярная.
Выражение для определения скорости реакции первого порядка
Скорость реакции второго порядка для двух реагентов В и D подчиняется кинетическому уравнению
где С В – концентрация реагента В, а С D – концентрация реагента D.
Наиболее часто встречаются реакции первого и второго порядка. Реакции третьего порядка крайне редки. Реакции более высокого порядка, чем третий, неизвестны, так как в большинстве случаев реакции многостадийны.
Правило Вант-Гоффа. V2 = V1×gDT/ 10
Повышение температуры ускоряет большинство реакций. Согласно правилу Вант-Гоффа при увеличении температуры на 10 К скорость многих реакций увеличивается в 2-4 раза V2 = V1×gDT/ 10
Где V2 и V1 – скорость реакции при температурах Т2 и Т1, γ – коэффициент, значение которого для эндотермической реакции выше, чем для экзотермической реакции. Для многих реакций γ лежит в пределах 2- 4.
Скорость химических реакций зависит:
1. Природа реагирующих веществ
б) 2K+2H2O=2KOH+H2 Скорость реакции» б» больше чем «а», так как калий активнее натрия.
2. Концентрация. Чем выше концентрация, тем больше скорость реакции, Эта зависимость выражается законом действующих масс.
Например, сера горит в чистом кислороде и на воздухе. СКОРОСТЬ ГОРЕНИЯ СЕРЫ В КИСЛОРОДЕ В 5 раз больше, чем на воздухе.
Химические реакции, протекающие в гомогенных системах (смеси газов, жидкие растворы), осуществляется за счет соударения частиц. Однако, не всякое столкновение частиц реагентов ведет к образованию продуктов. Только частицы, обладающие повышенной энергией — активные частицы, способны осуществить акт химической реакции. С повышением температуры увеличивается кинетическая энергия частиц и число активных частиц возрастает, следовательно,
| химические реакции при высоких температурах протекают быстрее, чем при низких температурах |
Возрастание химические реакции при высоких температурах протекают быстрее, чем при низких температурах скорости реакции при нагревании в первом приближении подчиняется следующему правилу:
| при повышении температуры на 10 0С скорость химической реакции возрастает в два — четыре раза. |
3. Катализатор — вещество, изменяющее скорость реакции. Он может как увеличивать скорость реакции так и уменьшать (такой катализатор называется ингибитором).
Понравилась статья? Добавь ее в закладку (CTRL+D) и не забудь поделиться с друзьями:
Источник
Понятие скорости химической реакции
Механизм химических реакций сводится к разрыву связей в исходных веществах и возникновению новых связей в продуктах реакций. При этом общее число атомов каждого элемента до и после реакции остается постоянным.
Реакции могут быть гомогенными и гетерогенными. Гомогенные реакции протекают в однородной среде (например, в газовой фазе или жидком растворе). Гетерогенные реакции протекают в неоднородной среде – между веществами, которые находятся в разных фазах (например, в твердой и жидкой или газовой и жидкой и т.д.). Гомогенные реакции происходят равномерно во всем объеме, заполненном реагентами. Гетерогенные – происходят на границе раздела фаз. Примером гетерогенной реакции может служить реакции между веществом в газовой фазе и поверхностью жидкого или твердого тела.
Скоростью химической реакции называется число элементарных актов реакции, происходящих в единицу времени в единице объема (для гомогенных реакций) или на единице поверхности раздела фаз (в случае гетерогенных реакций)
Скорость химической реакции обычно характеризует изменение концентрации одного из реагирующих веществ в единицу времени.
При этом безразлично, о каком из участвующих в реакции веществе идет речь: все они связаны между собой уравнением реакции.
Обычно концентрацию выражают в [моль/л], а время — в секундах (с), поэтому размерность скорости реакции равна [моль/л • с].
Рассмотрим реакцию взаимодействия водорода с парами хлора:
Обозначим концентрацию паров хлора в начале некоторого отрезка времени t1 через С1, а при t2 – С2 . Так, хлор в процессе реакции расходуется, следовательно, С1> С2. Скорость реакции V может быть найдена из равенства
По мере расходования исходных веществ, скорость реакции уменьшается (рис. 1).
Рисунок 1- Изменение концентрации реагирующего вещества во времени
В ходе химических процессов концентрации веществ меняются непрерывно. Поэтому важно знать величину скорости реакции в данный момент времени, т.е. мгновенную скорость, которая выражается производной от концентрации во времени:
Мгновенная (истинная) скорость – это скорость реакции в конкретный момент времени.
где: t – это время от начала химической реакции до момента появления видимых изменений (изменение окраски раствора, появление газа, осадка).
Факторы, влияющие на скорость химической реакции
Скорость реакции зависит от природы реагирующих веществ, их концентрации и внешних условий (например, температуры, давления, катализаторов).
2.1 Зависимость скорости реакции от природы реагирующих веществ
В зависимости от природы реагирующих веществ реакции могут протекать как очень медленно (некоторые реакции между органическими веществами, многие реакции с участием твердых веществ, как, например, коррозия металлов), так и очень быстро (ионные реакции в растворах). В
промежуточном случае, скорость реакции может быть такой, что ее нетрудно измерять в ходе короткого опыта.
Зависимость скорости реакции от природы веществ очень сложна, она связана с их составом и строением. Химический процесс всегда представляет собой некоторую перегруппировку атомов, т. е. их обмен местами, разъединение или, наоборот, объединение отдельных атомов или молекул в более сложные. Совершенно естественно, что подобные процессы могут развертываться лишь при достаточно тесном сближении молекул реагентов или, как часто выражаются, при их столкновении.
Источник
1. Зависимость скорости химической реакции от природы реагирующих веществ.
Говорить о скорости химической реакции имеет смысл, если природа реагирующих веществ позволяет им вступать в химическое взаимодействие. Например, природа реагирующих веществ позволяет протекать первой и второй реакции, но не позволяет третьей.
1. Mg + O2 2MgО
2. Zn + 2HCl ZnCl2 + H2↑
3. NaOH + KOH ≠
2. Зависимость скорости химической реакции от концентрации реагирующих веществ определяется законом действия масс, который был установлен в 1867г опытным путем Гульдбергом и Вааге.
Скорость химической реакции при данной температуре пропорциональна произведению концентраций реагирующих веществ в степени, равной стехиометрическому коэффициенту, стоящему перед формулой данного вещества в уравнении реакции.
Закон действия масс справедлив только для наиболее простых по своему механизму реакций взаимодействия, протекающих в газах или в разбавленных растворах.
1.aA(Ж) + bB(Ж) ↔ cC(Ж) + dD(Ж) ; (T=const)
2. 3H2(Г) + N2(Г) ↔ 2NH3(Г);
1. aA(т) + bB(Г) = cC(Г) + dD(Г); 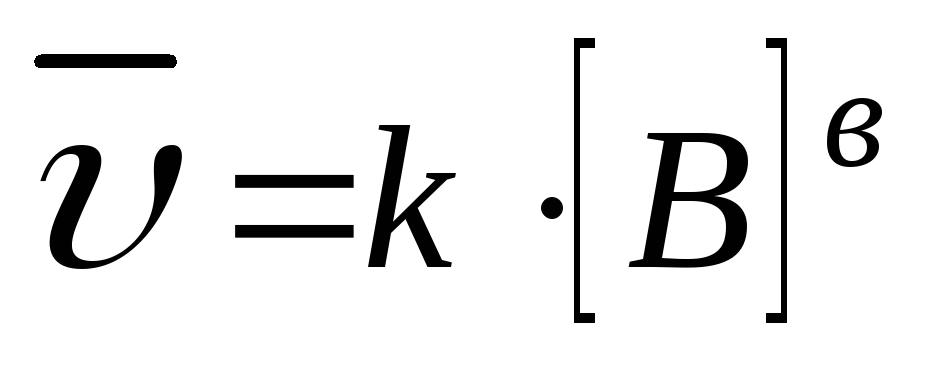
В законе действия масс не учитываются концентрации веществ, находящихся в твердой фазе. Чем больше площадь поверхности твердой фазы, тем выше скорость химической реакции.
k – константа скорости химической реакции определяется природой реагирующих веществ и зависит от температуры, от присутствия в системе катализатора, но не зависит от концентрации реагирующих веществ. Константа скорости представляет собой скорость химической реакции (

3. Зависимость скорости химической реакции от давления. Для газообразных систем увеличение давления или уменьшение объема, равноценно увеличению концентрации и наоборот.
Задача: Как изменится скорость химической реакции 2SO2(г) + O2(г) 2SO3(г), если давление в системе увеличить в 4 раза?
В соответствие с законом действия масс для прямой реакции, записываем выражение:

Уменьшение объема в 4 раза соответствует увеличению концентрации в системе в 4 раза, тогда
;
.
4. Зависимость скорости химической реакции от температуры.
Влияние температуры на скорость химической реакции приближенно определяется правилом Вант-Гоффа. При повышении температуры на 10 0 С скорость химической реакции возрастает в 2-4раза.
Математическая запись правила Вант-Гоффа: γ — температурный коэффициент скорости реакции или коэффициент Вант-Гоффа для большинства реакций лежит в пределах 2-4.
Задача. Во сколько раз изменится скорость химической реакции, протекающей в газовой фазе, если температура изменилась от 80 0 С до 120 0 С (γ = 3)?
В соответствии с правилом Вант-Гоффа записываем:
Увеличение скорости химической реакции при повышении температуры объясняется не только увеличением кинетической энергии взаимодействующих молекул. Например, число столкновений молекул растет пропорционально корню квадратному из абсолютной температуры

Энергия активации (EА)– это тот избыток энергии по сравнению со средним запасом, которым должны обладать молекулы для осуществления химической реакции. Если ЕА< 40 кДж/моль – реакции протекают быстро, если ЕА > 120 кДж/моль – реакции не идут, если ЕА = 40-120 кДж/моль – реакции протекают в обычных условиях. Повышение температуры снижает энергию активации, делает вещества более реакционно-способными, скорость взаимодействия при этом увеличивается.
Более точную зависимость скорости химической реакции от температуры установил C.Аррениус: константа скорости реакции пропорциональна основанию натурального логарифма, возведенного в степень ( –ЕА/RT). ,
А – предэкспоненциальный множитель, определяет число активных
е – экспонента (основание натурального логарифма).
Логарифмируя выражение , получим уравнение:
. Уравнение Аррениуса показывает, что скорость реакции тем выше, чем меньше энергия активации. Для снижения энергии активации используют катализаторы.
Источник