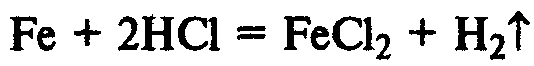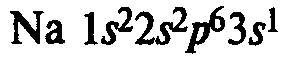- Скорость химических реакций. Зависимость скорости химических реакций от природы реагирующих веществ, концентрации, температуры, катализатора
- Билет №8.
- Билет №9.
- Понятие скорости химической реакции
- Факторы, влияющие на скорость химической реакции
- 2.1 Зависимость скорости реакции от природы реагирующих веществ
Скорость химических реакций. Зависимость скорости химических реакций от природы реагирующих веществ, концентрации, температуры, катализатора
Скорость реакции – это число частиц образованных за единицу времени в единице объема.
Скорость химической реакции равна изменению количества вещества в единицу времени в единице реакционного пространства. Гомогенная реакция протекает в одной фазе. Гетерогенные реакции протекают на границе раздела фаз. [моль*м-3/с] не учитывая газы.
Все реакции можно подразделить на простые и сложные. Простые реакции протекают в одну стадию и называется одностадийными. Сложные реакции идут либо последовательно (многостадийные реакции), либо параллельно, либо последовательно-параллельно. В свою очередь, в каждой стадии реакции может участвовать одна молекула (мономолекулярные реакции), две молекулы (бимолекулярные) и три молекулы (тримолекулярные). Число молекул реагента, принимающих участие в простейшей (элементарной) стадии, называется её молекулярностью.
Порядок реакции — это сумма порядков реакции по реагентам.
Порядок реакции определяется суммой величин показателей степени при значениях концентраций исходных веществ в кинетическом уравнении:
Поэтому обе реакции первого порядка.
Молекулярность реакции определяется числом молекул, одновременным взаимодействием которых осуществляется акт химического взаимодействия. Реакция а) одномолекулярная, б) двухмолекулярная.
Выражение для определения скорости реакции первого порядка
Скорость реакции второго порядка для двух реагентов В и D подчиняется кинетическому уравнению
где С В – концентрация реагента В, а С D – концентрация реагента D.
Наиболее часто встречаются реакции первого и второго порядка. Реакции третьего порядка крайне редки. Реакции более высокого порядка, чем третий, неизвестны, так как в большинстве случаев реакции многостадийны.
Правило Вант-Гоффа. V2 = V1×gDT/ 10
Повышение температуры ускоряет большинство реакций. Согласно правилу Вант-Гоффа при увеличении температуры на 10 К скорость многих реакций увеличивается в 2-4 раза V2 = V1×gDT/ 10
Где V2 и V1 – скорость реакции при температурах Т2 и Т1, γ – коэффициент, значение которого для эндотермической реакции выше, чем для экзотермической реакции. Для многих реакций γ лежит в пределах 2- 4.
Скорость химических реакций зависит:
1. Природа реагирующих веществ
б) 2K+2H2O=2KOH+H2 Скорость реакции» б» больше чем «а», так как калий активнее натрия.
2. Концентрация. Чем выше концентрация, тем больше скорость реакции, Эта зависимость выражается законом действующих масс.
Например, сера горит в чистом кислороде и на воздухе. СКОРОСТЬ ГОРЕНИЯ СЕРЫ В КИСЛОРОДЕ В 5 раз больше, чем на воздухе.
Химические реакции, протекающие в гомогенных системах (смеси газов, жидкие растворы), осуществляется за счет соударения частиц. Однако, не всякое столкновение частиц реагентов ведет к образованию продуктов. Только частицы, обладающие повышенной энергией — активные частицы, способны осуществить акт химической реакции. С повышением температуры увеличивается кинетическая энергия частиц и число активных частиц возрастает, следовательно,
| химические реакции при высоких температурах протекают быстрее, чем при низких температурах |
Возрастание химические реакции при высоких температурах протекают быстрее, чем при низких температурах скорости реакции при нагревании в первом приближении подчиняется следующему правилу:
| при повышении температуры на 10 0С скорость химической реакции возрастает в два — четыре раза. |
3. Катализатор — вещество, изменяющее скорость реакции. Он может как увеличивать скорость реакции так и уменьшать (такой катализатор называется ингибитором).
Понравилась статья? Добавь ее в закладку (CTRL+D) и не забудь поделиться с друзьями:
Источник
Билет №8.
Скорость химических реакций. Факторы, влияющие на скорость химической реакции (зависимость скорости от природы, концентрации вещества, площади поверхности соприкосновения реагирующих веществ, температуры, катализатора).
Скоростью химической реакции называется изменение количества вещества за единицу времени в единице объема.
Скорость реакции зависит от природы реагирующих веществ.
При реакции металлов с соляной кислотой, чем левее расположен металл в раду напряжений, тем быстрее протекает реакция, а металлы, находящиеся правее водорода, не реагируют вообще:
Скорость реакции увеличивается при увеличении концентрации реагирующих веществ.
Горение веществ в чистом кислороде происходит быстрее, чем в воздухе, содержание кислорода в котором составляет 21%:
Скорость реакции увеличивается при увеличении поверхности соприкосновения реагирующих веществ.
Железные опилки быстрее реагируют с соляной кислотой, чем железные гвозди:
Скорость реакции увеличивается с увеличением темпера-
Железо при обычной температуре реагирует с хлором очень медленно, при высокой же температуре протекает бурная реакция (железо горит в хлоре):
Водород восстанавливает оксиды металлов при нагревании, при комнатной температуре эта реакция не идет, то есть ее скорость равна 0:
Скорость многих реакций увеличивается в присутствии специальных веществ — катализаторов.
Катализаторы увеличивают скорость реакции, но по окончании реакции остаются неизменными.
Примеры каталитических реакций:
(реакция сильно ускоряется в присутствии МnО2).
(реакция протекает только в присутствии катализаторов — платины, оксида ванадия (V), железа и др).
Билет №9.
Общая характеристика металлов главных подгрупп I – III групп (I-A – III-A групп) в связи с их положением в периодической системе химических элементов Д. И. Менделеева и особенности строение их атомов, металлическая химическая связь, химические свойства металлов как восстановителей.
В периодической системе элементов металлы в основном располагаются в главных подгруппах I—Ill групп, а также в побочных подгруппах.
В IA группе у атомов элементов на внешнем энергетическом уровне находится 1 электрон в состоянии s 1 , во IIA группе у атомов на внешнем ЭУ 2 электрона в состоянии s 2 . Эти элементы относятся к s-элементам. В IIIA группе у всех элементов на внешнем ЭУ 3 электрона в состоянии s 2 p 1 . Они относятся к p-элементам.
В IA группу входят щелочные металлы Li, Na, K, Rb, Cs, Fr, активность которых при движении сверху вниз увеличивается вследствие увеличения радиуса атомов, металлические свойства возрастают также, как и у щелочеземельных металлов IIA группы Be, Mg, Ca, Sr, Ba, Ra и металлов IIIA группы Al, Ga, In, Tl.
Оксиды типа R2O характерны только для Li, для всех остальных щелочных металлов характерны пероксиды R2O2, которые являются сильными окислителями.
Все металлы этих групп образуют основные оксиды и гидроксиды, кроме Be и Al, которые проявляют амфотерные свойства.
Химические свойства. Атомы металлов имеют больший радиус, чем атомы неметаллов, поэтому легко теряют валентные электроны. Вследствие этого металлы проявляют восстановительные свойства.
Источник
Понятие скорости химической реакции
Механизм химических реакций сводится к разрыву связей в исходных веществах и возникновению новых связей в продуктах реакций. При этом общее число атомов каждого элемента до и после реакции остается постоянным.
Реакции могут быть гомогенными и гетерогенными. Гомогенные реакции протекают в однородной среде (например, в газовой фазе или жидком растворе). Гетерогенные реакции протекают в неоднородной среде – между веществами, которые находятся в разных фазах (например, в твердой и жидкой или газовой и жидкой и т.д.). Гомогенные реакции происходят равномерно во всем объеме, заполненном реагентами. Гетерогенные – происходят на границе раздела фаз. Примером гетерогенной реакции может служить реакции между веществом в газовой фазе и поверхностью жидкого или твердого тела.
Скоростью химической реакции называется число элементарных актов реакции, происходящих в единицу времени в единице объема (для гомогенных реакций) или на единице поверхности раздела фаз (в случае гетерогенных реакций)
Скорость химической реакции обычно характеризует изменение концентрации одного из реагирующих веществ в единицу времени.
При этом безразлично, о каком из участвующих в реакции веществе идет речь: все они связаны между собой уравнением реакции.
Обычно концентрацию выражают в [моль/л], а время — в секундах (с), поэтому размерность скорости реакции равна [моль/л • с].
Рассмотрим реакцию взаимодействия водорода с парами хлора:
Обозначим концентрацию паров хлора в начале некоторого отрезка времени t1 через С1, а при t2 – С2 . Так, хлор в процессе реакции расходуется, следовательно, С1> С2. Скорость реакции V может быть найдена из равенства
По мере расходования исходных веществ, скорость реакции уменьшается (рис. 1).
Рисунок 1- Изменение концентрации реагирующего вещества во времени
В ходе химических процессов концентрации веществ меняются непрерывно. Поэтому важно знать величину скорости реакции в данный момент времени, т.е. мгновенную скорость, которая выражается производной от концентрации во времени:
Мгновенная (истинная) скорость – это скорость реакции в конкретный момент времени.
где: t – это время от начала химической реакции до момента появления видимых изменений (изменение окраски раствора, появление газа, осадка).
Факторы, влияющие на скорость химической реакции
Скорость реакции зависит от природы реагирующих веществ, их концентрации и внешних условий (например, температуры, давления, катализаторов).
2.1 Зависимость скорости реакции от природы реагирующих веществ
В зависимости от природы реагирующих веществ реакции могут протекать как очень медленно (некоторые реакции между органическими веществами, многие реакции с участием твердых веществ, как, например, коррозия металлов), так и очень быстро (ионные реакции в растворах). В
промежуточном случае, скорость реакции может быть такой, что ее нетрудно измерять в ходе короткого опыта.
Зависимость скорости реакции от природы веществ очень сложна, она связана с их составом и строением. Химический процесс всегда представляет собой некоторую перегруппировку атомов, т. е. их обмен местами, разъединение или, наоборот, объединение отдельных атомов или молекул в более сложные. Совершенно естественно, что подобные процессы могут развертываться лишь при достаточно тесном сближении молекул реагентов или, как часто выражаются, при их столкновении.
Источник