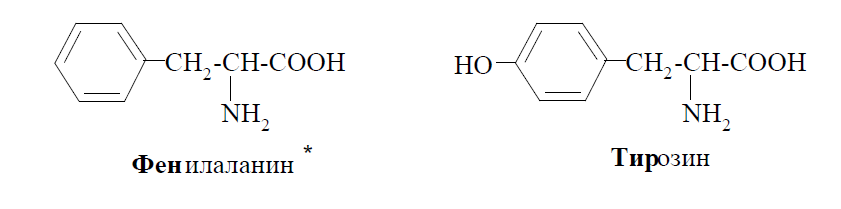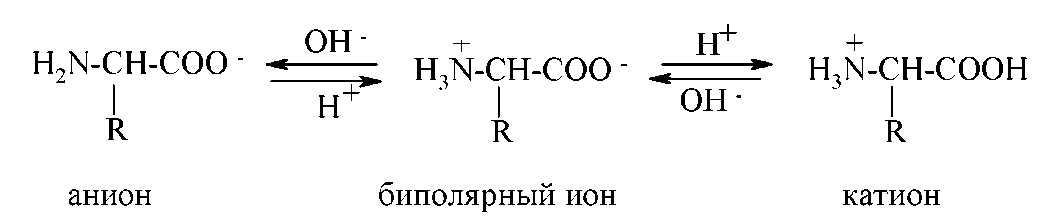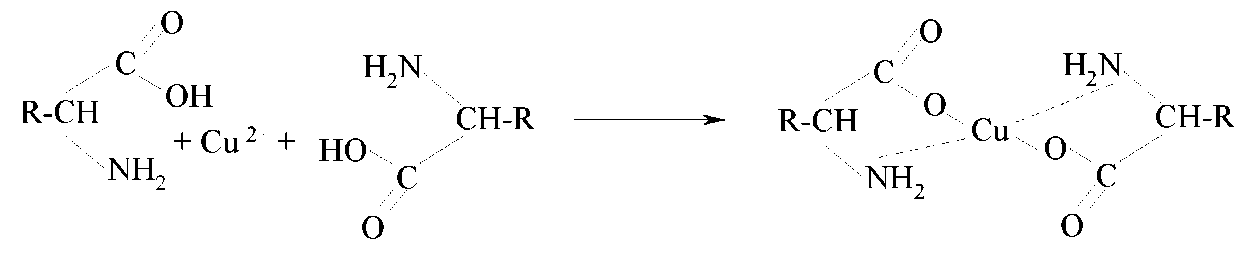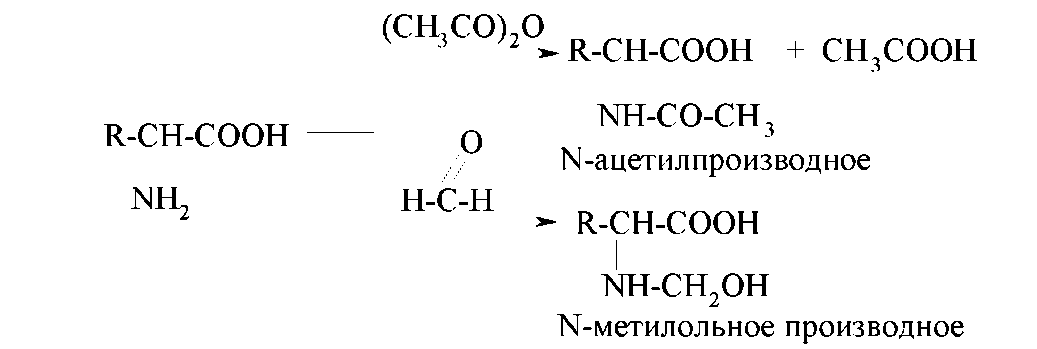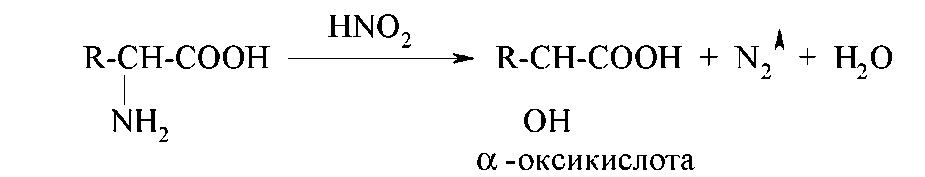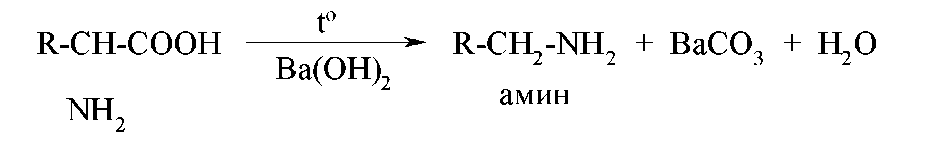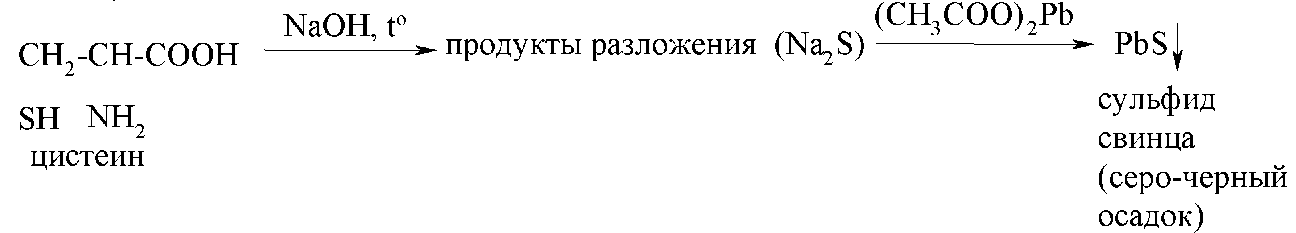- Лекция №2-4 природные α-аминокислоты. Строение классификация стереоизомерия химические свойства
- Аминокислоты
- Номенклатура аминокислот
- Физические свойства аминокислот
- Получение аминокислот
- Химические свойства аминокислот
- 1.1. Взаимодействие с металлами и щелочами
- 1.2. Взаимодействие с кислотами
- 2. Взаимодействие с азотистой кислотой
- 3. Взаимодействие с аминами
- 4. Этерификация
- 5. Декарбоксилирование
- 6. Межмолекулярное взаимодействие аминокислот
Лекция №2-4 природные α-аминокислоты. Строение классификация стереоизомерия химические свойства
α-Аминокислоты являются мономерными единицами биополимеров — пептидов и белков. Белки — основа всего живого. Функции белков в природе многообразны. Это ферменты и гормоны, выполняющие регуляторную функцию, структурные белки (кератин, коллаген), транспортные (гемоглобин), защитные (иммуноглобулины). Некоторые аминокислоты используются как лекарственные средства, например, глутаминовая кислота — при заболеваниях ЦНС, метионин — для лечения заболеваний печени, цистеин — как радиопротектор, а также в глазной практике.
В природе в свободном и связанном виде обнаружены сотни аминокислот, 20-25 из них постоянно встречаются во всех белках.
Строение и классификация природных α-аминокислот
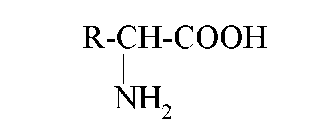
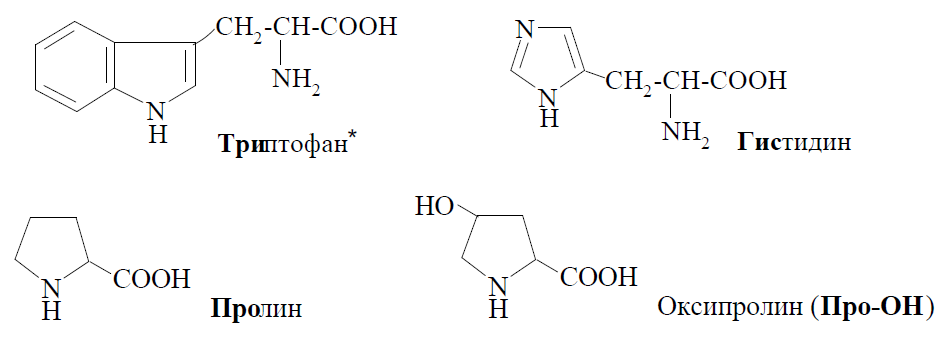
Общая формула α-аминокислот (исключение — пролин и оксипролин):
В основном используют тривиальные названия α- аминокислот. В биохимии часто пользуются сокращенными трехбуквенными названиями.
Согласно общей формуле, аминокислоты отличаются лишь строением радикала, в соответствии с чем они классифицируются на алифатические, ароматические и гетероциклические. Среди алифатических аминокислот в зависимости от наличия в радикале функциональной группы выделяют подгруппы гидрокси- и серосодержащих аминокислот.
Примеры алифатических аминокислот:
Примерами ароматических аминокислот являются фенилаланин и тирозин:
К гетероциклическим аминокислотам относятся:
В зависимости от соотношения количества карбоксильных и аминогрупп в молекулах различают нейтральные (моноаминомонокарбоновые) — глицин, аланин и др., кислые (моноаминодикарбоновые) — аспарагиновая, глютаминовая кислоты, основные (диаминомонокарбоновые) аминокислоты — лизин, орнитин, аргинин.
Природа радикала в молекулах аминокислот значительно влияет на свойства белков. Например, наличие полярных групп (-SH, NH2, -OH, COOH, фенольного гидроксила) увеличивает растворимость белков. Кроме того, эти группы принимают участие в образовании связей, формирующих пространственную структуру белка. За счет карбоксильной и аминогруппы многие ферменты обеспечивают кислотный или основный катализ ряда биохимических процессов. Большинство α-аминокислот синтезируется в организме, но некоторые организм не способен синтезировать, они должны поступать с пищей. Эти аминокислоты называют незаменимыми, в норме их восемь: валин, лейцин, изолейцин, треонин, метионин, фенилаланин, триптофан, лизин.
Стереоизомерия α-аминокислот
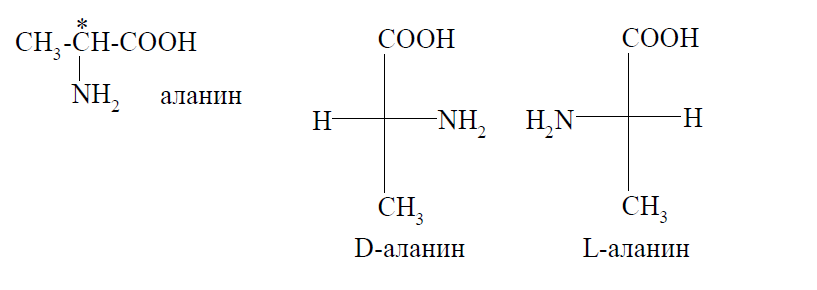
Все α-аминокислоты, за исключением глицина, имеют в своей структуре хотя бы один хиральный центр, значит, для них характерна оптическая изомерия. Например, аланин существует в виде пары энантиомеров:
Относительная конфигурация стереоизомеров определяется в сравнении с конфигурационным стандартом — стереоизомерами глицеринового альдегида.
Все α-аминокислоты, участвующие в построении молекул белков животных и человека, имеют L-конфигурацию. D-аминокислоты встречаются в некоторых грибах и микроорганизмах.
α-Аминокислоты представляют собой кристаллические вещества с высокой температурой плавления, растворимые в воде, но не растворимые в неполярных растворителях. Эти свойства результат того, что и в кристаллическом состоянии, и в водных растворах аминокислоты существуют в виде биполярных ионов (цвиттер-ионов). Возможность образования биполярных ионов связана с амфотерностью аминокислот, в молекулах которых присутствуют и кислотные COOH-группы, и основные NH2-группы. Близость этих групп у α-аминокислот облегчает переход протона от карбокисльонй группы.
Практически α-аминокислоты в водном растворе существуют в виде равновесной смеси из цвиттер-ионов, катионной и анионной форм:
Положение такого равновесия существенно зависит от pH среды: в сильнокислой среде (pH=1-2) преобладает катионная форма, в сильнощелочной (pH=13-14) — анионная.
Если поместить раствор аминокислоты в электрическое поле, то в кислых растворах она будет мигрировать к катоду, а в щелочных — к аноду. При некотором значении pH, характерном для данной аминокислоты, она не будет перемещаться в электрическом поле. При этом значении pH, называемом изоэлектрической точкой (ИЭТ, pI), аминокислота существует в виде биполярного иона и в целом электронейтральна. Итак, изоэлектрическая точка аминокислоты — это то значение pH раствора, при котором большинство молекул данной аминокислоты существуют в виде биполярных ионов, а концентрации анионной и катионной форм минимальны и равны. Изоэлектрическая точка зависит от соотношения кислотных и основных групп в молекуле: pI кислых аминокислот имеет значение 7.
При пропускании электрического тока через раствор, содержащий смесь аминокислот, каждая из них будет двигаться к катоду или аноду со скоростью, зависящей от природы аминокислоты и pH среды. Это явление используют для разделения и анализа смеси аминокислот методом электрофореза.
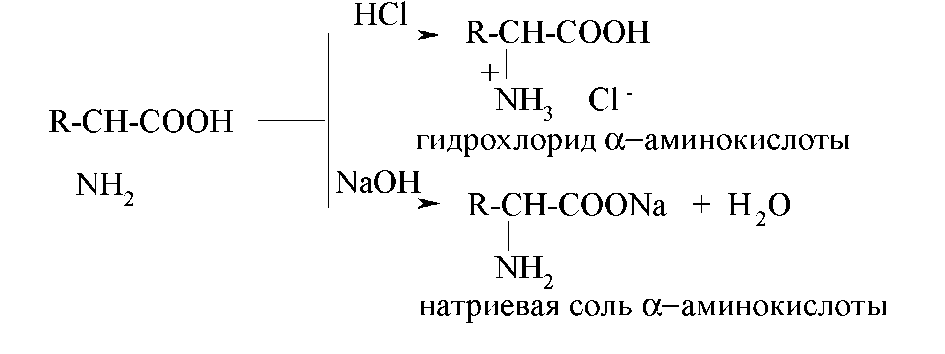
Химические свойства Являясь амфотерными соединениями, аминокислоты реагируют и с кислотами, и с щелочами:
Характерной особенностью α-аминокислот является способность образовывать комплексные соли с ионами тяжелых металлов:
Медные соли аминокислот нерастворимы в воде, имеют интенсивное синее окрашивание. Эта реакция используется для обнаружения α-аминокислот.
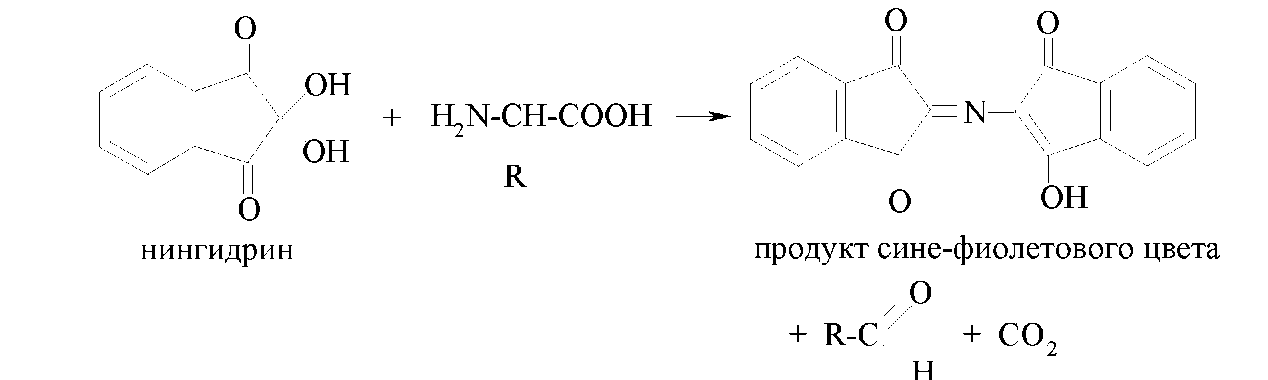
Другой общей качественной реакцией α-аминокислот является их взаимодействие с нингидрином с образованием продукта сине-фиолетового цвета:
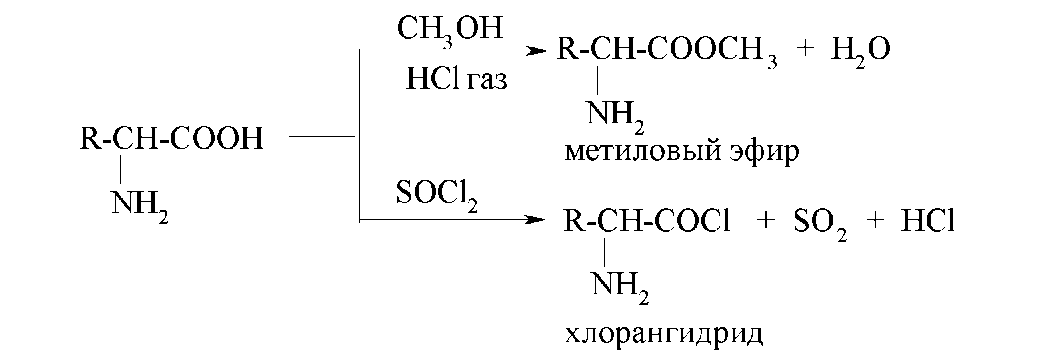
Как карбоновые кислоты, α-аминокислоты образуют сложные эфиры при взаимодействии со спиртами и хлорангидриды при взаимодействии с тионилхлоридом или хлоридами фосфора:
Сложные эфиры α-аминокислот летучи, они имеют сравнительно низкие температуры кипения. Это их свойство используется для разделения смеси аминокислот в белковых гидролизатах (эфирный метод Фишера). С этой целью аминокислоты сначала этерифицируют, а потом подвергают перегонке.
За счет аминогруппы α-аминокислоты подвергаются реакциям ацилирования и алкилирования, взаимодействуют с оксо- соединениями. Так, при ацилировании аминокислоты уксусным ангидридом образуется N-ацетильное производное. При взаимодействии с формальдегидом образуется продукт нуклеофильного присоединения — N-метилольное производное, которое достаточно устойчиво (с другими оксосоединениями протекает реакция нуклеофильного присоединения-отщепления).
Реакцию ацилирования раньше использовали для защиты аминогруппы в синтезе пептидов. Реакция с формальдегидом лежит в основе метода количественного анализа аминокислот (метод формольного титрования, метод Зеренсена). Сущность метода формольного титрования заключается в следующем: до взаимодействия с формальдегидом растворы большинства аминокислот имеют реакцию, близкую к нейтральной; N-метилольное производное проявляет кислотные свойства и может быть оттитровано раствором щелочи с известной концентрацией.
Как первичные алифатические амины α-аминокислоты подвергаются действию азотистой кислоты с образованием соответствующих α-оксикислот и выделением азота:
Эту реакцию называют реакцией дезаминирования in vitro. Ее используют и как качественную реакцию для доказательства наличия первичной алифатической аминогруппы (наблюдают выделение пузырьков газа), и для количественного анализа (метод Ван-Слайка) — по объему выделившегося азота рассчитывают количество аминокислоты, вступившей в реакцию.
Специфическим свойством α-аминокислот является их способность к декарбоксилированию при нагревании в присутствии гидроксида бария:
Рассмотренные выше реакции характерны для всех α- аминокислот.
Существуют также реакции на определенные группы аминокислот.
Серосодержащие аминокислоты (цистеин цистин, метионин) обнаруживают по реакции с ацетатом свинца (реакция Фоля).
При нагревании с щелочью серосодержащие аминокислоты разлагаются, одним из продуктов разложения является сульфид натрия. При дальнейшем добавлении ацетата свинца образуется осадок сульфида свинца серо-черного цвета.
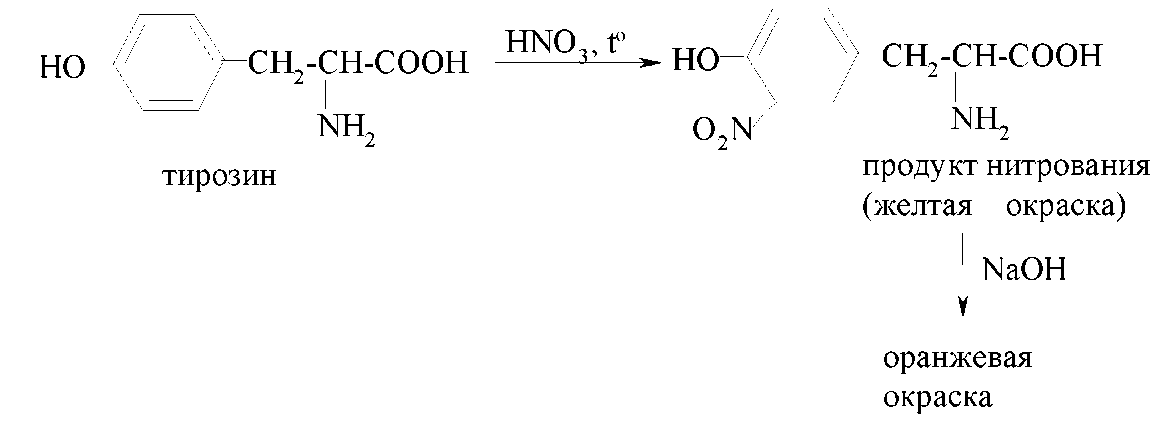
Для обнаружения ароматических аминокислот используют так называемую ксантопротеиновую реакцию. При нагревании этих аминокислот (или белков, в структуре которых присутствуют их остатки) с концентрированной азотной кислотой образуются продукты нитрования желтого цвета, которые в щелочной среде приобретают оранжевую окраску:
Источник
Аминокислоты
Природные аминокислоты можно разделить на следующие основные группы:
Номенклатура аминокислот
- Для природных α-аминокислот R-CH(NH2)COOH применяются тривиальные названия: глицин, аланин, серин и т. д.
- По систематической номенклатуре названия аминокислот образуются из названий соответствующих кислот прибавлением приставки амино- и указанием места расположения аминогруппы по отношению к карбоксильной группе:
| 2 – Аминобутановая кислота | 3-Аминобутановая кислота |
 |  |
- Часто используется также другой способ построения названий аминокислот, согласно которому к тривиальному названию карбоновой кислоты добавляется приставка амино- с указанием положения аминогруппы буквой греческого алфавита.
| α-Аминомасляная кислота | β-Аминомасляная кислота |
 |  |
Физические свойства аминокислот
Аминокислоты – твердые кристаллические вещества с высокой температурой плавления. Хорошо растворимы в воде, водные растворы хорошо проводят электрический ток.
Получение аминокислот
- Замещение галогена на аминогруппу в соответствующих галогензамещенных кислотах:
- Восстановление нитрозамещенных карбоновых кислот (применяется для получения ароматических аминокислот):
Химические свойства аминокислот
| При растворении аминокислот в воде карбоксильная группа отщепляет ион водорода, который может присоединиться к аминогруппе. При этом образуется внутренняя соль, молекула которой представляет собой биполярный ион: |
1. Кислотно-основные свойства аминокислот
| Аминокислоты — это амфотерные соединения. |
Они содержат в составе молекулы две функциональные группы противоположного характера: аминогруппу с основными свойствами и карбоксильную группу с кислотными свойствами.
| Водные растворы аминокислот имеют нейтральную, щелочную или кислую среду в зависимости от количества функциональных групп. |
Так, глутаминовая кислота образует кислый раствор (две группы -СООН, одна -NH2), лизин — щелочной (одна группа -СООН, две -NH2).
1.1. Взаимодействие с металлами и щелочами
Как кислоты (по карбоксильной группе), аминокислоты могут реагировать с металлами, щелочами, образуя соли:
1.2. Взаимодействие с кислотами
По аминогруппе аминокислоты реагируют с кислотами:
2. Взаимодействие с азотистой кислотой
Аминокислоты способны реагировать с азотистой кислотой.
| Например, глицин взаимодействует с азотистой кислотой: |
3. Взаимодействие с аминами
Аминокислоты способны реагировать с аминами, образуя соли или амиды.
4. Этерификация
Аминокислоты могут реагировать со спиртами в присутствии газообразного хлороводорода, превращаясь в сложный эфир:
| Например, глицин взаимодействует с этиловым спиртом: |
5. Декарбоксилирование
Протекает при нагревании аминокислот с щелочами или при нагревании.
| Например, глицин взаимодействует с гидроксидом бария при нагревании: |
| Например, глицин разлагается при нагревании: |
6. Межмолекулярное взаимодействие аминокислот
При взаимодействии аминокислот образуются пептиды. При взаимодействии двух α-аминокислот образуется дипептид.
| Например, г лицин реагирует с аланином с образованием дипептида (глицилаланин): |
Фрагменты молекул аминокислот, образующие пептидную цепь, называются аминокислотными остатками, а связь CO–NH — пептидной связью.
Источник