Общие сведения о воде
В природе нет абсолютно, нерастворимых веществ. Все они в той или иной степе ни подвергаются воздействию воды, отличаясь, друг от друга только количеством переходящего в раствор вещества. Даже, казалось бы, столь неизменяемые горные породы, как гранит, диабаз, базальт, — и те постепенно разрушаются водой, обогащая ее растворимыми веществами. Поэтому в естественном состоянии вода всюду представляет собой сложный раствор различных веществ, который принято называть природной водой в отличие от химически чистой воды Н2О.
Сложность веществ, находящихся в природе, отражается на составе природных вод. Соприкасаясь в своём круговороте с огромным числом, разно образных минералов, газов и органических веществ, природная вода включает в свой состав значительное число химических соединений. В настоящее время опpe делено уже большинство химических элементов периодической системы, находящихся в природной воде. Нет сомнений, что при дальнейшем усовершенствовании чувствительности методов химического анализа в природных водах будут определены все присутствующие на Земле в естественном состоянии химические элементы.
Природные воды по химическому составу чрезвычайно разнообразны. Встречаются более или менее сходные по составу воды, но никогда не бывает совершенно одинаковых. Они отличаются не только по химическим элементам и общей концентрации растворенных веществ, но и по количественному соотношению между компонентами состава и форме их соединений. В состав воды входят газы, главным образом в виде молекул и частично гидратированных соединений, соли, преимущественно в виде ионов, а при больших концентрациях комплексов и молекул — органические вещества как в молекулярных и высокомолекулярных соединениях, так и в коллоидном состоянии. Сложность состава природных вод подтверждается, хотя бы тем, что один и тот же элемент может находиться в воде в различных соединениях и состояниях.
Так, например, азот находится в воде в виде растворенных свободных молекул N2, растворенных газообразных соединений NН3, ионов неорганических веществ NO2 и NО3, а также многочисленных органических веществ в молекуляр ном и коллоидном состоянии.
Таким образом, под химическим составом природных вод надо понимать весь сложный комплекс минеральных и органических веществ, находя щихся в разных формах ионно-молекулярного и коллоидного состояния.
С некоторой условностью химический состав природных вод можно разделить на следующие пять групп: 1) главные ионы, т. е. ионы, содержащиеся в наибольшем количестве (хлоридные Сl — , сульфатные SO4 — , гидрокарбонатные НСОз — , карбонатные СО3 — , натрия Na + ; калия К + , магния Mg 2+ и кальция Са 2+ ); 2) растворенные газы (кислород О2, азот N2, двуокись углерода СО2, сероводород H2S и др.); 3) биогенные элементы (соединения азота, фосфора, кремния); 4) микроэлементы — соединения всех остальных химических элементов;
Несколько особое положение занимают ионы водорода Н + , находящиеся в природных водах в очень небольшом количестве, но играющие очень большую роль в химических и биологических процессах, протекающих в природных водах.
Деление на эти группы в известной мере условно, так как некоторые элементы, например, кальций, калий, также усваиваются и необходимы организ мам, как и биогенные элементы, а концентрации биогенных элементов часто бывают еще меньше, чем микроэлементов.
Некоторая условность создается и в результате определения путём анализа суммарной концентрации нескольких видов ионов, близких по химичес ким свойствам и поэтому аналитически трудно разделяемых, например, фосфора с мышьяком, кальция с барием и стронцием, хлора с бромом и йодом. Разумеется, существуют аналитические методы и раздельного определения указанных сход ных по свойствам элементов. Однако такое определение элементов отнимает много времени и труда и в большинстве случаев ограничивается только суммар ной концентрацией с пересчетом ее на главный определяемый элемент, напри мер, сумму галогенов на хлоридный ион, сумму щелочноземельных, металлов на кальций и сумму щелочных металлов на натрий.
Кроме перечисленных компонентов, состав — природной воды обладает качественными характеристиками. Таковы: жесткость, щелочность, окисля емость, агрессивность. Эти свойства обусловлены не одним, а совокупностью нескольких компонентов состава воды.
В химии широко распространен еще термин минерализация воды, под которым понимают сумму всех найденных при анализе минеральных веществ в мг/л или г/кг (при сумме больше одного г/кг), содержащихся в данной воде. Эта количественная характеристика состава воды носит условный характер, так как полнота анализа вод может быть различна, так же как и форма выражения его результатов (особенно для тяжелых металлов). В океанологической практике вместо минерализации употребляется термин соленость.
Кроме минерализации, существует ещё близкое к ней по величине понятие сумма ионов, т. е. сумма всех видов ионов в мг/л или г/кг, концентрация которых больше 0, 1 мг/л. ( 2 ).
Источник
Химический состав природных вод
1.1. Основные этапы формирования химического состава природных вод
Процесс формирования химического состава природных вод осуществляется в несколько этапов, на каждом из которых определяющую роль играют различные факторы. Первым этапом формирования поверхностных вод является взаимодействие их с атмосферой. Еще находясь в атмосфере, мельчайшие капли воды при своем падении на Землю увлекают из воздуха различные вещества. Источником минерального состава атмосферных осадков являются вулканические выбросы, оксиды азота, образующиеся при грозовых разрядах, а также антропогенное загрязнение воздуха, обусловленное промышленными выбросами и работой автотранспорта. В состав атмосферных осадков входят и радиоактивные загрязнения, и пестициды. Общее количество веществ, растворенных и взвешенных в дождевой воде, колеблется в пределах 10 – 20 мг/дм 3 . Это, прежде всего, газы – азот, кислород, диоксид углерода, оксиды азота и серы, ионы солей (SO4 2– ,Cl – , HCO3 – ,NO3 – ,NH4 + ,Ca 2+ ,Mg 2+ ,Na + ). Кроме того, дождевые воды содержат микроорганизмы и пыль в виде механических примесей. Вторымэтапом формирования состава природных вод является взаимодействие выпавших атмосферных осадков с почвенным покровом, при этом важную роль играет наличие растительности и ее характер. Приобретаемый при соприкосновении с почвой химический состав воды зависит от характера почвы. Вода, фильтруясь через почву, выщелачивает ее растворимые части, изменяя при этом свой состав: увеличивается содержание ионов и органических веществ, изменяется содержание растворенных газов. При взаимодействии воды с почвой содержание кислорода в воде уменьшается, а оксида углерода (IV) увеличивается, что объясняется окислением органических веществ. Наряду с растворением солей наблюдаются явления адсорбции и ионного обмена. Если вода фильтруется через бедные солями торфянисто-тундровые или болотные почвы, то она обогащается большим количеством органических веществ и лишь незначительно — ионами. Больше обогащают ионами воду черноземные и каштановые почвы, еще больше солонцеватые. Значительной ионообменной способностью обладают многие почвы, в особенности чернозем и торф, что связано с наличием в них гуминовых кислот. Третьими основным этапом формирования химического состава природных вод является их взаимодействие с минералами литосферы. Породы, слагающие земную кору, могут обогащать природные воды солями в результате выветривания изверженных и образовавшихся из них обломочных пород и растворения солей, находящихся в осадочных породах. Основная часть минералов, образовавшихся в глубинных слоях Земли, попав в условия биосферы, начинает постепенно изменяться и разрушаться. Это разрушение называют выветриванием. В зависимости от того, какому агенту принадлежит ведущая роль в разрушении горных пород, различают:
- физическое выветривание;
- химическое выветривание;
- биологическое выветривание.
Обычно они происходят одновременно. Химическое выветривание горных пород происходит под действием воды и воздуха в результате различных химических реакций, прежде всего гидролиза, гидратации, ионного обмена, окисления, карбонатизации и обычного химического растворения. Для минерализации воды особое значение имеет выветривание различных алюмосиликатов, которые разлагаются, главным образом при гидролизе. Так, гидролиз обычного полевого шпата (ортоклаза) приводит к образованию нового силиката – каолина, составляющего основу различных глин: 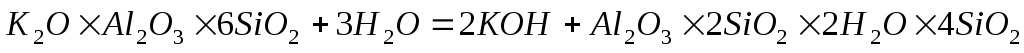
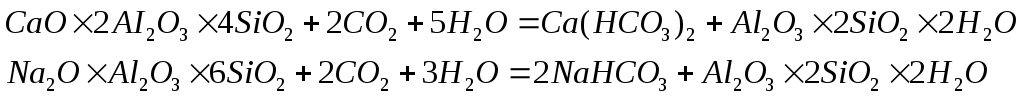
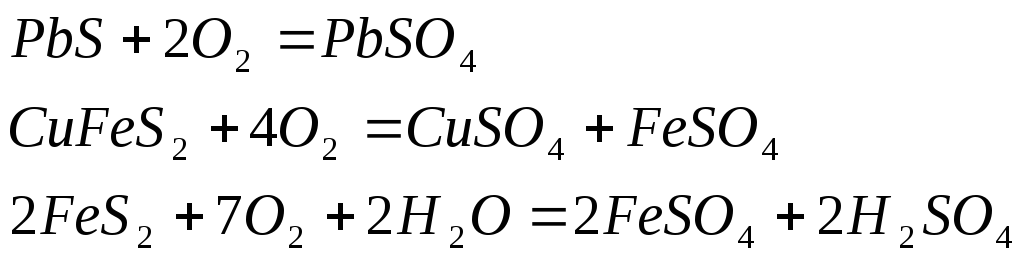

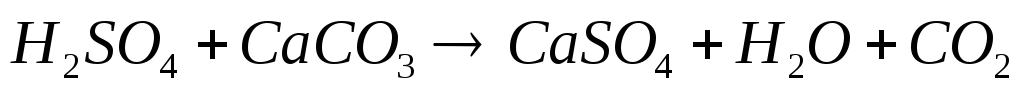
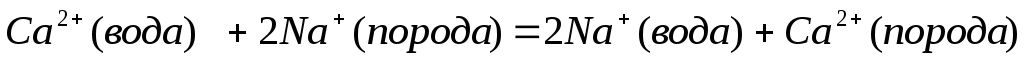
Для продолжения скачивания необходимо пройти капчу:
Источник