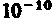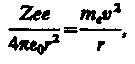Г лава 27 Теория атома водорода по Бору
Представление об атомах как неделимых мельчайших частицах вещества («атомос» — неразложимый) возникло еще в античные времена (Демокрит, Эпикур, Лукреций). В средние века, во времена безграничного господства церкви, учение об атомах, будучи материалистическим, естественно, не могло получить признания, а тем более дальнейшего развития. К началу XVIII в. атомистическая теория приобретает все большую популярность, так как к этому времени в работах А. Лавуазье (1743—1794, французский химик), М. В. Ломоносова и Д. Дальтона была доказана реальность существования атомов. Однако в это время вопрос о внутреннем строении атомов даже не возникал, так как атомы по-прежнему считались неделимыми.
Большую роль в развитии атомистической теории сыграл Д. И. Менделеев, разработавший в 1869 г. Периодическую систему элементов, в которой впервые на научной основе был поставлен вопрос о единой природе атомов. Во второй половине XIX в. экспериментально было доказано, что электрон является одной из основных составных, частей любого вещества. Эти выводы, а также многочисленные экспериментальные данные привели к тому, что в начале XX в. серьезно встал вопрос о строении атома.
Первая попытка создания на основе накопленных экспериментальных данных модели атома принадлежит Дж. Дж. Томсону (1903). Согласно этой модели, атом представляет собой непрерывно заряженный положительным зарядом шар радиусом порядка 10 -10 м, внутри которого около своих положений равновесия колеблются электроны; суммарный отрицательный заряд электронов равен положительному заряду шара, поэтому атом в целом нейтрален. Через несколько лет было доказано, что представление о непрерывно распределенном внутри атома положительном заряде ошибочно.
В развитии представлений о строении атома велико значение опытов английского физика Э. Резерфорда (1871—1937) по рассеянию а-частиц в веществе. Альфа-частицы возникают при радиоактивных превращениях; они являются положительно заряженными частицами с зарядом 2е и массой, примерно в 7300 раз большей массы электрона. Пучки а-частиц обладают высокой монохроматичностью (для данного превращения имеют практически одну и ту же скорость (порядка 10 7 м/с)).
Резерфорд, исследуя прохождение а-частиц в веществе (через золотую фольгу толщиной примерно 1 мкм), показал, что основная их часть испытывает незначительные отклонения, но некоторые а-частицы (примерно одна из 20 000) резко отклоняются от первоначального направления (углы отклонения достигали даже 180°). Так как электроны не могут существенно изменить движение столь тяжелых и быстрых частиц,
как 
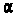
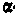
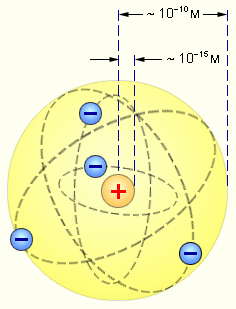
На основании своих исследований Резерфорд в 1911 г. предложил ядерную (плане-тарную) модель атома. Согласно этой модели, вокруг положительного ядра, имеющего заряд Ze(Z — порядковый номер элемента в системе Менделеева, 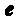
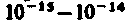
с линейными размерами порядка м по замкнутым орбитам движутся электроны,
образуя электронную оболочку атома. Так как атомы нейтральны, то заряд ядра равен суммарному заряду электронов, т. е. вокруг ядра должно вращаться Z электронов.
Для простоты предположим, что электрон движется вокруг ядра по круговой орбите радиуса r. При этом кулоновская сила взаимодействия между ядром и электроном сообщает электрону центростремительное ускорение. Второй закон Ньютона для электрона, движущегося по окружности под действием кулоновской силы, имеет вид
(208.1)
где 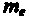
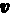
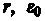
Уравнение (208.1) содержит два неизвестных: г и v. Следовательно, существует бесчисленное множество значений радиуса и соответствующих ему значений скорости (а значит, и энергии), удовлетворяющих этому уравнению. Поэтому величины r, 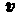
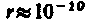
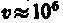
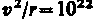
ренно движущиеся электроны должны излучать электромагнитные волны и вследствие этого непрерывно терять энергию. В результате электроны будут приближаться к ядру и в конце концов упадут на него. Таким образом, атом Резерфорда оказывается неустойчивой системой, что опять-таки противоречит действительности.
Попытки построить модель атома в рамках классической физики не привели к успеху: модель Томсона была опровергнута опытами Резерфорда, ядерная же модель оказалась неустойчивой электродинамически и противоречила опытным данным. Преодоление возникших трудностей потребовало создания качественно новой — квантовой — теории атома.
Источник
1. Развитие представлений о строении атома. Модели Томсона и Резерфорда.
Представление об атомах как неделимых («атомос» неделимый) мельчайших частицах вещества возникло еще в античные времена, но только в XVIII веке трудами А. Лавуазье, М. В. Ломоносова и других ученых была доказана реальность существования атомов. Но вопрос об их внутреннем устройстве даже не возникал, и атомы по-прежнему считались неделимыми частицами. В XIX веке изучение атомистического строения вещества существенно продвинулось вперед. В 1833 году при исследовании явления электролиза М. Фарадей установил, что ток в растворе электролита это упорядоченное движение заряженных частиц – ионов. Фарадей определил минимальный заряд иона, который был назван элементарным электрическим зарядом (e = 1,60·10 –19 Кл).
На основании исследований Фарадея можно было сделать вывод о существовании внутри атомов электрических зарядов.
Большую роль в развитии атомистической теории сыграл выдающийся русский химик Д. И. Менделеев, разработавший в 1869 году периодическую систему элементов, в которой впервые был поставлен вопрос о единой природе атомов.
Важным свидетельством сложной структуры атомов явились спектроскопические исследования, которые привели к открытию линейчатых спектров атомов. В начале XIX века были открыты дискретные спектральные линии в излучении атомов водорода в видимой части спектра, и впоследствии были установлены математические закономерности, связывающие длины волн этих линий (И. Бальмер, 1885 г.).
В 1896 году А. Беккерель обнаружил явление испускания атомами невидимых проникающих излучений, названное радиоактивностью. В последующие годы явление радиоактивности изучалось многими учеными (М. Склодовская-Кюри, П. Кюри, Э. Резерфорд и др.). Было обнаружено, что атомы радиоактивных веществ испускают три вида излучений различной физической природы (альфа-, бета- и гамма-лучи). Альфа-лучи оказались потоком ионов гелия. Бета-лучи – потоком электронов, а гамма-лучи – потоком квантов жесткого рентгеновского излучения.
В 1897 году Дж. Томсон открыл электрон и измерил отношение e / m заряда электрона к массе. Опыты Томсона подтвердили вывод о том, что электроны входят в состав атомов.
Таким образом, на основании всех известных к началу XX века экспериментальных фактов можно было сделать вывод о том, что атомы вещества имеют сложное внутреннее строение. Они представляют собой электронейтральные системы, причем носителями отрицательного заряда атомов являются легкие электроны, масса которых составляет лишь малую долю массы атомов. Основная часть массы атомов связана с положительным зарядом.
Рис. 1. Модель атома Дж. Томсона.
Первая попытка создания модели атома на основе накопленных экспериментальных данных принадлежит Дж. Томсону (1903 г.). Он считал, что атом представляет собой электронейтральную систему шарообразной формы радиусом примерно равным 10 –10 м. Положительный заряд атома равномерно распределен по всему объему шара, а отрицательно заряженные электроны находятся внутри него. Через несколько лет в опытах великого английского физика Э. Резерфорда было доказано, что модель Томсона неверна.
Рис. 2. Схема опыта Резерфорда по рассеянию α-частиц. K – свинцовый контейнер с радиоактивным веществом, Э – экран, покрытый сернистым цинком, Ф – золотая фольга, M – микроскоп.
Первые прямые эксперименты по исследованию внутренней структуры атомов были выполнены Э. Резерфордом 1909–1911 годах. Резерфорд применил зондирование атома с помощью α-частиц. Масса α-частиц в 7300 раз больше массы электрона, а положительный заряд равен 2e. Резерфорд использовал α-частицы с кинетической энергией около 5 МэВ (скорость таких частиц велика – порядка 10 7 м/с,).
Рис. 3. Рассеяние α-частицы в атоме Томсона (a) и в атоме Резерфорда (b).
Было обнаружено, что большинство α-частиц проходит через тонкий слой металла, практически не испытывая отклонения. Однако небольшая часть частиц отклоняется на значительные углы, превышающие 30°. Очень редкие α-частицы (приблизительно одна на десять тысяч) испытывали отклонение на углы, близкие к 180°.
Эти результаты были неожиданными даже для Резерфорда и привели его к выводу, что атом почти пустой, и весь его положительный заряд сосредоточен в малом объеме. Эту часть атома Резерфорд назвал атомным ядром. Так возникла ядерная модель атома.
Рис. 4. Планетарная модель атома Резерфорда. Показаны круговые орбиты четырех электронов.
Опыты Резерфорда привели к выводу, что в центре атома находится плотное положительно заряженное ядро, диаметр которого не превышает 10 –14 –10 –15 м. Это ядро занимает только 10 –12 часть полного объема атома, но содержит весь положительный заряд и не менее 99,95 % его массы. Веществу, составляющему ядро атома, следовало приписать колоссальную плотность порядка ρ ≈ 10 15 г/см 3 . Заряд ядра должен быть равен суммарному заряду всех электронов, входящих в состав атома.
Резерфорд предложил планетарную модель атома. Согласно этой модели, в центре атома располагается положительно заряженное ядро, в котором сосредоточена почти вся масса атома. Атом в целом нейтрален. Вокруг ядра, подобно планетам, вращаются под действием кулоновских сил со стороны ядра электроны. Находиться в состоянии покоя электроны не могут, так как они упали бы на ядро. Однако планетарная модель атома оказалась неспособной объяснить факт длительного существования атома, т. е. его устойчивость. По законам классической электродинамики, движущийся с ускорением заряд должен излучать электромагнитные волны, уносящие энергию.



За короткое время (порядка 10 –8 с) все электроны в атоме Резерфорда должны растратить всю свою энергию и упасть на ядро. То, что этого не происходит в устойчивых состояниях атома, показывает, что внутренние процессы в атоме не подчиняются классическим законам.
Простейшим из атомов является водород. Он содержит единственный электрон. Ядром атома является протон – положительно заряженная частица, заряд которой равен по модулю заряду электрона, а масса в 1836 раз превышает массу электрона. Еще в начале XIX века были открыты дискретные спектральные линии в излучении атома водорода в видимой области (линейчатый спектр). Впоследствии закономерности, которым подчиняются длины волн (или частоты) линейчатого спектра, были хорошо изучены количественно (И. Бальмер, Швейцария, 1885 г.). Совокупность спектральных линий атома водорода в видимой части спектра была названа серией Бальмера. Позже аналогичные серии спектральных линий были обнаружены в ультрафиолетовой и инфракрасной частях спектра. В 1890 году И. Ридберг получил эмпирическую формулу для частот спектральных линий:
, т =1, 2, 3, 4, 5, 6; n = m +1, m +2,… (1)
где R = 3,2910 15 с -1 – постоянная Ридберга. Для серии Бальмера в видимом свете m = 2, n = 3, 4, 5, . . Для ультрафиолетовой серии (серия Лаймана) m = 1, n = 2, 3, 4, . . До Бора механизм возникновения линейчатых спектров и смысл целых чисел, входящих в формулы спектральных линий водорода оставались непонятными.
Датский физик Нильс Бор в 1913 г. предпринял смелую попытку объяснить результаты анализа спектра атома водорода. Это была первая попытка построить качественно новую (квантовую) теорию атома.
Источник