Внутренняя энергия и энтальпия системы. Первый закон термодинамики. Тепловой эффект химической реакции
2. Внутренняя энергия и энтальпия системы. Первый закон термодинамики. Тепловой эффект химической реакции.
3. Факторы, определяющие глубину и направленность химических реакций. Понятия об энтропии и энергии Гиббса. Второй и третий законы термодинамики.
4. Термодинамические представления о равновесном состоянии.
Химическая термодинамика изучает энергетические эффекты, сопровождающие химические процессы, зависимость их от условий протекания, вероятность самопроизвольного течения процесса, их направление и пределы.
Термодинамический подход к изучению систем состоит в том, чтобы мысленно изолировать объект исследования от окружающей среды, называемой термодинамической системой.
Система, лишенная возможности обмена веществом или энергией с окружающей средой и имеющая постоянный объём, называется изолированной или замкнутой.
Фаза – это часть системы с одинаковыми физическими и химическими свойствами.
Различают гомогенные и гетерогенные системы.
Гомогенная система – это однородная система, имеющая одну фазу (воздух, любая газовая смесь и т.д.).
Гетерогенная система – это система, имеющая две или более фазы (насыщенный раствор с осадком, уголь в атмосфере воздуха).
Различают фазовые и химические превращения. При химических превращениях изменяется состав и свойства химических соединений. При фазовых превращениях не затрачивается состав и свойства химического вещества (плавление льда, превращение воды в пар и т.д.)
Совокупность термодинамических свойств системы называется её состоянием.
Величины, позволяющие определить состав системы, называются параметрами (состав, концентрация, давление, объём, температура).
Состав системы может быть равновесным и неравновесным.
Равновесное состояние – это такое состояние системы, которое с течением времени самопроизвольно не изменяется (т.е. без каких-либо внешних воздействий на систему её параметры остаются неизменными). Напротив, состав системы будет неравновесным, если параметры её изменяются во времени при отсутствии внешнего воздействия.
Равновесное состояние может быть устойчивым и ограниченным (метостабильное состояние), причём в ограниченном состоянии система стремится занять устойчивое состояние.
Переход термодинамической системы из одного состояния в другое, сопровождающееся изменением параметров системы, называется процессом.
Процесс, при котором термодинамическая система, пройдя через ряд промежуточных состояний, возвращается в исходное состояние, называется круговым процессом или циклом.
В зависимости от того, какие параметры системы при переходе её из одного состояния в другое, остаются постоянными, процессы делятся на:
— изотермические (Т = const),
— изохорические (V = const),
— изобарические (P=const),
— адиабатические (отсутствует теплообмен с окружающей средой).
Параметры системы дают возможность ввести переменные, позволяющие характеризовать состояние системы, следовательно, происходящие в ней изменения. Это термодинамические функции:
внутренняя энергия u,
энтальпия H,
энтропия S,
энергия Гиббса G.
Данные функции являются функциями состояния, т.е. их значения определяются только начальными и конечными параметрами системы и не зависят от пути перехода, по которому протекает процесс.
Внутренняя энергия системы (u) складывается из поступательного и вращательного движения молекул, атомов; энергии движения ядер и электронов, энергии межъядерного и внутриядерного взаимодействия. Изменение внутренней энергии при переходе из одного состояния в другое:
где u2 и u1 – внутренняя энергия системы в конечном и начальном состояниях.
Количественное соотношение между изменением внутренней энергии, теплотой и работой устанавливает первый закон термодинамики: теплота, подведённая к системе Q, расходуется на изменение внутренней энергии системы Δu и на совершение системой работы A против внешних сил:
где p – внешнее давление, V1– объём начального состояния системы, V2 — объём конечного состояния системы.
При изохорическом процессе (V = const, ΔV = 0):
При изобарическом процессе (Р = const):
называется энтальпией системы.
Подставив уравнение (6) в (5), получим первый закон термодинамики для изобарического процесса:
Энтальпия также как и внутренняя энергия характеризует энергетическое состояние вещества, но включает ещё работу на расширение.
Энтальпия является функцией состояния системы, т.е. её значение определяется заданными начальным и конечным состояниями и не зависит от пути перехода. Она выражается в кДж/моль.
Тепловым эффектом химической реакции называется количество тепла (энергии), выделяемое или поглощаемое системой в ходе химической реакции, протекающей необратимо при р,Т = const или V,T = const, т.е. в условиях постоянного объёма или постоянного давления, а получаемые продукты реакции имеют при этом ту же температуру, что и исходные вещества.
При экзотермических реакциях теплота выделяется, т.е. уменьшается энтальпия и внутренняя энергия системы, и значения Δu и ΔH для них отрицательны.
При эндотермических реакциях теплота поглощается, энтальпия и внутренняя энергия системы возрастают, а это значит, что ΔH и Δuимеют положительные значения.
Уравнения химических реакций с указанием теплового эффекта называются термохимическими.
В термохимических уравнениях указываются не только тепловые эффекты реакций, но и агрегатные состояния или кристаллическая модификация веществ.
Термохимическое уравнение реакции образования 1 моль СО2 имеет вид:
В основе термодинамических расчётов лежит закон Г.И. Гесса (1841 г): тепловой эффект химической реакции зависит только от природы и состояния исходных веществ и конечных продуктов, но не зависит от пути процесса, т.е. от числа и характера промежуточных стадий.
В термодинамических расчётах часто применяют следствия из закона Гесса:
1. Тепловой эффект прямой реакции равен тепловому эффекту обратной реакции с противоположным знаком:
2. Тепловой эффект химической реакции Δ Нх.р. равен сумме теплот образования ΔНобр.продуктов реакции за вычетом суммы теплот образования исходных веществ (с учётом коэффициентов перед формулами этих веществ в уравнении реакции):
3. Тепловой эффект химической реакции ΔНх.р.равен сумме теплот сгорания ΔНсгор.исходных веществ за вычетом суммы теплот сгорания продуктов реакции (с учётом коэффициентов перед формулами этих веществ в уравнениях реакции):
Тепловой эффект реакции зависит не только от природы реагирующих веществ, но и от условий, в которых протекает реакция, поэтому все тепловые эффекты приводят к стандартным условиям: 1 моль вещества, температура 25 0 С (298 К), давление 1 атм. (101325 Па).
В термохимических расчётах используют энтальпии (теплоты) образования веществ.
Теплотой образования называется тепловой эффект реакции образования 1 моль вещества из простых веществ, при этом он приведён к стандартным условиям.
Стандартные теплоты образования принято обозначать .
Стандартные теплоты образования простых веществ, устойчивых в стандартных условиях, равны нулю.
Теплота образования одного и того же химического соединения зависит от агрегатного состояния вещества и от его аллотропного видоизменения:
Для реакции вида аА+вВ=сС+dD тепловой эффект определяется равенством:
Источник
2. Внутренняя энергия и энтальпия системы. Первый закон термодинамики. Тепловой эффект химической реакции.
Внутренняя энергия системы (u) складывается из поступательного и вращательного движения молекул, атомов; энергии движения ядер и электронов, энергии межъядерного и внутриядерного взаимодействия. Изменение внутренней энергии при переходе из одного состояния в другое:
где u2 и u1 – внутренняя энергия системы в конечном и начальном состояниях.
Количественное соотношение между изменением внутренней энергии, теплотой и работой устанавливает первый закон термодинамики: теплота, подведённая к системе Q, расходуется на изменение внутренней энергии системы Δu и на совершение системой работы A против внешних сил:
где p – внешнее давление , V1 – объём начального состояния системы, V2 — объём конечного состояния системы.
При изохорическом процессе (V = const, ΔV = 0):
При изобарическом процессе (Р = const):
Термодинамическая функция:
называется энтальпией системы.
Подставив уравнение (6) в (5), получим первый закон термодинамики для изобарического процесса:
Энтальпия также как и внутренняя энергия характеризует энергетическое состояние вещества, но включает ещё работу на расширение.
Энтальпия является функцией состояния системы, т.е. её значение определяется заданными начальным и конечным состояниями и не зависит от пути перехода. Она выражается в кДж/моль.
Тепловым эффектом химической реакции называется количество тепла (энергии), выделяемое или поглощаемое системой в ходе химической реакции, протекающей необратимо при р,Т = const или V,T = const, т.е. в условиях постоянного объёма или постоянного давления, а получаемые продукты реакции имеют при этом ту же температуру, что и исходные вещества.
При экзотермических реакциях теплота выделяется, т.е. уменьшается энтальпия и внутренняя энергия системы, и значения Δu и ΔH для них отрицательны.
При эндотермических реакциях теплота поглощается, энтальпия и внутренняя энергия системы возрастают, а это значит, что ΔH и Δu имеют положительные значения.
Уравнения химических реакций с указанием теплового эффекта называются термохимическими.
В термохимических уравнениях указываются не только тепловые эффекты реакций, но и агрегатные состояния или кристаллическая модификация веществ.
Термохимическое уравнение реакции образования 1 моль СО2 имеет вид:
В основе термодинамических расчётов лежит закон Г.И. Гесса (1841 г): тепловой эффект химической реакции зависит только от природы и состояния исходных веществ и конечных продуктов, но не зависит от пути процесса, т.е. от числа и характера промежуточных стадий.
В термодинамических расчётах часто применяют следствия из закона Гесса:
1. Тепловой эффект прямой реакции равен тепловому эффекту обратной реакции с противоположным знаком:
2. Тепловой эффект химической реакции Δ Нх.р. равен сумме теплот образования ΔНобр. продуктов реакции за вычетом суммы теплот образования исходных веществ (с учётом коэффициентов перед формулами этих веществ в уравнении реакции):
3. Тепловой эффект химической реакции ΔНх.р. равен сумме теплот сгорания ΔНсгор. исходных веществ за вычетом суммы теплот сгорания продуктов реакции (с учётом коэффициентов перед формулами этих веществ в уравнениях реакции):
Тепловой эффект реакции зависит не только от природы реагирующих веществ, но и от условий, в которых протекает реакция, поэтому все тепловые эффекты приводят к стандартным условиям: 1 моль вещества, температура 25 0 С (298 К), давление 1 атм. (101325 Па).
В термохимических расчётах используют энтальпии (теплоты) образования веществ.
Теплотой образования называется тепловой эффект реакции образования 1 моль вещества из простых веществ, при этом он приведён к стандартным условиям.
Стандартные теплоты образования принято обозначать .
Стандартные теплоты образования простых веществ, устойчивых в стандартных условиях, равны нулю.
Теплота образования одного и того же химического соединения зависит от агрегатного состояния вещества и от его аллотропного видоизменения:
H2(г)+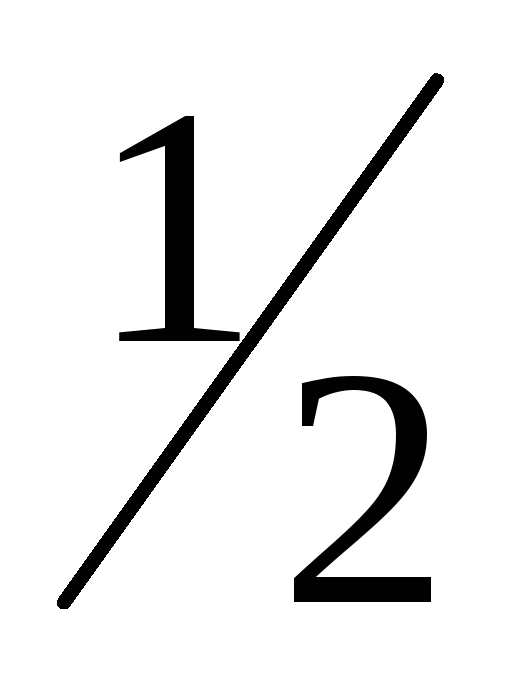

H2(г)+ 

Для реакции вида аА+вВ=сС+dD тепловой эффект определяется равенством:
ΔH = с(



Источник
Тепловой эффект химической реакции.
Тепловой эффект химической реакции зависит только от вида (природы) и состояния исходных веществ и конечных продуктов, но не зависит от пути процесса, т.е. от числа и характера промежуточных стадий.
Большинство реакций протекают при постоянном давлении. Поэтому энергетический эффект реакции оценивают именно изменением энтальпии или тепловым эффектом. В основе расчета лежит закон Гесса:
Тепловой эффект химической реакции зависит только от вида (природы) и состояния исходных веществ и конечных продуктов, но не зависит от пути процесса, т.е. от числа и характера промежуточных стадий.
Например, образование диоксида углерода из графита и кислорода можно рассматривать как результат взаимодействия простых веществ:
Или как результат процесса, протекающего через промежуточную стадию образования и сгорания оксида углерода (I):
Согласно закону Гесса тепловые эффекты образования СО2 любым способом равны:
Энтальпии соединений рассчитаны с особой точностью и приводятся в соответствующих таблицах.
Тепловой эффект реакции равен разности суммы теплот образования продуктов реакции и суммы теплот образования исходных веществ:
где Qi и Qj – теплоты образования продуктов реакции и исходных веществ, соответственно.
Аналогично можно записать:
∆H – изменение энтальпии соответствующей реакции,
∆Hi и ∆Hj – энтальпии образования продуктов реакции и исходных веществ, соответственно.
Источник
