- Циклопарафины их химическое строение, свойства, нахождение в природе, практическое значение.
- 38) Циклопарафины, их химическое состояние, свойства, нахождение в природе, практическое значение.
- 39) Непредельные углеводороды ряда этилена, общая формула и химические свойства. Применение этиленовых углеводородов в медицине.
- Циклопарафины, их строение, свойства, нахождение в природе, практическое значение
- Билет№ 3
- Циклопарафины, их химическое строение, свойства, нахождение в природе, практическое значение.
- Гомологический ряд алканов:
Циклопарафины их химическое строение, свойства, нахождение в природе, практическое значение.
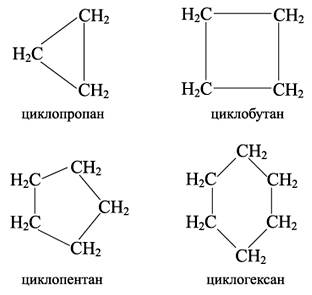
Циклоалканы (циклопарафины)- это предельные циклические углеводороды. Простейшие представители этого ряда:
Общая формула гомологического ряда циклоалканов СnH2n.
Каждый углеродный атом в циклоалканах находится в состоянии sp³-гибридизации и образует четыре σ-связи С-С и С-Н.
―Для циклоалканов характерна изомерия углеродного скелета (структурная изомерия). Структурная изомерия для циклоалканов обусловлена размером цикла.
Так, существует два циклоалкана формулы С4Н8: циклобутан и метилциклопропан.
При обычных условиях циклопропан и циклобутан газы, циклопентан и циклогексан жидкости, начиная с циклогептодекана твердые вещества. Температуры кипения и плавления циклоалканов выше, чем у соответствующих алканов.
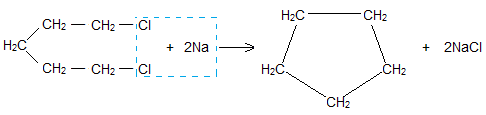
Основной способ получения циклоалканов – отщепление двух атомов галогена от дигалогеналканов:
1,4 — дибромбутан циклобутан
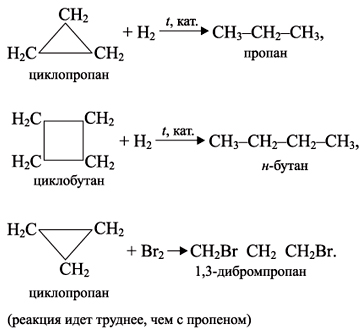
1. Присоединение галогенов.
Циклопропан 1,3 дибромпропан
2. Присоединение водорода (гидрирование). Реакция идёт при повышении температуры до 50º-70ºС используется катализатор платина.
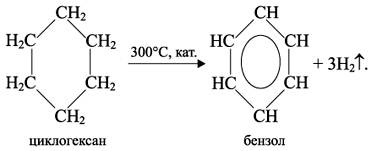
Из циклопарафинов практическое применение имеют циклогексан, метилциклогексан и некоторые другие. В процессе ароматизации нефти эти соединения превращаются в ароматические углеводороды – в бензол, толуол и другие вещества, которые широко используются для синтеза красителей, медикаментов и т.д. Циклопропан используют для наркоза.
Понравилась статья? Добавь ее в закладку (CTRL+D) и не забудь поделиться с друзьями:
Рекомендуем для прочтения:
МЕТОДЫ ПРОГНОЗИРОВАНИЯ В третьей главе рассматриваются методы прогнозирования. Представлена классификация методов прогнозирования. Раскрывается сущность.
Лекция 4. 1. Понятие нормы языка (литературной нормы) А. НОРМЫ СОВРЕМЕННОГО РУССКОГО ЛИТЕРАТУРНОГО ЯЗЫКА (ВАРИАНТЫ.
Процессуальные документы: понятие, виды, значение. Оформление процессуальных документов Процессуальные документы – это процессуальные акты, в которых фиксируются действия и решения органов и должностных лиц, ведущих.
Виды проездных документов Заключение договора перевозки между пассажиром и перевозчиком удостоверяется проездным документом (билетом).
Внутренняя и внешняя политика Б. Н. Ельцина. Внутренняя политика Б. Н. Ельцина. 12 июня 1991 г. всенародным голосованием Б. Н. Ельцина избрали первым Президентом РСФСР. В декабре.
Источник
38) Циклопарафины, их химическое состояние, свойства, нахождение в природе, практическое значение.
В отличии от остальных предельных углеводородов, в молекулах которых все углеродные атомы образуют открытые цепи, имеются углеводороды с замкнутыми цепями (циклами). Так, например, при действии на 1,5-дихлорпентан активным металлом цепь углеродных атомов замыкается и образуется циклический углеводород циклопентан:
Общая формула циклопарафинов CnH2n.
Циклопарафины главным образом находятся в составе некоторых нефтей. Отсюда и другое название циклопарафинов — нафтены. Пяти- и шестичленные циклопарафины были впервые выделены из нефти и изучены профессором Московского университета В. В. Морковниковым.
По химическим свойствам малые и обычные циклы существенно различаются между собой. Циклопропан и Циклобутан склонны к реакциям присоединения, то есть сходны в этом отношении с алкенами. Циклопентан и Циклогексан по своему химическому поведению близки к алканам, так как вступают в реакции замещения.
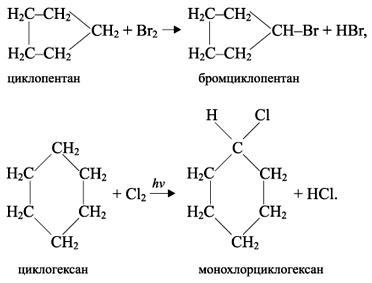
1. Циклопропан и циклобутан способны присоединять бром:
2. Циклопропан, циклобутан и циклопентан могут присоединять водород, давая соответствующие нормальные алканы. Присоединение происходит при нагревании в присутствии никелевого катализатора:
Из циклопарафинов практическое значение имеют циклогексан, метилциклогексан и некоторые другие. В процессе ароматизации нефти эти соединения превращаются в ароматические углеводороды — в бензол, толуол и другие вещества, которые широко используются для синтеза красителей, медикаментов и т. д. Циклопропан применяют для наркоза.
39) Непредельные углеводороды ряда этилена, общая формула и химические свойства. Применение этиленовых углеводородов в медицине.
Алке́ны (олефины, этиленовые углеводороды) — ациклические непредельные углеводороды, содержащие одну двойную связь между атомами углерода, образующие гомологический ряд с общей формулой CnH2n. Атомы углерода при двойной связи находятся в состоянии sp² гибридизации, и имеют валентный угол 120°. Простейшим алкеном является этилен (C2H4)
CH2=CH-CH3 + Br2 → CH2Br-CHBr-CH3 — качественная реакция на алкены — обесцвечивание бромной воды.
Присоединение по правилу Марковникову:
водород присоединяется к наиболее гидрогенезированному (= к тому, у которого больше водородов) атому углерода при двойной связи:
СH2=CH-CH3 + HCl = CH3-CHCl-CH3
1)В нейтральной (или слабощелочной среде:
СH2=CH2 → CH2(OH) — CH2(OH) — схематичное уравнение
3СH2=CH2 + 2KMnO4 + 4H2O = 3C2H4(OH)2 + 2MnO2 + 2KOH — полное уравнение
2)В кислой среде — идет разрыв двойной связи:
R-СH2=CH2-R → 2R-COOH — схематичное уравнение
полное сгорание: С2H4 + 3O2 = 2CO2 + 2H2O
Реакция полимеризации: n СH2=CH2 → n(-CH2-CH2-)
При взаимодействии этилена с хлороводородом образуется этилхлорид, который используют в медицине для проведения местной анестезии. Применение алкенов также связано с их способностью реагировать с водой, образуя при этом спирты. Так, из этилена в процессе реакции гидратации получается этиловый спирт. Нашли свое применение в качестве сырья для производства органических соединений, лаков, пластических масс, средств косметической промышленности и окиси алкенов.
Источник
Циклопарафины, их строение, свойства, нахождение в природе, практическое значение
Помимо предельных углеводородов с открытой цепью существуют предельные углеводороды с замкнутой (циклической) цепью. Они имеют несколько названий: циклоалканы, циклопарафины, нафтены, цикланы, полиметилены. Циклоалканы различаются между собой размерами цикла:
По размеру цикла циклоалканы делятся на группы: малые (C3, C4) и обычные (C5 – C7) циклы.
Молекулы циклоалканов содержат на два атома Н меньше, чем соответствующие алканы (за счет их отщепления замыкается углеродное кольцо). Поэтому общая формула циклоалканов СnH2n.
Трех- и четырехчленные циклоалканы менее прочны, чем пяти- и шестичленные. Циклобутан и особенно циклопропан – соединения малоустойчивые. Это связано с тем, что в молекулах этих соединений углы между валентными связями значительно отличаются от “нормального” угла в правильном тетраэдре (109°28′). Например, в циклопропане, молекулу которого можно изобразить в виде равностороннего треугольника, угол между углерод-углеродными связями (60°) отличается от тетраэдрического угла на 49°28′ (а в расчете на одну связь на 24°44′). Такое отклонение от тетраэдрического угла создает в молекуле значительное напряжение, что существенно сказывается на ее устойчивости.
В циклогексане разница между тетраэдрическим углом и углом между углерод-углеродными связями в нем меньше и составляет 10°32′ (в расчете на одну связь она равна 5°16′). Чтобы еще уменьшить эту разницу, молекула циклогексана, как и другие молекулы циклоалканов, изгибается в пространстве. Существуют две основные формы – “ванна” и “кресло”. Наиболее устойчивой (энергетически выгодной) формой в циклогексане является форма “кресло”.
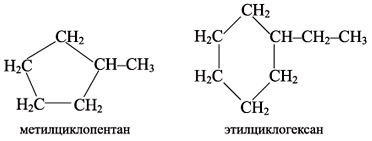
Молекулы циклоалканов часто содержат боковые углеводородные цепи:
У циклопарафинов возможна изомерия.
Структурная изомерия обусловлена размером цикла (например, циклобутан и метилциклопропан – изомеры) и положением заместителей в цикле (например, 1,1- и 1,2-диметилциклобутан).
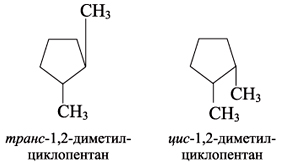
Также имеет место пространственная изомерия, связанная с различным расположением заместителей относительно плоскости цикла. При их расположении по одну сторону от плоскости цикла получаетсяцисизомер, по разные стороны – трансизомер:
Кроме того, каждому циклоалкану изомерен соответствующий алкен – это пример межклассовой изомерии.
Физические свойства. Циклопропан и циклобутан при нормальных условиях – газы, с С5 до С16 – жидкости, начиная с С17 и выше – твердые вещества. Температура кипения и плавления циклоалканов несколько выше, чем у алканов с тем же числом атомов С в молекуле. Циклопарафины в воде практически не растворяются.
Химические свойства. Циклоалканы химически малоактивны и в этом отношении напоминают алканы: они горючи, атомы Н могут замещаться галогенами.
Химические свойства циклоалканов определяются особенностями их строения.
1. Малые циклы (особенно циклопропан) неустойчивы и способны к разрыву, поэтому они склонны к реакциям присоединения:
2. Обычные циклы (С5–С7) очень устойчивы и вступают только в реакции замещения, подобно алканам:
3. Циклопарафины подвергаются реакциям дегидрирования (отщепления Н):
Нахождение в природе. Циклопарафины главным образом находятся в составе некоторых нефтей. Отсюда и другое название циклопарафинов – нафтены. Пяти- и шестичленные циклопарафины были впервые выделены из нефти и изучены профессором Московского университета В.В.Марковниковым.
Практическое значение. Циклоалканы и их гомологи относятся к карбоциклическим соединениям.
Как вещества, составляющие значительную часть некоторых сортов нефти и получаемых из нее нефтепродуктов, они имеют большое практическое значение.
Циклопропан C3H6 используют в качестве анестезирующего средства в хирургии (для наркоза). Циклогексан С6Н12 – прекрасный растворитель. Циклоалканы являются компонентами моторного топлива.
Циклогексан, метилциклогексан и некоторые другие в процессе ароматизации нефти превращаются в ароматические углеводороды – бензол, толуол и другие вещества, которые широко используются для синтеза красителей, медикаментов и т.д.
Источник
Билет№ 3
Под химической связью понимают такое взаимодействие атомов, которое связывает их в молекулы, ионы, радикалы, кристаллы.
Ионная химическая связь – это связь, образовавшаяся за счет электростатического притяжения катионов к анионам (NaCl).
Ковалентная химическая связь – это связь, возникающая между атомами за счет образования общих электронных пар.
Ковалентная неполярная связь – это связь, образующаяся между атомами с одинаковой электроотрицательностью (H2, O2, N2).
Ковалентная полярная связь – это связь, образующаяся между атомами элементов с разной электроотрицательностью (HCl, NH3).
По числу общих электронных пар, связывающих атомы (по кратности), ковалентные связи делят:
Циклопарафины, их химическое строение, свойства, нахождение в природе, практическое значение.
Циклопарафинами (циклоалканы) – называют углеводороды, в молекулах которых углероды соеденены между собой одинарными связями и образуют замкнутую цепь, соответствующие общей формуле CnH2n.
Гомологический ряд алканов:
Главным образом, циклоалканы находятся в составе некоторых нефтей. Пяти- и шести-членные циклоалканы впервые были выделены из нефти В.В.Марковниковым.
Циклопропан и циклобутан при нормальных условиях газы, циклопентан и циклогексан – жидкости. Циклоалканы в воде практически не растворяются.
У циклоалканов, как и у алканов все связи насыщенные, однако в отличие от последних, они способны к реакциям присоединения. Это объясняется тем, что связи между атомами углерода в цикле могут разорваться. В результате образуются свобдные связи, способные присоединять атомы водорода и атомы других элементов.
Источник