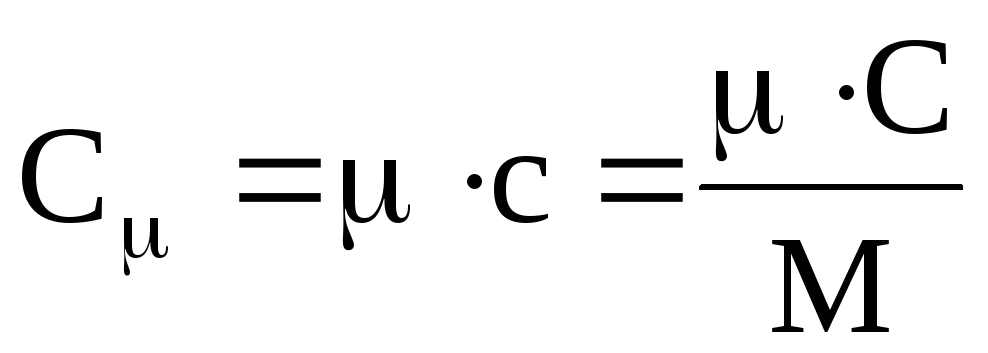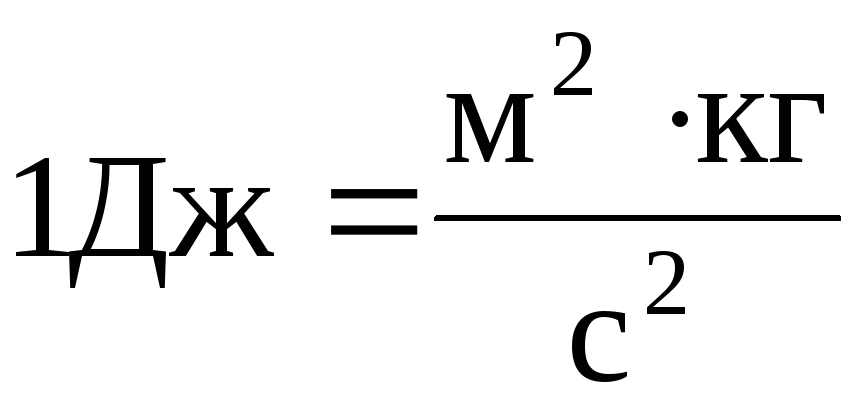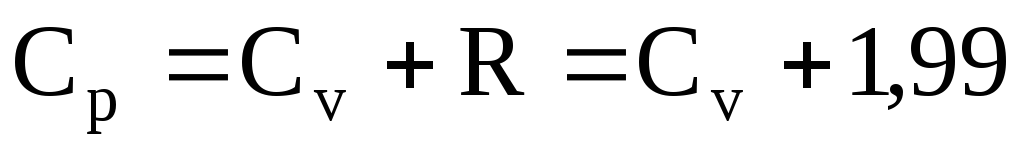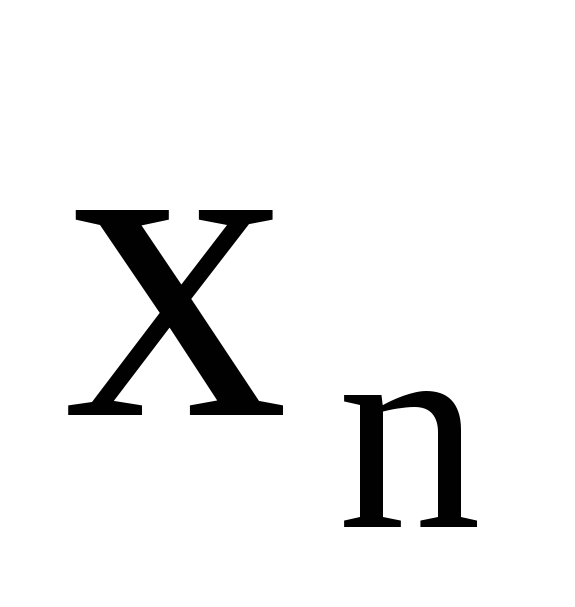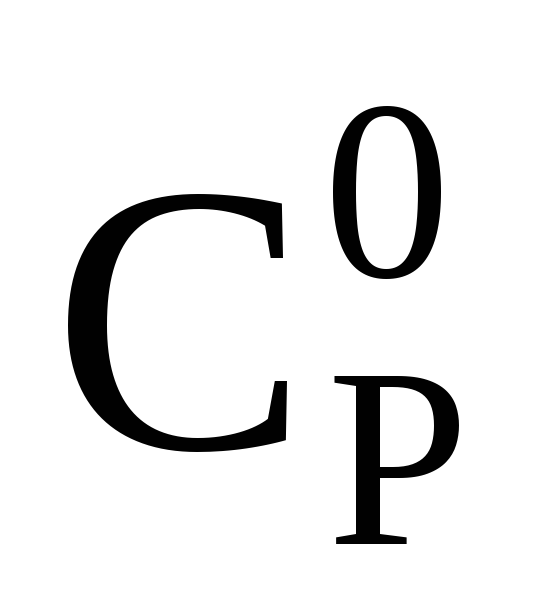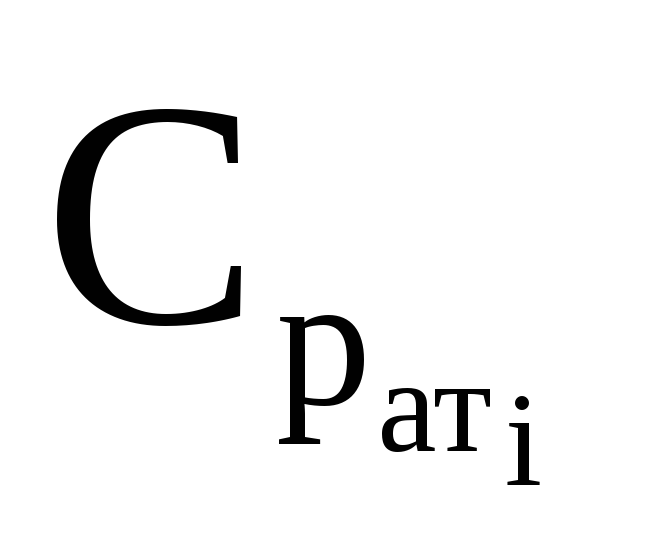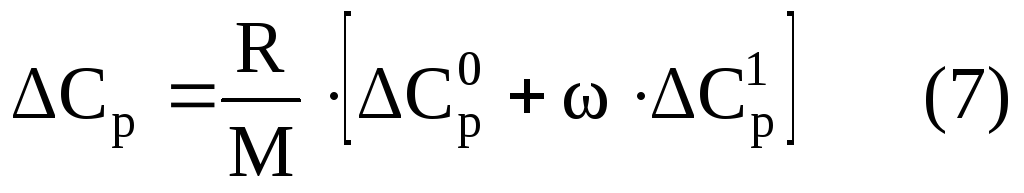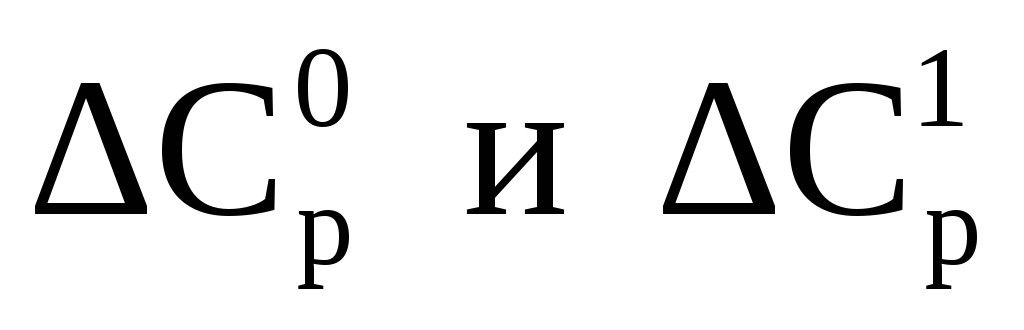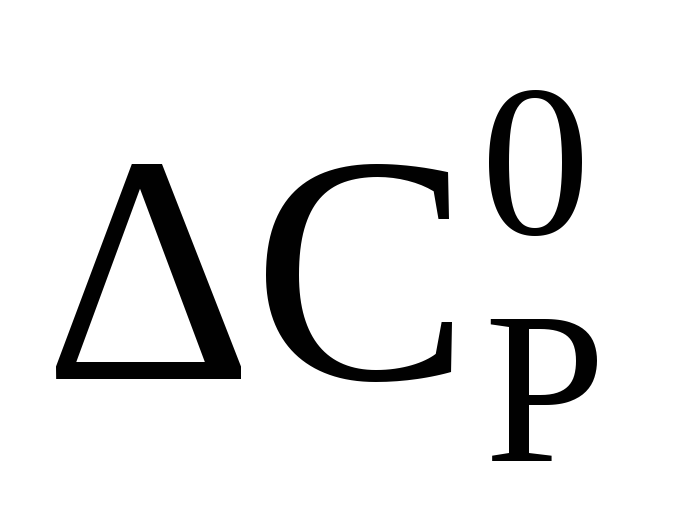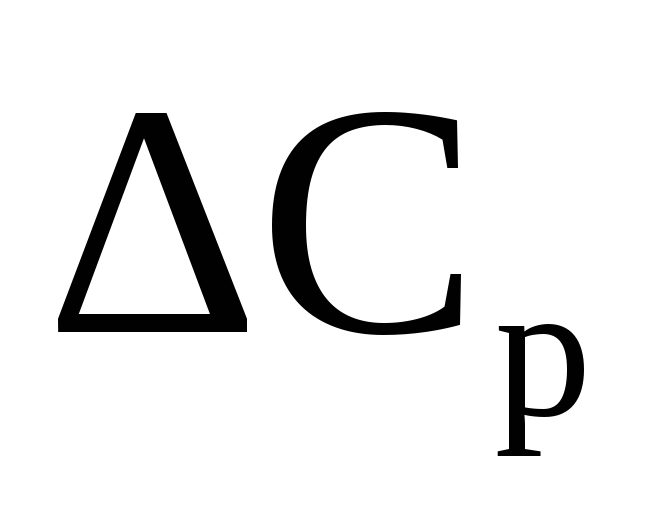§ 9. Определение изобарной молярной теплоемкости природных газов
где индексы у скобок означают давление р = const и объем V= const.
Согласно первому началу термодинамики имеем dQ=dt—Vdp, (III. 60)
где Q — количество теплоты; V — объем системы; i— энтальпия (теплосодержание). di = cpdT + . (III.61)
При изобарном процессе (р = const) изменение количества теплоты системы равно изменению ее энтальпии dQ = di = CpиdT (II1.62)
Изобарная молярная теплоемкость идеальных газов Сри зависит от температуры. Зависимость молярной теплоемкости компонентов природных газов при атмосферном давлении от температуры приближенно можно выразить формулой
Сри = 0,523 (8,36+0,00892t) , кДж/(кмоль-К), (III.64)
где Mi — молекулярная масса углеводорода, являющегося компонентом природного газа (от метана до гептана включительно)
Погрешность расчетов по формуле (III. 64) для углеводородов CH4-C5H12 в интервале температур минус 40 °С плюс 120 О С не превышает 5%, для углеводородов С6Н14—С7Н16 в том же интервале температур не превышает 10 %.
Изобарная молярная теплоемкость неуглеводородных компонентов природных газов (азота, углекислого газа, сероводорода) равна примерно половине теплоемкости углеводорода с одинаковой молекулярной массой при одинаковой температуре.
Например, изобарная молярная теплоемкость CO2(Cри=44) равна половине молярной теплоемкости пропана С3Н8 (Сри=44), которая рассчитывается по формуле (111.64).
Теплоемкость смесей газов определяется по правилу аддитивности(II1.65)
где yi — молярная доля i-ro компонента в смеси; cpi — изобарная молярная теплоемкость i-ro компонента.
Изобарная молярная теплоемкость реальных природных газов зависит от давления и температуры Ср = Сри(t) + Ср(р, t), (Ш.66)
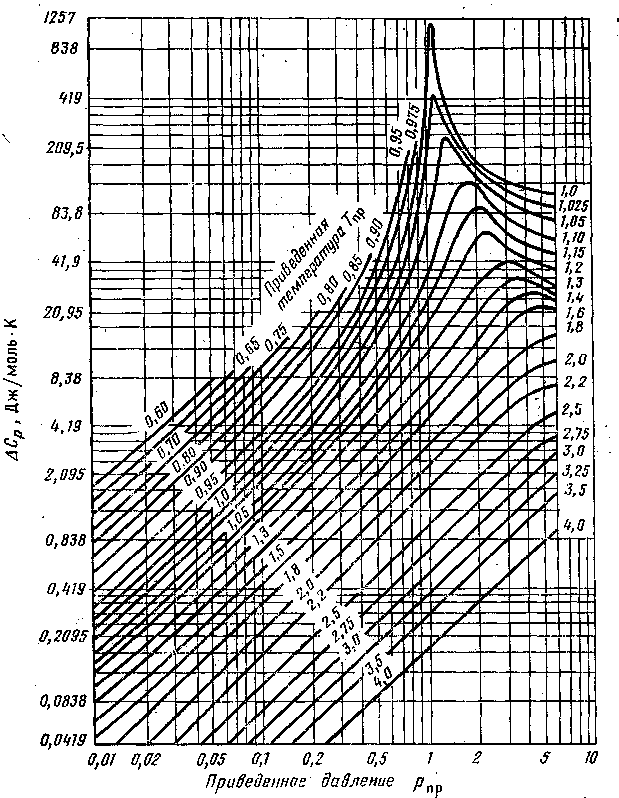
где Ср(р, t) —изотермическая поправка теплоемкости на давление (рис. III.9).
Изобарную молярную теплоемкость природного газа можно рассчитать и по формуле, предложенной Л. М. Гухманом и Т. В. Нагаревой:
При решении задач, связанных с добычей, транспортом, хранением и переработкой природных газов, наиболее употребительны двухконстантные уравнения состояния и восьмиконстантные.
Р ис. III.9. Зависимость изотермической поправки изобарной мольной теплоемкости Ср(р, t) от приведенных абсолютных давления рпр и температуры Тпр
Последней, наиболее удачной модификацией двухконстантного уравнения состояния природных газов, предложенной в 1975 г., является уравнение состояния Пенга — Робинсона
где V —молярный объем; а(Т), b — коэффициенты уравнения, определяемые критическими параметрами вещества (коэффициент а(Т) —фракция температуры).
Уравнение состояния Пенга—Робинсона, записанное относительно коэффициента сверхсжимаемости z, имеет вид z 3 -(1-В)z 2 +(А-3В 2 -2В)z-(АВ—В 2 -B 3 )=0, (69)
Уравнение (III.69) имеет один или три действительных корня. Если смесь находится в двухфазном состоянии, то больший корень относится к паровой фазе, а наименьший положительный корень — к жидкой фазе.
При критических условиях (zкp = 0,307)
При температурах, отличных от критической,
где — безразмерная функция приведенной температуры Тпр и ацентрического фактора ; при критической температуре =1.
Для всех веществ зависимость между 0,5 и Т 0,5 пр может быть аппроксимирована уравнением прямой 0,5 =1+m(1- Т 0,5 пр), (III.73)
где коэффициент m, определяющий угол наклона прямой к оси Т 0,5 пр, является функцией ацентрического фактора : m=0,37464+1,5422b—0,26992 2 . (III.74)
При использовании уравнения Пенга—Робинсона для расчета термодинамических и физических свойств многокомпонентных смесей коэффициенты аcм(Т) и bсм вычисляют по следующим формулам:
Отклонение теплофизических свойств реальных природных газов от идеальных можно определить с использованием уравнения состояния Пенга — Робинсона.
Отклонение энтальпии реального газа
г де Н° — энтальпия идеального газа.
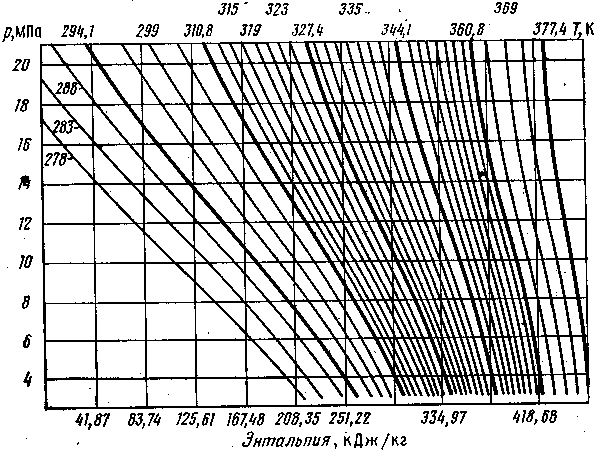
Энтальпийная диаграмма природного газа изображена на рис. III.10.
Рис. III.10. Энтальпийная диаграмма природного газа
Отклонение молярной изобарной теплоемкости реального газа
Зависимость Ср от рпр и Тпр изображена на рис. III.9
Разность изобарной и изохронной молярных теплоемкостей реального газа
Источник
Термодинамические характеристики газа
В технологических расчётах добычи и транспорта газа часто пользуются основными термодинамическими характеристиками природного газа: теплоемкостью, энтропией, энтальпией, теплотой сгорания, теплообменом, теплопроводностью.
Теплоёмкость. Теплоёмкостью называют количество теплоты, необходимое для нагревания единицы массы или объёма вещества на 1° С.
Отношение теплоёмкости в массе системы М называется удельной теплоёмкостью: с = С/М, а отношение теплоемкости к количеству вещества – молярной теплоёмкостью:
. (1)
Единицей количества теплоты, работы, энергии в системе СИ является джоуль (Дж). Джоуль — работа силы 1 Н при перемещении ею тела на расстоянии 1 м в направлении действия силы:
Теплоёмкость выражается в Дж/К, удельная теплоёмкость – в Дж/(кг·K), молярная теплоёмкость – в Дж/(моль К).
Теплоёмкость природных газов зависит от химического состава и состояния, а также от процесса сообщения им теплоты. В адиабатическом процессе С = 0, в изобарическом С = Ср, в изохорическом С = Сv.
Для газов обычно различают теплоёмкости при постоянном объёме Сv и постоянном давлении Ср.
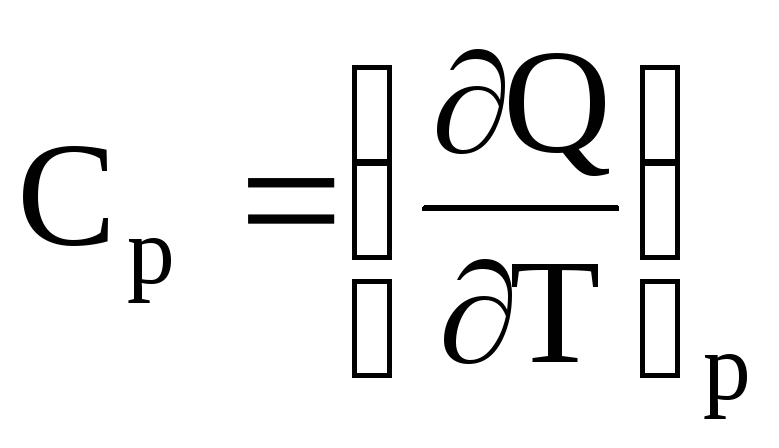
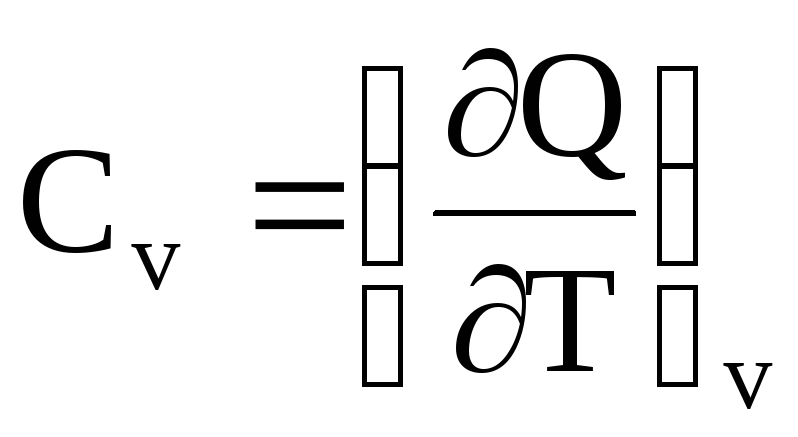
Теплоёмкости при постоянном объёме Сv связана с процессом, характеризующимся тем, что при неизменности объёма вся энергия, сообщаемая газу в форме теплоты, затрачивается на увеличение внутренней энергии газа. Срсвязана с процессом, характеризующимся тем, что, нагревая тело, предоставляют ему возможность расширяться при неизменном давлении. Таким образом, часть сообщенной телу теплоты идет на производство работы расширения. ПоэтомуСр > Сv.
Для идеальных газов между СриСv существует следующее соотношение в [кал/моль·°С]:
(3)
где R— газовая постоянная.
В области давлений, где газы считаются идеальными, значения теплоёмкостей постоянны. Однако для реальных газов значения теплоёмкости изменяются в зависимости от давления и температуры.
Для смеси газов теплоёмкость определяется по сумме теплоемкости входящих компонентов по формуле
(4)
где С1, С2…Сn— теплоёмкости отдельных компонентов смеси;
х1, х2…содержание компонентов в долях единицы.
Отношение теплоёмкости называют показателем адиабаты.
Для практических целей с достаточной точностью можно использовать формулу следующего вида:
где Ср– изобарная теплоёмкость;
Ср ат– теплоёмкость при атмосферном давлении и заданной температуре, определяемая из рисунка 1 и расчётным путём.
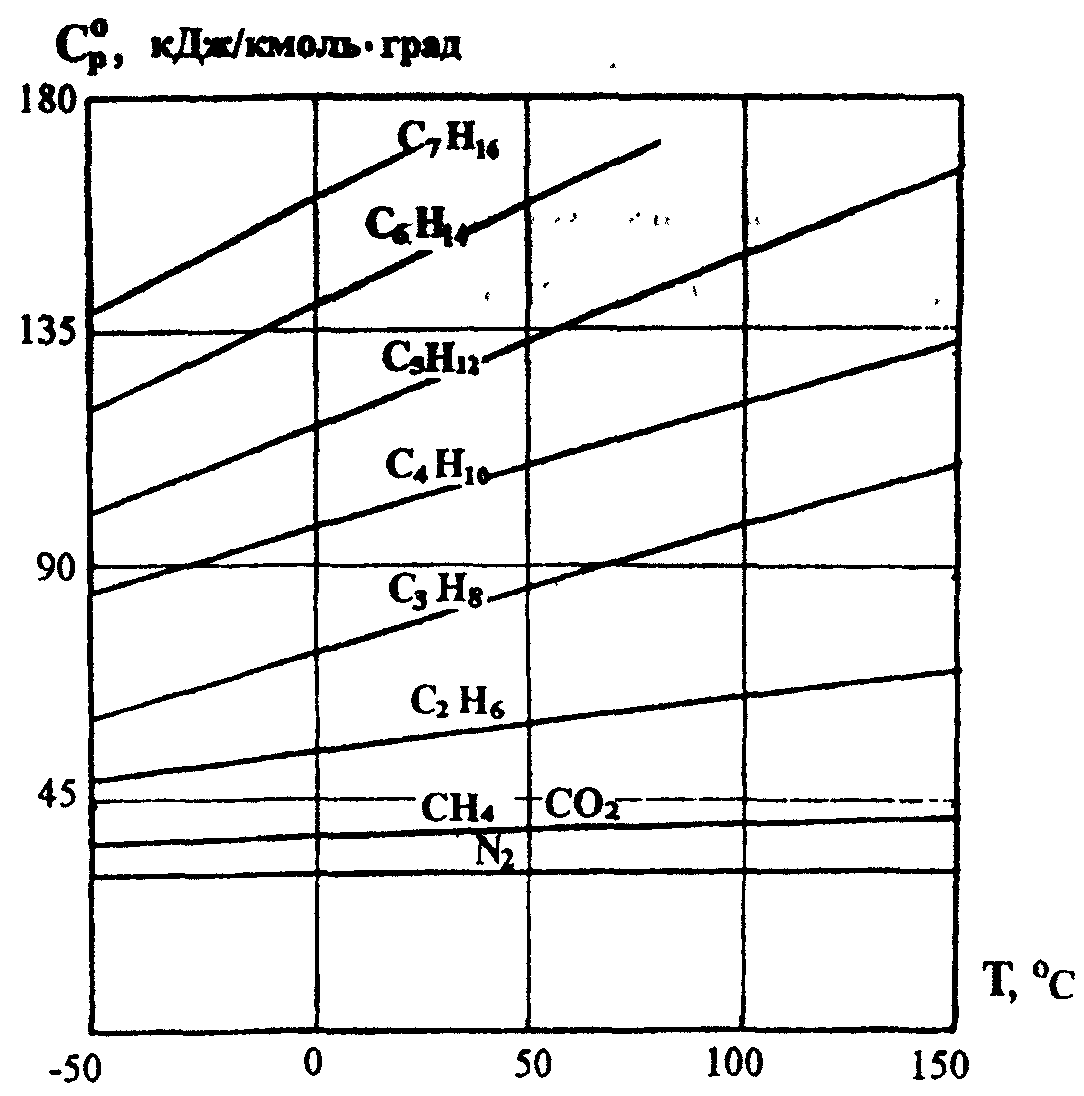
Рисунок 1. Зависимость изобарной молярной теплоёмкости природных газов от температуры при давлении Р = 0,1 МПа
Аналитически Ср атопределяется по формуле следующего вида
где Еi, Fi, Hi, Ni– коэффициенты, определяемые из таблицы 1;
Т – температура, при которой определяется .
Изотермическая поправка на давление ΔСрможет быть определена как графическим путем, так и расчётным, например, по формуле следующего вида
где R – газовая постоянная, равная R = 1,986 ккал/моль;
М – молекулярная масса газа;
— поправки на теплоёмкость, зависящие от приведенных давления и температуры, определяемые по зависимостям, приведенным на рисунках 2 и 3.
Рисунок 2. Зависимость поправочной от приведенных давления и температуры
Величина может быть определена и без учёта фактора ацентричности ω по графической зависимости приведенной на рисунке 4.
Рисунок 3. Зависимость поправочной величины т приведенных давления и температуры
Фактор ацентричности молекул газа ω определяется аналогично, как и при определении коэффициента сверхсжимаемости Z.
Величину Ср(Р, Т) можно рассчитать по формуле вида
(8)
где Т — температура газа, 0 С;
М – молекулярная масса газа.
Таблица 1. Значения коэффициентов для зависимости (6)
Источник