- Важнейшие природы соединения алюминия
- Важнейшие природные содинения алюминия
- Вопрос 3 § 42 Химия 9 класс Рудзитис, Фельдман Охарактеризуйте важнейшие природные соединения алюминия.
- Способы получения Аl2O3
- Соли алюминия
- Способы осаждения (получения) Аl(ОН)3 из растворов его солей
- I. Осаждение из растворов, содержащих соли Al 3+ :
- II. Осаждение из растворов, содержащих гидроксоалюминаты:
- III. Осаждение в результате обратимого или необратимого гидролиза солей Al 3+ (усиливается при разбавлении раствора водой и при нагревании)
Важнейшие природы соединения алюминия
Каолинит — минерал подкласса слоистых силикатов, главная составная часть белой, огнеупорной, и фарфоровой глины. Обычно является продуктом выветривания. Имеет две полиморфные модификации — диккит и накрит. Каолинит сильно гигроскопичен.
Бокситы это осадочные алюминиевые руды. Содержат вредную примесь — SiO2. Бокситы служат важным сырьем для получения алюминия, а также красок, абразивов и огнеупорных материалов.
Корунд относится к классу простых оксидов, и иногда образует прозрачные драгоценные кристаллы — сапфира, и, с добавлением хрома, рубина. Накапливается в россыпях. В основном используется как абразивный материал. Его смесь с магнетитом, гематитом, и шпинелью называют наждаком. Синтетический корунд с различными добавками получают в промышленных масштабах для квантовой электроники, часовой, ювелирной и другой промышленности.
Минерал — серые, красноватые и другие кристаллы с характерным жирным блеском. Главный минерал щелочных изверженных пород. Используется как сырье для добычи алюминия с попутным получением соды.
Полевой шпат или ортоклаз:
Калиевый полевой шпат. Белый, серый, розовый, и.т.д. Одна из главных составных частей гранитов, гнейсов, и других изверженных и метаморфических пород. Сырье стекольной и керамической промышленности.
Важнейшие соединения алюминия.
Оксид алюминия — твердое, тугоплавкое вещество белого цвета. Может образовывать прозрачные кристаллы сапфира или, с добавлением хрома, рубина.
Оксид алюминия получают непосредственно путем сжигания порошка металлического алюминия, вдуванием его в пламя горелки:
Al2O3 — амфотерный оксид. Он реагирует с кислотами:
но в присутствии воды реакция протекает иначе:
Это объясняется тем, что в воде иллюминат натрия (NaAlO2) может присоединить одну или две молекулы воды: NaH2 AlO3или NaAlO2.
Гидроксид алюминия (Al(OH)3):
Внешний вид:
Если белую желеобразную массу выделить из раствора, а затем высушить, то получится белое кристаллическое вещество, практически не растворяющееся в воде.
Гидроксид алюминия получают при взаимодействии раствора щелочи с растворами солей алюминия. При этом раствор щелочи нельзя брать в избытке.
Гидроксид алюминия, как и оксид, обладает амфотерными свойствами. Подобно другим основаниям он реагирует с кислотами. При сплавлении его со щелочами образуются мета алюминаты, а в водных растворах — их гидраты:
Раздел: Металлургия
Количество знаков с пробелами: 2785
Количество таблиц: 0
Количество изображений: 0
Источник
Важнейшие природные содинения алюминия
Каолинит — минерал подкласса слоистых силикатов, главная составная часть белой, огнеупорной, и фарфоровой глины. Обычно является продуктом выветривания. Имеет две полиморфные модификации — диккит и накрит. Каолинит сильно гигроскопичен.
Бокситы:
Al 2 O 3 · nH 2 O
Бокситы это осадочные алюминиевые руды. Содержат вредную примесь — SiO 2 . Бокситы служат важным сырьем для получения алюминия, а также красок, абразивов и огнеупорных материалов.
Корунд относится к классу простых оксидов, и иногда образует прозрачные драгоценные кристаллы — сапфира, и, с добавлением хрома, рубина. Накапливается в россыпях. В основном используется как абразивный материал. Его смесь с магнетитом, гематитом, и шпинелью называют наждаком. Синтетический корунд с различными добавками получают в промышленных масштабах для квантовой электроники, часовой, ювелирной и другой промышленности.
Нефелин:
Na 2 O · Al 2 O · 2SiO 2
Минерал — серые, красноватые и другие кристаллы с характерным жирным блеском. Главный минерал щелочных изверженных пород. Используется как сырье для добычи алюминия с попутным получением соды.
Полевой шпат или ортоклаз:
K 2 O · Al 2 O 3 · 6SiO 2
Калиевый полевой шпат. Белый, серый, розовый, и.т.д. Одна из главных составных частей гранитов, гнейсов, и других изверженных и метаморфических пород. Сырье стекольной и керамической промышленности.
База рефератов на портале KM.RU существует с 1999 года. Она пополнялась не только готовыми рефератами, докладами, курсовыми, но и авторскими публикациями, чтобы учащиеся могли использовать их и цитировать при самостоятельном написании работ.
Это популяризирует авторские исследования и научные изыскания, что и является целью работы истинного ученого или публициста. Таким образом, наша база — электронная библиотека, созданная в помощь студентам и школьникам.
Уважаемые авторы! Если Вы все же возражаете против размещения Вашей публикации или хотите внести коррективы, напишите нам на почту info@corp.km.ru, мы незамедлительно выполним Вашу просьбу или требование.
Источник
Вопрос 3 § 42 Химия 9 класс Рудзитис, Фельдман Охарактеризуйте важнейшие природные соединения алюминия.
Каолинит: Аl2О3 • 2 SiО2 • 2Н2О. Каолинит —
минерал, главная составная часть белой, огнеупор-
ной, и фарфоровой глины. Бокситы — Аl2О3 • nН2О.
Обычно бокситы представляют собой землистую
глиноподобную массу. Используют для получе-
ния алюминия и в качестве флюса в черной
металлургии. Нефелин — Na2О • Аl2О3 • 2SiО2 —
породообразующий минерал, который использу-
ют в производстве алюминия, соды, в стеколь-
ной, кожевенной промышленности. Алуниты —
(Na,K)2SО4 • Al2(SО4)3 • 4 Аl(ОН)3 — применяют для
получения квасцов, глинозема, калиевых солей. Ко-
рунд (сапфир, рубин, наждак) — Аl2О3 — драгоцен-
ные камни, применяются также в качестве сырья
для изготовления офтальмологических скальпелей,
хрусталиков глаза, в устройстве лазера. Берилл
(изумруд, аквамарин) — 3 ВеО • Аl2О3 • 6 SiО2 —
драгоценные камни, поделки. Хризоберилл (алек-
сандрит) — ВеАl2О4. Александрит меняет окраску
от темной сине-зеленой, голубовато-зеленой, тем-
ной травяно-зеленой, оливково-зеленой при днев-
ном свете до розово-малиновой. Применяется в
качестве драгоценного камня.
Источник
Способы получения Аl2O3
— твердое бесцветное вещество, нерастворимое в воде. При нагревании разлагается:
Полученный этим способом Al2O3 называется алюмогелем.
По химическим свойствам — типичный амфотерный гидроксид, растворяется и в кислотах, и в щелочах:
Al(OH)3 + NaOH = Na[Al(OH)4] тетрагидроксоалюмикат натрия
При сплавлении Al(OH)3 с твердыми щелочами образуются метаалюминаты — соли метагидроксида АlO(ОН), которые можно рассматривать как соли метаалюминиевой кислоты НАlO2:
Соли алюминия
Вследствие амфотерности гидроксида алюминия и возможности существования его в орто- и метаформе существуют различные типы солей. Так как Al(OH)3 проявляет очень слабые кислотные и очень слабые основные свойства, все типы солей в водных растворах в сильной степени подвержены гидролизу, в результате которого образуется в конечном итоге нерастворимый Al(OH)3. Присутствие в водном растворе того или иного типа солей алюминия определяется величиной рН данного раствора.
1. Соли Al 3+ с анионами сильных кислот (AlCl3, Al2(SO4)3, Al(NO3)3, АlВr3) существуют в подкисленных растворах. В нейтральной среде метаалюминаты, содержащие алюминий в составе аниона АlO2 существуют в твердом состоянии. Распространены в природе. При растворении в воде превращаются в гидроксоалюминаты.
2. Гидроксоалюминаты, содержащие алюминий в составе аниона [Al(OH)4] — , существуют в щелочных растворах. В нейтральной среде сильно гидролизуются.
3. Метаалюминаты, содержащие алюминий в составе аниона АlO2. Существуют в твердом состоянии. Распространены в природе. При растворении в воде превращаются в гидроксоалюминаты.
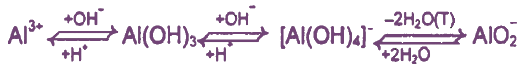
Взаимопревращения солей алюминия
Способы осаждения (получения) Аl(ОН)3 из растворов его солей
I. Осаждение из растворов, содержащих соли Al 3+ :
а) действие сильных щелочей, добавленных без избытка
б) действие водных растворов аммиака (слабое основание)
в) действие солей очень слабых кислот, растворы которых вследствие гидролиза имеют щелочную среду (избыток ОН — )
II. Осаждение из растворов, содержащих гидроксоалюминаты:
а) действие сильных кислот, добавленных
б) действие слабых кислот, например, пропускание СО2
III. Осаждение в результате обратимого или необратимого гидролиза солей Al 3+ (усиливается при разбавлении раствора водой и при нагревании)
Источник