Понятие растворимости, растворения. Процесс растворения. Факторы, влияющие на процесс растворения
В данной статье мы постараемся не только максимально раскрыть теорию растворения, но и обобщить, систематизировать сведения из различных источников о процессе растворения и влиянии внешних факторов на растворимость. Но главная цель статьи — вывести уравнение зависимости растворимости твердых веществ в воде и других жидких растворителях от температуры. Или другими словами, вывести уравнение температурного фактора растворимости твердых веществ.
Процесс растворения — сложный физико-химический процесс, при котором образуется гомогенная термодинамически устойчивая система, называемая раствором. Вещество, в котором растворяется другое вещество или несколько веществ называется растворителем.
Существует множество различных видов и классификаций видов растворов — жидкие, твердые, газообразные, истинные (ионно-молекулярные), коллоидно-дисперсные [5]. Растворяемыми веществами могут быть газы, жидкости и твердые вещества.
В данной статье мы немного сузим задачу — рассмотрим проблему растворимости твердых веществ в жидких растворителях, а также очень поверхностно затронем тему растворимости газов.
Растворимость — способность вещества растворяться в растворителе. Существуют различные меры растворимости. Две наиболее распространенные меры растворимости: по количеству грамм растворенного вещества к количеству грамм растворителя г/100 г. растворителя (m растворяемого/m растворителя); но более удобная — молярная — по количеству вещества в объеме раствора, моль/литр (n растворяемого вещества/V раствора). Однако обе из этих классификации часто используются в литературе.
При растворении твердых веществ в жидкостях протекают следующие процессы:
- Разрушение кристаллической решетки твердого вещества. Для разрушения кристаллической решетки твердого вещества необходимы затраты энергии. Данный процесс является эндотермическим, для его осуществления необходим приток тепла извне.
- Диффузия молекул жидкости и молекул твердого вещества. Скорость диффузии определяется скоростью движения молекул, то есть скорость диффузии прямо зависит от температуры. Чем она выше, тем скорее протекает данная стадия [5]:
- Сольватация — процесс взаимодействия молекул жидкости и молекул твердого вещества (если растворитель — вода, данный процесс называется гидратацией). Процесс сольватации может быть как эндо-, так и экзотермическим. То есть при взаимодействии молекул растворителя и твердого вещества может как выделяться теплота, так и поглощаться. Следовательно, повышение температуры может как замедлить, так и укорить данную стадию. В данном случае все зависит только от природы молекул растворителя и растворяемого вещества.
В соответствии с источником [2] растворимость твердых веществ определяется следующими факторами:
- Природа растворителя и природа растворенного вещества. Здесь необходимо отметить, что существуют растворители полярные (вода) и неполярные (бензол). Полярные вещества (например соли минеральных кислот) как правило лучше растворяются в полярных растворителях, неполярные (к примеру гексан, толуол) — в неполярных.
- На растворимость твердых веществ давление существенно не влияет. Однако растворимость газа напрямую зависит от давления. Согласно закону Генри, растворимость газа прямо пропорциональна давлению газа над жидкостью: [4]: c = kp, или с ~ p , где c — молярная концентрация растворенного газа в объеме раствора (моль/литр); p — давление газа над жидкостью (Па); k — константа растворимости газа. Данная константа может зависеть от других факторов, таких как например температура, но не зависит от давления газа над раствором, объема раствора и количества вещества растворенного или растворяемого газа. В дифференциальной форме уравнение закона Генри выглядит следующим образом: dc = kdp
- Температурный фактор. Для большинства твердых веществ растворимость увеличивается с ростом температуры. Исключение могут составить некоторые кристаллогидраты, так как растворение самих кристаллогидратов сопровождается поглощением тепла (эндотермический процесс), но после «освобождения» молекул соли от молекул воды в кристаллогидрате безводные молекулы при гидратации (сольватации) сами могут выделять тепло (экзотермический процесс), тем самым нагревание может тормозить процесс растворения. Яркий тому пример – процесс растворения в воде глауберовой соли Na2SO4·10H2O. Существуют и другие исключения из этого правила. Наша цель — вывести эту зависимость, описав ее математически. На растворимости газов в воде повышение температуры сказывается негативно. При повышении температуры растворимость газа резко падает. При кипячении из воды выходит весь газ.
Стоит также отметить, что согласно работе [3] на растворение добавок в полиэтилене влияет наличие других добавок — продуктов окисления полиэтилена. То есть на растворимость вещества в растворителе могут влиять и другие примеси. Стоит отметить, что полиэтилен не жидкость, и не твердое кристаллическое вещество, а аморфное. Поэтому его раствор в таком случае сложно назвать жидким или твердым.
Здесь также необходимо отметить, что если речь идет о коллоидном растворе, а не об истинном растворе, то добавление особых примесей — коагулянтов, влечет к выпадению в осадок дисперсной фазы из дисперсной среды — процессу коагуляции [1]. Таким образом, примеси могут влиять на растворимость как положительно, так и отрицательно.
Вывод уравнения(-ий) зависимости растворимости твердых веществ в жидких растворителях от температуры.
Итак, выведем зависимость или зависимости растворимости твердых веществ от температуры. Мы уже знаем, что на растворимость твердых веществ в жидкостях влияет температура. Рассмотрим график из учебного пособия [4].
Как видно из графика, зависимость растворимости нитрата свинца от температуры практически линейная. Так при 20 °С в 100 г воды растворяется около 50 г нитрата свинца. При 40 °С около 70 г, а при 60 °С чуть менее 90 г. Данная зависимость практически линейна:
m = kt + const, при t > 0, где:
m — масса растворяемого вещества, k — коэффициент пропорциональности, t — температура (в градусах Цельсия), const — константа, масса растворяемого вещества, способная раствориться в 100 грамм воды при 0 °С.
Из уравнения мы можем определить коэффициент k, определив его, мы можем выяснить, верно ли предположение о том, что зависимость практически линейная. Кроме того мы сможем оценочно определить массу растворяемого вещества при любой температуре.
Исходя из данных графика видно, что const приблизительно равно 30, при температуре 20 °С масса растворенного в воде нитрата свинца равна примерно 50 г, тогда константа k:
k = (m — const)/t ≈ (50 — 30)/20 ≈ 1
Теперь определим, сколько граммов нитрата свинца может раствориться при температуре 40 °С:
m ≈ kt + const ≈ 1×40 + 30 ≈ 70 г
И действительно, в соответствии с графиком в 100 г воды при температуре 40 °С растворяется около 70 г нитрата свинца. Таким образом, зависимость верна.
Похожая картина и с хлоридом натрия, так как его график так же похож на «прямую».
У нитрата калия график более похож на ветвь параболы:
Причем const ≈ 15 (приблизительно), а t > 0.
Рассчитаем коэффициент k. При температуре 20 °С в 100 г воды растворяется примерно 30 г нитрата калия:
k = (m — const)/t 2 ≈ (30 — 15)/20 2 ≈ 0,0375
Теперь рассчитаем сколько граммов нитрата может раствориться в 100 г воды при температуре 40 °С, после чего сверим с графиком:
m = kt 2 + const = 0,0375×40 2 + 15 ≈ 75 г
На графике видим, что при 40 °С в 100 г воды растворяется 70-75 г нитрата калия. Таким образом, предположение о правильности зависимости растворения практически верно.
Также очевидно, что размерность коэффициента может различной, для разных графиков. В случае нитрата свинца или хлорида натрия:
В случае же нитрата калия:
Конечно, для вывода общей закономерности это недостаточно. К примеру, бихромат калия и хлорид ртути на данном графике представляют собой более сложные функции. Поэтому, наиболее обобщенно можно сказать, что:
То есть, растворимость твердого вещества прямо пропорциональна температуре. Или, дифференциал массы растворяемого вещества есть ничто иное как, произведение коэффициента пропорциональности на дифференциал температуры. Важно учесть, что температура всегда положительная (по Цельсию): t > 0.
Если мы проинтегрируем левую и правую часть выражения dm = kdt, мы получим:
Мы пришли к примеру, аналогичному зависимости растворимости нитрата свинца. Однако в случае, например с хлоридом ртути, выражение типа m = kt + const будет справедливо только при небольшом интервале температур, к примеру от 20 °С до 40 °С. Для выражения зависимости растворимости хлорида ртути на всех температурных интервалах правильнее будет использовать выражение типа dm = kdt. Само собой разумеется, что речь идет о температурах выше нуля по Цельсию.
Если речь идет не о массе растворенного вещества, а о его молярной концентрации, то уравнение dm = kdt примет вид:
с — молярная концентрация растворенного вещества (моль/литр). Коэффициент в таком случае будет иметь размерность
Все остальные операции с молярной концентрацией c аналогичны операциям с массой m, как в уравнениях выше.
Таким образом, зависимость растворимости твердых веществ в воде и в других жидких растворителях прямо пропорциональна температуре (в большинстве случаев), и в общем случае может описываться уравнениями:
- Балезин С. А. Основы физической и коллоидной химии / С. А. Балезин, Б. В. Ерофеев, Н. И. Подобаев – М.: Просвещение, 1975. – 398 с.
- Болдырев А. И. Физическая и коллоидная химия / А. И. Болдырев – М.: Высшая Школа, 1974. – 504 с.
- Монахова Т. В. Растворимость добавок в полиэтилене и алифатических полиамидах/ Т. В. Монахова, А. П. Марьин, Ю. А. Шляпников // Высокомолекулярные соединения – 1991. — № 11. – С.1306-1310
- Стась Н.Ф. Химия растворов / Н.Ф. Стась, Л.Д. Свинцова – Томск: Издательство ТПУ, 2006. – 155 с.
- Телесин Р. В. Молекулярная физика / Р. В. Телесин – М.: Высшая школа, 1965. – 360 с.
Автор статьи: Кошелев Георгий Геннадьевич, учитель химии и физики г.о.г. Выкса.
Редактор статьи: Доронин Дмитрий Олегович, учитель физики, информатики и астрономии г.о.г. Выкса.
По всем вопросам, в том числе вопросам сотрудничества, писать сюда: diomidius89@gmail.com
Источник
Физико-химическая природа процесса растворения.
Природа процесса растворения сложна. Естественно возникает вопрос, почему некоторые вещества легко растворяются в одних растворителях и плохо растворимы или практически нерастворимы в других.
Образование растворов связано с физическим процессом – диффузией растворенного вещества и растворителя. Благодаря диффузии частицы — молекулы, ионы — удаляются с поверхности растворяющегося вещества и равномерно распределяются по всему объему растворителя. Именно поэтому в отсутствие перемешивания скорость растворения зависит от скорости диффузии. Но не только физическими процессами объясняется неодинаковая растворимость веществ в различных растворителях.
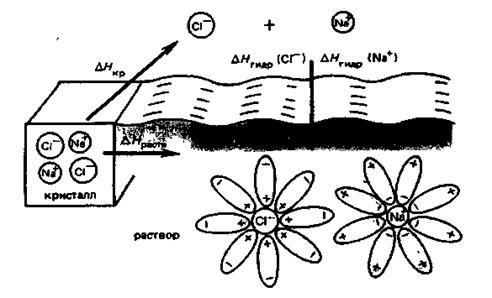
Важную роль при растворении играют химические процессы. Д.И. Менделеев доказал существование гидратов серной кислоты Н2SО4·Н2О, Н2SО4·2Н2О, Н2SО4·4Н2О и некоторых других веществ, например С2Н5ОН·3H2О. В этих случаях растворение сопровождается образованием химических связей частиц растворяемого вещества и растворителя. Этот процесс называется сольватацией; в частном случае, когда растворителем является вода, — гидратацией.
Химические взаимодействия осуществляются за счет донорно-акцепторных связей — здесь ионы растворенного вещества являются акцепторами электронов, а растворители (Н2О, NН3) — донорами электронов (например, образование аквакомплексов), а также в результате образования водородных связей (например, растворение спирта в воде).
Доказательствами химического взаимодействия растворенного вещества с растворителем являются тепловые эффекты и изменение окраски, сопровождающие растворение.
Например, при растворении гидроксида калия в воде выделяется теплота:
а при растворении хлорида натрия теплота поглощается:
Теплоту, выделяемую или поглощаемую при растворении 1 моль вещества, называют теплотой растворения Qраств.
Растворение в воде безводного меди сульфата белого цвета приводит к появлению интенсивной голубой окраски. Образование сольватов, изменение окраски, тепловые эффекты, как и ряд других фактов, свидетельствуют об изменении химической природы компонентов раствора при его образовании.
Рис. 4.3. Растворение кристалла NaCl в воде
Таким образом, в соответствии с современными представлениями растворение — физико-химический процесс, в котором играют роль как физические, так и химические взаимодействия.
Понравилась статья? Добавь ее в закладку (CTRL+D) и не забудь поделиться с друзьями:
Источник