5.7. Водородная связь
Атом водорода, образовавший полярную связь с атомом другого элемента, электроотрицательность которого выше электроотрицательности водорода, способен образовывать дополнительную связь с другим атомом того же или иного элемента высокой электроотрицательности. Такая связь называется водородной. Этот вид химического взаимодействия уникален и присущ только одному элементу — водороду. Ниже приведена схема образования водородной связи при взаимодействии двух полярных молекул
В образовавшейся частице связь X-H является полярной, а связь HY — водородной (водородная связь обычно обозначается пунктиром).
Водородной связи присущи следующие особенности:
1. Водородная связь является насыщаемой. Атом водорода образует лишь одну водородную связь; его партнеры могут участвовать в образовании нескольких водородных связей.
2. Водородная связь является направленной. Фрагмент Х-НY обычно является линейным, хотя в некоторых случаях может быть и угловым.
3. Энергия водородной связи невелика (8 — 40 кДж/моль) и представляет величину того же порядка, что и энергия межмолекулярного взаимодействия. Прочность водородной связи тем выше, чем больше электроотрицательность партнера водорода. Так энергия связи HF составляет 25-40 кДж/моль, связи НО — 19-21 кДж/моль, связей NH и SH — около 8 кДж/моль.
4. Водородная связь асимметрична: во фрагментах Х-НХ длина связи НХ больше длины Н-Х.
Общая теория водородной связи не разработана до настоящего времени. Можно считать, что по своей природе водородная связь имеет смешанный характер, в силу чего при ее описании следует учитывать два эффекта.
1. Электростатический эффект. В отличие от всех других элементов атом водорода имеет лишь один электрон и при потере последнего превращается не в обычный ион, а в элементарную частицу — протон. В связи с этим водород, образовавший полярную связь, может сильно притягиваться к электронным оболочкам соседних атомов, не связанных с ним ковалентно; силы межэлектронного отталкивания при этом не возникают.
2. Эффект донорно-акцепторного взаимодействия. При сильном смещении общей электронной пары, образующей полярную связь, к электроотрицательному партнеру атом водорода проявляет акцепторные свойства и способен взаимодействовать с электронными парами другого атома, хотя образующаяся при этом связь менее прочная, чем при наличии у водорода вакантной электронной орбитали.
Различают два типа водородной связи.
1. Межмолекулярная водородная связь. Образуется между двумя или несколькими молекулами, одинаковыми или различными.
Типичным примером вещества с межмолекулярными водородными связями является фтороводород, который образует ассоциаты (HF)n во всех агрегатных состояниях; при этом в газообразном фтороводороде значения n не превышают 4, а в жидком – n больше чем 4. Ассоциаты фтороводорода представляют собой цепи, состоящие из линейных (FHF) и угловых (HFH) фрагментов.
При этом длина водородной связи HF на 55% больше длины полярной связи. При достаточно высоких значениях n эти цепи могут замыкаться в циклы.
Образование ассоциатов за счет водородных связей характерно для воды. В жидкой воде образуются ассоциаты (Н2О)n, простейшим из которых является дигидроль (Н2О)2
для которого водородная связь в 1,8 раза длиннее полярной. В кристаллической воде каждый атом водорода образует одну полярную и одну водородную связь, а кислород участвует в образовании четырех связей — двух полярных и двух водородных (по числу электронных пар). Структурной единицей льда является тетраэдр, в котором центральный атом кислорода соединен с четырьмя атомами водорода, а каждый атом водорода — с двумя атомами кислорода во фрагменте ОНО
Муравьиная кислота НСООН в жидком и газообразном состояниях за счет водородных связей образует циклические димеры
2. Внутримолекулярная водородная связь образуется между атомами одной и той же молекулы. При образовании внутримолекулярной водородной связи обычно наблюдается замыкание циклов (пяти- или шестичленных); фрагмент XHY при этом может быть нелинейным. Например, для молекулы 2,6-дигидроксибензойной кислоты наблюдается образование двух внутримолекулярных водородных связей
В тоже время 3,5-дигидроксибензойная кислота образует только межмолекулярные водородные связи в силу удаленности функциональных групп друг от друга
Некоторые авторы выделяют еще и третий тип водородной связи — межатомную, примером которой считают связь в дифторогидрогенат-анионе HF2 — . Однако логичнее рассматривать дифторогидрогенат-анион и другие подобные ассоциаты как молекулярные частицы, имеющие трехцентровую связь с участием мостикового атома водорода. В пользу такого подхода свидетельствует высокая энергия связи в HF2 — (113 кДж/моль) и симметричная структура частицы.
Поскольку разрыв водородных связей требует затраты энергии, образование водородных связей определенным образом влияет на свойства вещества. Образование водородных связей повышает температуры и энтальпии кипения и кристаллизации соответствующих соединений, а также увеличивая их теплоемкость. Так, если бы в воде отсутствовали водородные связи, она кипела бы при -80 С, а кристаллизовалась бы при -100 С.
Теплоемкость воды также аномально велика и составляет при стандартных условиях 4,2 Джг -1 К -1 , что в 2-3 раза больше теплоемкости жидкостей, не образующих водородных связей. Образование водородных связей затрудняет отщепление катионов водорода при электролитической диссоциации вещества в растворах. Так, для 2,6-дигидроксибензойной кислоты, вещества с внутримолекулярными водородными связями, константа ионизации на три порядка ниже, чем для 3,5-дигидроксибензойной кислоты, молекулы которой не образуют внутримолекулярных водородных связей. Следствием образования водородных связей могут также быть аномалии плотности вещества. Так, плотность жидкой воды максимальна при 4 С, а плотность льда ниже плотности жидкой воды. Эта аномалия может быть объяснена ажурной структурой льда, обусловленной образованием большого числа водородных связей и наличием в результате этого полостей в кристаллической структуре воды. При плавлении льда примерно 10% водородных связей разрушается, и плотность воды возрастает. Отметим также, что образование водородных связей между растворителем и растворенным веществом благоприятствует увеличению растворимости.
Источник
3. Водородная связь
Водородная связь — это взаимодействие, возникающее между положительно заряженным атомом водорода и намного более электроотрицательным атомом, чаще всего кислорода, азота или фтора.
Это взаимодействие в несколько раз сильнее межмолекулярных сил, но в десять — пятнадцать раз слабее ковалентной связи.
Водородная связь образуется за счёт электростатического притяжения заряженных атомов, а также некоторый вклад в её возникновение вносит донорно-акцепторное взаимодействие. Из-за поляризации у атома водорода частично освобождается электронная орбиталь, а в атомах фтора, кислорода и азота есть пары электронов. Атом водорода выступает акцептором электронов, атом другого неметалла — их донором.
Водородная связь бывает межмолекулярной (в воде, аммиаке, фтороводороде, спиртах, карбоновых кислотах), а также внутримолекулярной (в многоатомных спиртах, белках, нуклеиновых кислотах).
Водородная связь значительно повышает температуры кипения и плавления веществ, а также их взаимную растворимость.
Рассмотрим влияние водородной связи на температуры кипения водородных соединений неметаллов \(IV\)–\(VII\) групп.
Температуры кипения зависят от молекулярных масс веществ и должны возрастать в каждом ряду. Но для воды, аммиака и фтороводорода эти значения температур не подчиняются общей закономерности. Причина такого явления — возникновение водородной связи.
Водородная связь образуется не только между одинаковыми молекулами, но и между разными. Например, такая связь возникает между молекулами спиртов и воды, что обуславливает их способность смешиваться друг с другом. Так, метанол, этанол, пропанол, этиленгликоль, глицерин растворяются в воде неограниченно благодаря образованию водородных связей.
Водородные связи широко встречаются в природе и оказывают значительное влияние на свойства веществ. Они значительно повышают температуры плавления и кипения веществ, влияют на их растворимость в воде.
Благодаря образованию водородных связей вода, метанол, этанол, уксусная кислота и многие другие вещества при обычных условиях находятся в жидком состоянии.
Водородные связи обуславливают вторичную (спиралевидную) структуру белков, а также соединяют две комплементарные цепи ДНК в единое целое.
Источник
3.2 Водородная связь. Заряд-дипольное взаимодействие
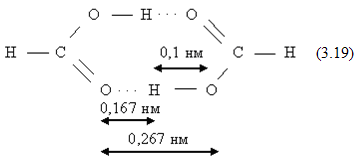
Водородная связь. Эта связь осуществляется между атомом водорода, химически связанном с одной молекулой и электроотрицательными атомами О, N, F, Cl и другими, принадлежащими той же или другой молекуле. В первом случае это будет внутримолекулярная связь, во втором – межмолекулярная. Природа водородной связи сложна и не сводится только к электростатическому притяжению, хотя оно дает основной вклад в энергию водородной связи. По данным структурного анализа кристаллов, расстояние между электроотрицательными атомами, связанными водородной связью, меньше ван-дер-ваальсовых радиусов соответствующих атомов. Например, сумма ван-дер-ваальсовых радиусов для пары атомов О ∙ ∙ ∙ О составляет 0,28 нм, а при образовании водородной связи О – Н ∙ ∙ ∙ О это расстояние сокращается до 0,27 – 0,25 нм. В димере уксусной кислоты (19) расстояние О – Н в гидроксигруппе равно 0,1 нм, длина водородной связи составляет 0,167 нм. Теплота димеризации муравьиной кислоты 59,22 кДж/моль, следовательно, на энергию водородной связи приходится 59,22/2 = 29,61 кДж/моль.
Наряду с электростатическим взаимодействием, ван-дер-ваальсовым притяжением и отталкиванием в энергию водородной связи UВОДОР вносит вклад и энергия делокализации UДЕЛОК двух электронов связи (А – Н) и неподеленной пары электронов другого электроотрицательного атома (В), что также уменьшает ее длину. Например, для связи О – Н ∙ ∙ ∙ О UВОДОР = UЭЛ-СТАТ + UДИСП + UДЕЛОК + UОТТ, что дает соответственно UВОДОР = ( – 25,2 – 12,6 – 33,6 + 35,28 ) = – 36,12 кДж/моль.
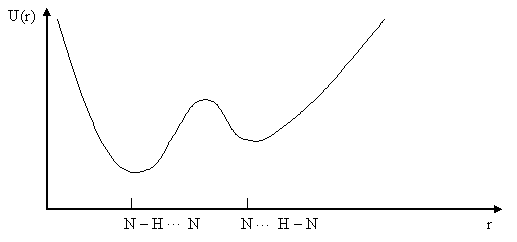
Рис. 3.4. Потенциальная функция водородной связи с двумя минимумами.
Как правило, значения энергии водородной связи лежит в пределах 12,6 – 33,6 кДж/моль. Экспериментальные данные показали, что потенциальная функция водородной связи имеет вид асимметричной кривой связи вдоль прямой линии, соединяющей атомы. Это кривая с двумя минимумами (рис.3.4.), локализованными вблизи электроотрицательных атомов.
Электростатическое (заряд-дипольное) взаимодействие. Этот вид взаимодействий не только дает вклад в энергию водородных связей, но и играет важную самостоятельную роль в стабилизации биоструктур. Различные атомы в пептидных цепочках сильно различаются по характеру распределения на них зарядов. Взаимодействие частично заряженных атомов характеризуется электростатическим потенциалом:
где: qi, qj – величины парциальных зарядов на атомах (i, j); rij – расстояние между атомами; ε – диэлектрическая постоянная, зависящая от поляризуемости атомов и их взаимного расположения (значение ее обычно принимается равным ~ 3,5). Величины парциальных зарядов на атомах определяются методами квантовой химии.
Учет электростатических взаимодействий наряду с ван-дер-ваальсовыми силами несколько изменяет расстояния между атомами и их стерическое положение в структуре биополимеров. Представление о точечной локализации зарядов на атомных центрах не позволяет учесть закономерности, связанные с объемным распределением зарядовой плотности. Сравнение зависимости энергии от расстояния для точечных зарядов и 1 s – электронных облаков атома водорода показывает совпадение на расстоянии 0,175 – 0,2 нм. То есть для атома водорода точечное приближение оправдано на расстояниях, составляющих 60-70 % от суммы ван-дер-ваальсовых радиусов.
Источник