Вопрос № 7. Межмолекулярное взаимодействие (силы Ван–дер-Ваальса). Водородная связь, ее природа и колич хар – ки. Меж- и внутримолекулярная водородная связь.
В 1873 г. голланд уч И. Ван-дер-Ваальс предположил, что существуют силы, обусловливающие притяжение м-у м-лами. Эти силы позднее получили название ваандервальсовых сил. Они включают в себя три составляющие: диполь-дипольное, индукционное и дисперстное взаимодействия.
Диполь-дипольное взаимодействие. При сближении полярных молекул они ориентируются таким образом, чтобы положительная сторона одного диполя была ориентирована к отрицательной стороне другого диполя.
Возникающее между диполями взаимодействие называется диполь-дипольным или ориентационным. Энергия диполь-дипольного взаимодействия пропорциональна электрическому моменту диполя в 4-ой степени и обратно пропорциональна расстоянию между центрами диполей в шестой степени и абсолютной температуре в первой степени.
Индукционное взаимодействие. Диполи могут воздействовать на неполярные молекулы, превращая их в индуцированные (наведенные) диполи. Между постоянными и наведенными диполями возникает притяжение, энергия которого пропорциональна электрическому моменту диполя во второй степени и обратно пропорциональна расстоянию между центрами молекул в шестой степени. Энергия индукционного взаимодействия возрастает с увеличением поляризуемости молекул, т.е. способности молекулы к образованию диполя под воздействием электрического поля. Величину поляризуемости выражают в единицах объема. Поляризуемость в однотипных молекулах растет с увеличением размера молекул. Энергия индукционного взаимодействия значительно меньше энергии диполь-дипольного взаимодействия.
Дисперсионное притяжение. В любой молекуле возникают флуктуации электрической плотности, в результате чего появляются мгновенные диполи, которые в свою очередь индуцируют мгновенные диполи у соседних молекул. Движение мгновенных диполей становится согласованным, их появление и распад происходит синхронно. В результате взаимодействия мгновенных диполей энергия системы понижается. Энергия дисперсионного взаимодействия пропорциональна поляризуемости молекул и обратно пропорциональна расстоянию между центрами частиц. Для неполярных молекул дисперсионное взаимодействие является единственной составляющей вандерваальсовых сил.
Энергия вандерваальсова взаимодействия. всех видов вандерваальсова взаимодействия обратно пропорциональна расстоянию между
центрами молекул в шестой степени. При сильном сближении молекул проявляются силы отталкивания между ними, которые обратно пропорциональны расстоянию между молекулами в двенадцатой степени. Поэтому зависимость результирующей энергии вандерваальсова взаимодействия Ев от рас-
стояния между молекулами, lв, выражается уравнением: Ев = -(а/ lв 6 ) + (b/ lв 12 ), где а и b — постоянные.
Минимальная энергия системы обеспечивается при расстояниях между центрами молекул 0,4 0,5 нм, т.е. существенно больше длины химической связи.
С увеличением размера молекул в ряду растет их поляризуемость и энергия дисперсион-
ного притяжения. Ориентационное взаимодействие вносит значительный вклад в вандерваальеовы силы лишь в случае молекул с большим электрическим моментом диполя. С увеличением суммарной энергии межмолякулярного взаимодействия возрастет температура кипения жидкостей, а также теплота их испарения.
Суммарная энергия вандерваальсового взаимодействия молекул на 1—2 порядка ниже энергии химических связей.
Химическая связь, образованная попожительно поляризованным водородом молекулы А-Н (или полярной группы—А-Н) и электроотрицательным атомом В другой или той жемолекулы, называется водородной связью. Если водородная связь образуется между разными молекулами, она называется межмолекулярной, если связь образуется между двумя группами одной и той же молекулы, то она называется внутримолекулярной.
Водородная связь между молекулами А-Н и В-R. обозначается тремя точками:
А – H + B – R → A – H … B – R водород в данном случае образует две химические связи, причем они не равноценны.
Образование водородной связи обусловлено тем, что в полярных молекулах А-Н или полярных группах -А-Н поляризованный атом водорода обладает уникальными свойствами: отсутствием внутренних электронных оболочек, значительным сдвигом электронной пары к атому с высокой электроотрицательностью и очень малым размером. Поэтому водород способен глубоко внедряться в электронную оболочку соседнего отрицательно поляризованного атома.
Атомы А и В могут быть одинаковыми, как при взаимодействии НF:
F δ — — H δ + + F δ — — H δ + → F – H … F – H, но могут быть и разными, как при взаимодействии воды и фтороводорода:
Энергия и длина водородной связи. Энергия водородной связи возрастает с увеличением электроотрицательности (ЭО) и уменьшением размеров атомов В. Поэтому наиболее прочные водородные связи возникают, когда в качестве атомов В выступают F, О или N.
Э нергия связи (кДж/моль) возрастает в ряду:
Несмотря на высокую ЭО у хлора, водородная связь – Н … С1 — носительно слабая из-за большого размера атома хлора.
Как видно, энергия водородной связи имеет промежуточное значение между энергией ковалентной связи и вандерваальсовых сил. Также промежуточные значения имеют длины водородных связей.
Т ак, в полимере (НF)n
длина связи F-Н = 0,092 нм, а связи F … Н — 0,14 нм. У воды длина связи O – H — 0,096 нм, а связи О … Н — 0,177 нм.
Влияние водородных связей на свойства веществ. При возникновении водородных связей образуются димеры, тримеры или полимерные структуры.
Соответственно в жидком состоянии молекулы вступающие в водородные связи, ассоциированы, а в твердом состоянии образуют сложные кристаллические структуры.
Образование межмолекулярных водородных связей приводит к существенному изменению свойств веществ: повышению вязкости, диэлектрической постоянной, температур кипения и плавления, теплот плавления и парообразования.
Внутримолекулярные водородные связи. Водородная связь может также возникнуть между атомами водорода и отрицательным атомами полярных групп в одной и той же молекуле.
Молекулы с внутримолекулярными водородными связями не могут вступать в межмолекулярные водородные связи. Поэтому вещества с такими связями не образуют ассоциатов, более летучи, имеют более низкие вязкости, температуры кипения и плавления, чем их изомеры, способные образовать межмолекулярную связь.
Значение водородных связей. Так как многие соединения содержат ковалентные полярные связи Н-0 и Н-N, то водородные связи очень распространены. Они проявляются не только в воде, но и в различных кристаллических веществах, полимерах, белках, живых организмах.
Важную роль водородные связи играют в белках, у которых спиральные полимерные структуры объединяются связями N-Н…0. Двойные спирали нуклеиновых кислот соединяются межмолекулярными водородными связями N-H…N и N-H…О.
Источник
3.2 Водородная связь. Заряд-дипольное взаимодействие
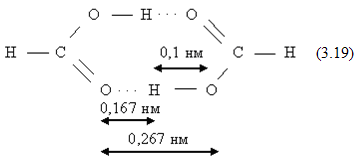
Водородная связь. Эта связь осуществляется между атомом водорода, химически связанном с одной молекулой и электроотрицательными атомами О, N, F, Cl и другими, принадлежащими той же или другой молекуле. В первом случае это будет внутримолекулярная связь, во втором – межмолекулярная. Природа водородной связи сложна и не сводится только к электростатическому притяжению, хотя оно дает основной вклад в энергию водородной связи. По данным структурного анализа кристаллов, расстояние между электроотрицательными атомами, связанными водородной связью, меньше ван-дер-ваальсовых радиусов соответствующих атомов. Например, сумма ван-дер-ваальсовых радиусов для пары атомов О ∙ ∙ ∙ О составляет 0,28 нм, а при образовании водородной связи О – Н ∙ ∙ ∙ О это расстояние сокращается до 0,27 – 0,25 нм. В димере уксусной кислоты (19) расстояние О – Н в гидроксигруппе равно 0,1 нм, длина водородной связи составляет 0,167 нм. Теплота димеризации муравьиной кислоты 59,22 кДж/моль, следовательно, на энергию водородной связи приходится 59,22/2 = 29,61 кДж/моль.
Наряду с электростатическим взаимодействием, ван-дер-ваальсовым притяжением и отталкиванием в энергию водородной связи UВОДОР вносит вклад и энергия делокализации UДЕЛОК двух электронов связи (А – Н) и неподеленной пары электронов другого электроотрицательного атома (В), что также уменьшает ее длину. Например, для связи О – Н ∙ ∙ ∙ О UВОДОР = UЭЛ-СТАТ + UДИСП + UДЕЛОК + UОТТ, что дает соответственно UВОДОР = ( – 25,2 – 12,6 – 33,6 + 35,28 ) = – 36,12 кДж/моль.
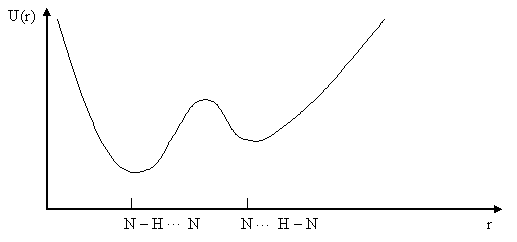
Рис. 3.4. Потенциальная функция водородной связи с двумя минимумами.
Как правило, значения энергии водородной связи лежит в пределах 12,6 – 33,6 кДж/моль. Экспериментальные данные показали, что потенциальная функция водородной связи имеет вид асимметричной кривой связи вдоль прямой линии, соединяющей атомы. Это кривая с двумя минимумами (рис.3.4.), локализованными вблизи электроотрицательных атомов.
Электростатическое (заряд-дипольное) взаимодействие. Этот вид взаимодействий не только дает вклад в энергию водородных связей, но и играет важную самостоятельную роль в стабилизации биоструктур. Различные атомы в пептидных цепочках сильно различаются по характеру распределения на них зарядов. Взаимодействие частично заряженных атомов характеризуется электростатическим потенциалом:
где: qi, qj – величины парциальных зарядов на атомах (i, j); rij – расстояние между атомами; ε – диэлектрическая постоянная, зависящая от поляризуемости атомов и их взаимного расположения (значение ее обычно принимается равным ~ 3,5). Величины парциальных зарядов на атомах определяются методами квантовой химии.
Учет электростатических взаимодействий наряду с ван-дер-ваальсовыми силами несколько изменяет расстояния между атомами и их стерическое положение в структуре биополимеров. Представление о точечной локализации зарядов на атомных центрах не позволяет учесть закономерности, связанные с объемным распределением зарядовой плотности. Сравнение зависимости энергии от расстояния для точечных зарядов и 1 s – электронных облаков атома водорода показывает совпадение на расстоянии 0,175 – 0,2 нм. То есть для атома водорода точечное приближение оправдано на расстояниях, составляющих 60-70 % от суммы ван-дер-ваальсовых радиусов.
Источник
3. Водородная связь
Водородная связь — это взаимодействие, возникающее между положительно заряженным атомом водорода и намного более электроотрицательным атомом, чаще всего кислорода, азота или фтора.
Это взаимодействие в несколько раз сильнее межмолекулярных сил, но в десять — пятнадцать раз слабее ковалентной связи.
Водородная связь образуется за счёт электростатического притяжения заряженных атомов, а также некоторый вклад в её возникновение вносит донорно-акцепторное взаимодействие. Из-за поляризации у атома водорода частично освобождается электронная орбиталь, а в атомах фтора, кислорода и азота есть пары электронов. Атом водорода выступает акцептором электронов, атом другого неметалла — их донором.
Водородная связь бывает межмолекулярной (в воде, аммиаке, фтороводороде, спиртах, карбоновых кислотах), а также внутримолекулярной (в многоатомных спиртах, белках, нуклеиновых кислотах).
Водородная связь значительно повышает температуры кипения и плавления веществ, а также их взаимную растворимость.
Рассмотрим влияние водородной связи на температуры кипения водородных соединений неметаллов \(IV\)–\(VII\) групп.
Температуры кипения зависят от молекулярных масс веществ и должны возрастать в каждом ряду. Но для воды, аммиака и фтороводорода эти значения температур не подчиняются общей закономерности. Причина такого явления — возникновение водородной связи.
Водородная связь образуется не только между одинаковыми молекулами, но и между разными. Например, такая связь возникает между молекулами спиртов и воды, что обуславливает их способность смешиваться друг с другом. Так, метанол, этанол, пропанол, этиленгликоль, глицерин растворяются в воде неограниченно благодаря образованию водородных связей.
Водородные связи широко встречаются в природе и оказывают значительное влияние на свойства веществ. Они значительно повышают температуры плавления и кипения веществ, влияют на их растворимость в воде.
Благодаря образованию водородных связей вода, метанол, этанол, уксусная кислота и многие другие вещества при обычных условиях находятся в жидком состоянии.
Водородные связи обуславливают вторичную (спиралевидную) структуру белков, а также соединяют две комплементарные цепи ДНК в единое целое.
Источник