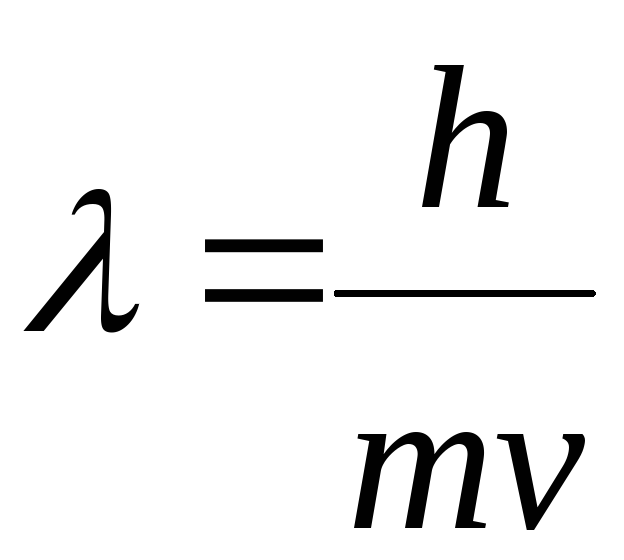- 2.4. Двойственная природа электрона
- 2.5. Квантово – механическая модель атома
- Вопрос № 3 Двойственная природа электрона. Корпускулярные и волновые свойства электрона. Уравнение де Бройля.
- 13)Квантово-механическая модель атома. Двойственная природа электрона. Квантовые числа. Атомные электронные орбитали. Принцип Паули. Правило Гунда.
- 14)Строение многоэлектронных атомов. Правила и порядок заполнения атомных орбиталей электронами. Правило Клечковского.
2.4. Двойственная природа электрона
В 1905 г. А. Эйнштейн предсказал, что любое излучение представляет собой поток квантов энергии, называемых фотонами. Из теории Эйнштейна следует, что свет имеет двойственную (корпускулярно-волновую) природу.
В 1924 г. Луи де Бройль (Франция) выдвинул предположение, что электрон также характеризуется корпускулярно-волновым дуализмом. Позднее это было подтверждено на опытах по дифракции на кристаллах. Де Бройль предложил уравнение, связывающее длину волны λ электрона или любой другой частицы с массой т и скоростью ν,
Волны частиц материи де Бройль назвал материальными волнами. Они свойственны всем частицам или телам. Однако, как следует из уравнения (5), для микротел длина волны настолько мала, что в настоящее время не может быть обнаружена. Так, для тела с массой 1000 кг, двигающегося со скоростью 108 км/ч (30 м/с)
В 1927 г. В. Гейзенберг (Германия) постулировал принцип неопределенности, согласно которому положение и импульс движения субатомной частицы (микрочастицы) принципиально невозможно определить в любой момент времени с абсолютной точностью. В каждый момент времени можно определить только лишь одно из этих свойств. Э. Шредингер (Австрия) в 1926 г. вывел математическое описание поведения электрона в атоме.
Работы Планка, Эйнштейна, Бора, де Бройля, Гейзенберга, а также Шредингера, предложившего волновое уравнение, заложили основу квантовой механики, изучающей движение и взаимодействие микрочастиц.
2.5. Квантово – механическая модель атома
В настоящее время строение атома рассматривается с позиций квантовой или волновой механики, в основе которой лежит представление о двойственной природе электрона: электрон, как и любая частица микромира, обладает одновременно свойствами частицы (массой m и скоростью передвижения v) и свойствами волны (длиной волны ):
где: h – постоянная Планка, наименьший квант энергии лучеиспускания.
Волновая механика описывает движение электрона в атоме как распространение волны по всему объему атома. Каждое мгновение электрон может находиться в любой части пространства вокруг ядра.
Путь, описываемый электроном, сливается в расплывчатое электронное облако, в котором плотность отрицательного заряда соответствует вероятности обнаружения электрона.
Плотность электронного облака максимальна на некотором расстоянии от ядра и характеризует удаленность электрона от ядра и запас его энергии. Состояние электрона в атоме математически описывается волновым уравнением.
Представление об электронном облаке – это квантово-механическая модель электрона в атоме. Понятию «электронное облако» соответствуют также понятия «атомная орбиталь», «квантовая ячейка», «энергетическая ячейка». Электронные облака (атомные орбитали) могут быть разного размера, различной формы, по-разному ориентированы в пространстве. Все это соответствует определенному энергетическому состоянию электрона.
В многоэлектронных атомах все электроны распределяются по энергетическим уровням (электронным слоям или электронным оболочкам). В пределах энергетического уровня электроны распределяются по подуровням (подоболочкам). Полная характеристика каждого электрона определяется значениями четырех квантовых чисел. Многоэлектронный атом подчиняется принципу Паули (1925 г.): в атоме не может быть двух электронов с одинаковыми значениями всех четырех квантовых чисел:
1. Главное квантовое число (n) характеризует энергетический уровень и отражает размеры электронного облака. n принимает значения целых чисел 1, 2, 3, 4, 5, 6, 7… (или в буквенном изображении K, L, M, N, O, P, Q…). С увеличением n (удалением электрона от ядра) энергия электрона возрастает. Число энергетических уровней в невозбужденном атоме равно номеру периода, в котором находится элемент в периодической системе. Например, электроны атома натрия распределяются по трем уровням, которым соответствуют значения главного квантового числа n=1 (K), n=2 (L), n=3 (M).
2. Орбитальное квантовое число l характеризует энергетический подуровень и отражает форму электронного облака. Усложнение формы электронного облака связано с возрастанием энергии электрона. Орбитальное квантовое число может изображаться буквами s, p, d, f или цифрами, которые в пределах данного энергетического уровня (с данным значением n) могут принимать целочисленные значения от 0 до (n-1).
Для обозначения подуровня указывают цифрой главное квантовое число (т.е. обозначают, в каком уровне находится электрон и каков размер его электронного облака) и буквой указывают орбитальное квантовое число (т.е. характеризуют форму этого облака). например, подуровни 1s, 2s, 2p, 4s, 3d, 5f и т.д.
Источник
Вопрос № 3 Двойственная природа электрона. Корпускулярные и волновые свойства электрона. Уравнение де Бройля.
В 1913г. Нильс Бор предложил теорию строения атома водорода, в которой связал планетарную модель атома с квантовой теорией излучения Планка и учения Эйнштейна о световых квантах. Бор показал, что если квантуется вся энергия, то энергия электрона тоже должна квантоваться.
В 1900 Планк доказал, что чистая энергия излучается квантом, энергия одного кванта рассчитывается по простой формуле.
E=h , где h-постоянная Планка, v-частота квантовой колебаний: h=6,626 10 -34 Дж*Сек.
С= * Е= =
E =mc 2 mc 2 = =
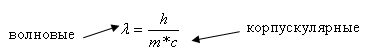
Волновые — = — корпускулярные
Уравнение показывает корпускулярные – волновые свойства фотона
В своих постулатах Бор учитывал, что энергия электрона в атоме изменяется скачкообразно – дискретно.
1. Электрон вращается вокруг ядра не по любым орбитам, а по стационарным, радиусы которых относятся к квадрату целых чисел.
2. Двигаясь по стационарной орбите электрон энергию не излучает и не поглощает, он находится в основном состоянии r1=0,053 Hм.
3. Излучение или помещение энергии происходит, при переходе электрона с одной орбиты на другую.
∆Е=Ен-Ек ∆Е=h =
После постулатов Бора появился новый раздел в физике, изучающий свойства и поведения частиц микромира (с малой массой) это так называемая квантовая или волновая механика.
Дополнение к постулатом Бора Зоммерфельд предложении эллипсовидные орбитами
Квантовая механика основывается на представлениях о квантовании энергии, волновом характере движения микрочастиц вероятностном методе описания микрообъектов.
Основное уравнение квантовой механики — двойственная природа фотонов
В 1924 г. Луи де Бройль применил это уравнение для описания поведения электрона.
Заменив скорость света на скорость движения электрона, таким образом было доказано, что электрон обладит корпускулярно-волновыми свойствами
Частица m=1гр, v=5м/сек, 1,3*10 -31 м=1,3*10 -29 см
В 1927 году Девиссон и Джермер (США) Томсон (Англия), Тарковский (Россия) обнаружили независимо друг от друга дифракцию и интерференцию у электронов.
Электрон обладает дуализмом – это одновременно и частица и волна. Учесть двойственную природу электрона позволяет принцип неопределенности Гейзенберга невозможно одновременно определимо точно и скорость движения электрона и его координаты.
, v – скорость движения , q – координаты
В связи с этим в квантовой механике состояние микрочастицы описывается не ее координатой и скоростью, а каждого функций (пси) (волновая функция).
Квантовая механика отказывается от уточнения положения электрона в пространстве е и заменяет это понятие вероятностью пребывания электрона в данной точке около ядерного пространства.
= (x,y,z)
В качестве модели состояния электронов в атоме в квантовой механике принято представление об электронном облаке.
Плотность соответствующих участков которого пропорциональна вероятности нахождение там электрона.
П ространство вокруг ядра в котором наиболее вероятно пребывание электрона называется орбиталь.
Исходя из представления о наличии у электрона волновых свойств. Шредингер в 1925 г. предположил, что состояние движущегося в атоме электрона должно описываться известным в физике уравнением стоячей электромагнитной волны. Подставив в это уравнение вместо длины волны ее значение из уравнения де Бройля, он получил новое уравнение, связывающее энергию электрона с пространственными координатами в этом уравнении амплитуде трехмерного волнового процесса.
Особенно важное значение для характеристики состояния электрона имеет волновая функция . Подобно амплитуде любого волнового процесса, она может принимать как положительные, так и отрицательные значения. Однако величина в данной области пространства, тем выше вероятность, того, что электрон проявит здесь своё действие, т. е. что его существование будет обнаружено в каком-либо физическом процессе.
Более точным будет следующее утверждение: вероятность обнаружения электрона в некотором малом объеме выражается произведением .Таким образом сама величина выражает плотность вероятности нахождения электрона в соответствующей области пространства.
Для электрона, находящегося под действием сил притяжения к ядру, уравнение Шледингера имеет решение не при любых, а только при определенных значениях энергии. Таким образом, квантованность энергетических состояний электрона в атоме оказывается следствие5м присущих электрону волновых свойств и не требует введения особых постулатов.
Источник
13)Квантово-механическая модель атома. Двойственная природа электрона. Квантовые числа. Атомные электронные орбитали. Принцип Паули. Правило Гунда.
В 1924г. Луи де Бройль выдвинул предположение, что электрон характеризуется корпускулярно-волновым дуализмом. Позднее это было подтверждено на опытах по дифракции на кристаллах. Де Бройль предложил уравнение, связывающее длину волны электрона или любой другой частицы массой m и скоростью V: . Волны частиц материи де Бройль называл материальными волнами.
В 1927г. Гейзенберг постулировал принцип неопределенности, согласно которому положение и импульс движения субатомной частицы принципиально невозможно определить с абсолютной точностью. А Шредингер в 1926г. Вывел математическое описание поведения электрона в атоме.
В квантово-механической модели атома используют вероятностный подход для характеристики положения электрона. Вероятность нахождения описывается волновой функцией , которая характеризует амплитуду волны, как функцию координат электрона. В наиболее простом случае эта функция зависит от трех координат и называется орбиталью. Орбиталью называется область пространства, в котором наиболее вероятно нахождение электрона. Так как электрон несет отрицательный заряд, то его орбиталь представляет собой определенное распределение заряда, которое получило название электронного облака.
Для характеристики поведения электрона в атоме введены квантовые числа: главное, орбитальное, магнитное и спиновое.
Главное квантовое число (n) – характеризует размеры атома и количество энергии на уровне, принимает значения от 1 до 7.
Орбитальное квантовое число(L) – определяет энергию на подуровне и форму электронного облака от 0 до n-1.
Магнитное квантовое число(m) – определяет положение орбитали в пространстве т.е. момент т. е. направление в котором вытянуто электронное облако от –L,0,L.
Спиновое квантовое число ( ) – характеризует крутящийся момент, возникающий при вращении электрона вокруг оси .
Принцип Паули: В атоме не может быть двух электронов, с одинаковым значением квантовых чисел. Т.е. а не или .
Правило Гунда: электроны заполняются таким образом, что бы спин был максимальным. Сначала , потом .
14)Строение многоэлектронных атомов. Правила и порядок заполнения атомных орбиталей электронами. Правило Клечковского.
Запись распределения электронов в атоме по оболочкам, подоболочкам и орбиталям, называется электронная конфигурация элемента.
Цифрами обозначают главное квантовое число, буквами подоболочки (s,p,d,f), а степень обозначает число электронов в подоболочки (1s 1) .
В многоэлектронных атомах электроны испытывают не только притяжение ядер, но и отталкивание от других электронов, экранирующих их от ядра атома, поэтому последовательность возрастания энергии орбиталей усложняется.
При составлении электронных конфигураций многоэлектронных атомов учитывают: принцип минимальной энергии, принцип Паули, правила Гунда и Клечковского.
Принцип min энергии: электроны заполняют орбитали в порядке повышения уровня энергии орбиталей.
Принцип запрета Паули: в атоме не может быть двух электронов, обладающих одинаковым набором квантовых чисел: n, l, m, ms. Следовательно, на каждой атомной орбитали может быть не более 2 электронов, причем они должны иметь противоположные спины: .
Правило Гунда: электроны заполняются таким образом, что бы спин был максимальным. Сначала , потом .
Правило Клечковского: последовательность заполнения электронами энергетических подуровней происходит в порядке возрастания ∑n+l, а при равной сумме – в порядке возрастания значения главного квантового числа n.
Исключение составляют некоторые атомы, у которых наблюдается отклонение от правила Клечковского (провал электронов): Cu, Ag, Cr, Mo, Pd, Pt и др.
Основной характеристикой атома, определяющей его поведение в химических реакциях, а также свойства простых веществ, является строение внешнего (и частично – предвнешнего) энергетического уровня атома, число неспаренных (валентных) электронов и их энергия относительно ядра атома.
Источник