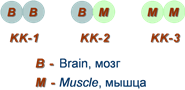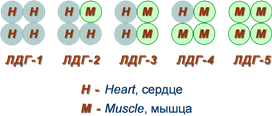Ферменты имеют белковую природу
Давно выяснено, что все ферменты являются белками и обладают всеми свойствами белков. Поэтому, подобно белкам, ферменты делятся на простые и сложные.
Простые ферменты состоят только из аминокислот – например, пепсин , трипсин, лизоцим.
Сложные ферменты ( холоферменты ) имеют в своем составе белковую часть, состоящую из аминокислот – апофермент , и небелковую часть – кофактор . Примером сложных ферментов являются сукцинатдегидрогеназа (содержит ФАД), аминотрансферазы (содержат пиридоксальфосфат), различные пероксидазы (содержат гем), лактатдегидрогеназа (содержит Zn 2+ ), амилаза (содержит Ca 2+ ).
Кофактор, в свою очередь, может называться коферментом (НАД + , НАДФ + , ФМН, ФАД, биотин) или простетической группой (гем, олигосахариды, ионы металлов Fe 2+ , Mg 2+ , Ca 2+ , Zn 2+ ).
Деление на коферменты и простетические группы не всегда однозначно:
• если связь кофактора с белком прочная, то в этом случае говорят о наличии простетической группы,
• но если в качестве кофактора выступает производное витамина – то его называют коферментом, независимо от прочности связи.
Для осуществления катализа необходим полноценный комплекс апобелка и кофактора, по отдельности катализ они осуществить не могут. Кофактор входит в состав активного центра, участвует в связывании субстрата или в его превращении.
Как многие белки, ферменты могут быть мономерами, т.е. состоять из одной субъединицы, и полимерами, состоящими из нескольких субъединиц.
Структурно-функциональная организация ферментов
В составе фермента выделяют области, выполняющие различную функцию:
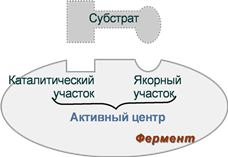
1. Активный центр – комбинация аминокислотных остатков (обычно 12-16), обеспечивающая непосредственное связывание с молекулой субстрата и осуществляющая катализ. Аминокислотные радикалы в активном центре могут находиться в любом сочетании, при этом рядом располагаются аминокислоты, значительно удаленные друг от друга в линейной цепи. В активном центре выделяют два участка:
- якорный (контактный, связывающий) – отвечает за связывание и ориентацию субстрата в активном центре,
- каталитический – непосредственно отвечает за осуществление реакции.
Схема строения ферментов
У ферментов, имеющих в своем составе несколько мономеров, может быть несколько активных центров по числу субъединиц. Также две и более субъединицы могут формировать один активный центр.
У сложных ферментов в активном центре обязательно расположены функциональные группы кофактора. Например, в реакции превращения пировиноградной кислоты (пируват) в молочную кислоту (лактат) сначала к апоферменту лактатдегидрогеназы присоединяется НАД, формируется активный центр, и только потом входит пируват.
Схема формирования сложного фермента
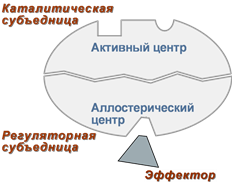
2. Аллостерический центр (allos – чужой) – центр регуляции активности фермента, который пространственно отделен от активного центра и имеется не у всех ферментов. Связывание с аллостерическим центром какой-либо молекулы, называемой активатором или ингибитором (или эффектором, модулятором, регулятором), вызывает изменение конфигурации белка-фермента и, как следствие, скорости ферментативной реакции.
Аллостерические ферменты являются полимерными белками, активный и регуляторный центры находятся в разных субъединицах.
Схема строения аллостерического фермента
В качестве такого регулятора может выступать продукт данной или одной из последующих реакций, субстрат реакции или иное вещество (см «Регуляция активности ферментов»).
Изоферменты
Изоферменты – это молекулярные формы одного и того же фермента, возникшие в результате небольших генетических различий в первичной структуре фермента, но катализирующие одну и ту же реакцию. Изоферменты отличаются сродством к субстрату, максимальной скоростью катализируемой реакции, чувствительностью к ингибиторам и активаторам, условиями работы (оптимум pH и температуры).
Как правило, изоферменты имеют четвертичную структуру, т.е. состоят из двух или более субъединиц. Например, димерный фермент креатинкиназа (роль КК) представлен тремя изоферментными формами, составленными из двух типов субъединиц: M (англ. muscle – мышца) и B (англ. brain – мозг). Креатинкиназа-1 (КК-1) состоит из субъединиц типа B и локализуется в головном мозге, креатинкиназа-2 (КК-2) – по одной М- и В-субъединице, наиболее активна в миокарде, креатинкиназа-3 (КК-3) содержит две М-субъединицы, специфична для скелетной мышцы. Определение активности разных изоферментов КК в сыворотке крови имеет клинико-диагностическое значение.
Необходимо понимать, что хотя в головном мозге активность креатинкиназы ВВ составляет все 100%, ее высокая активность обнаружена также в стенке желудка и почках. В скелетных мышцах имеется только креатинкиназа ММ (100%), но довольно высока ее активность также в печени и в сердце. Креатинкиназа МВ в сердце составляет лишь 22% от общей креатинкиназной активности, в большем количестве здесь имеется КК ММ, но зато в других тканях креатинкиназы МВ практически нет.
Изоферменты креатинкиназы
Изоферменты лактатдегидрогеназы
Также существует пять изоферментов лактатдегидрогеназы (роль ЛДГ) – фермента, участвующего в обмене глюкозы. Отличия между ними заключаются в разном соотношении субъединиц Н (англ. heart – сердце) и М (англ. muscle – мышца). Лактатдегидрогеназы типов 1 (Н4) и 2 (H3M1) присутствуют в тканях с аэробным обменом (миокард, мозг, корковый слой почек), обладают высоким сродством к молочной кислоте (лактату) и превращают его в пируват. Изоферменты ЛДГ-4 (H1M3) и ЛДГ-5 (М4) находятся в тканях, склонных к анаэробному обмену (печень, скелетные мышцы, кожа, мозговой слой почек), обладают низким сродством к лактату и катализируют превращение пирувата в лактат. В тканях с промежуточным типом обмена (селезенка, поджелудочная железа, надпочечники, лимфатические узлы) преобладает ЛДГ-3 (H2M2). Определение активности разных изоферментов ЛДГ в сыворотке крови имеет клинико-диагностическое значение.
Еще одним примером изоферментов является группа гексокиназ, которые присоединяют фосфатную группу к моносахаридам гексозам и вовлекают их в реакции клеточного метаболизма. Из четырех изоферментов выделяется гексокиназа IV (глюкокиназа), которая отличается от остальных изоферментов высокой специфичностью к глюкозе, низким сродством к ней и нечувствительностью к ингибированию продуктом реакции.
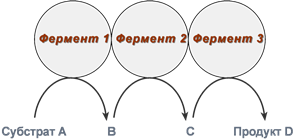
Мультиферментные комплексы
В мультиферментном комплексе несколько ферментов прочно связаны между собой в единый комплекс и осуществляют ряд последовательных реакций, в которых продукт реакции непосредственно передается на следующий фермент и является только его субстратом. Возникает туннельный эффект, т.е. субстрат попадает в созданный ферментами «туннель». В результате промежуточные метаболиты избегают контакта с окружающей средой, снижается время их перехода к следующему активному центру и значительно ускоряется скорость реакции.
Строение мульферментного комплекса
- пируватдегидрогеназный комплекс (пируватдегидрогеназа), превращающий пируват в ацетил-SКоА,
- α-кетоглутаратдегидрогеназный комплекс (в цикле трикарбоновых кислот) превращающий α-кетоглутарат в сукцинил-SКоА,
- комплекс под названием «синтаза жирных кислот» (или пальмитатсинтаза), синтезирующий пальмитиновую кислоту
- карбамоилфосфатсинтетаза, первый фермент синтеза мочевины в печени и синтеза пиримидиновых оснований
Абзимы
Абзимами называются антитела , имеющие каталитическую функцию (англ. abzymes, antibodies as enzymes) и катализирующие конкретные реакции. Такая способность возникает в результате формирования промежуточного продукта при связывании антитела с антигеном (имитация переходного комплекса E-X ферментативной реакции).
Источник
6. Белок-белковое взаимодействие
Термин белок-белковое взаимодействие обозначает ситуацию, когда в качестве регулятора выступают не метаболиты биохимических процессов, а специфичные белки. В целом ситуация схожа с аллостерическим механизмом: после влияния каких-либо факторов на специфичные белки изменяется активность этих белков, и они, в свою очередь, воздействуют на нужный фермент.
7. Ковалентная (химическая) модификация
Ковалентная модификация заключается в обратимом присоединении или отщеплении определенной группы, благодаря чему изменяется активность фермента. Чаще всего такой группой является фосфорная кислота, реже метильные и ацетильные группы. Фосфорилирование фермента происходит по остаткам серина и тирозина. Присоединение фосфорной кислоты к белку осуществляют ферменты протеинкиназы, отщепление – протеинфосфатазы.
Ферменты могут быть активны как в фосфорилированном, так и в дефосфорилированном состоянии. Например, в мышцах ферменты гликогенфосфорилазаи гликогенсинтаза
- при нагрузке фосфорилируются, при этом фосфорилаза гликогена становится активной и начинает расщепление гликогена и сжигание глюкозы, а гликогенсинтаза при этом неактивна.
- во время отдыха при синтезе гликогена оба фермента дефосфорилируются, синтаза при этом становится активной, фосфорилаза – неактивной.
11, Уровни структурной организации ферментов
- Все ферменты — белковой природы.
- Ферменты обладают высокой молекулярной массой.
- Они хорошо растворимы в воде, при растворении образуют коллоидные растворы.
- Все ферменты — термолабильны, т.е. оптимум действия 35 – 45 о С
- По химическим свойствам являются амфотерными электролитами.
- Ферменты высокоспецифичны по отношению к субстратам.
- Ферменты для своего действия требуют строго определенного значения рН (пепсин 1.5 – 2.5).
- Ферменты обладают высокой каталитической активностью (ускоряют скорость реакции в 10 6 – 10 11 раз).
- Все ферменты способны к денатурации по воздействием сильных кислот, щелочей, спиртов, солей тяжелых металлов.
- Оксидоредуктазы – катализируют окислительно-восстановительные реакции.
- Трансферазы – переносят ту или иную функциональную группу от одного субстрата на другой.
- Гидролазы – также участвуют в переносе групп, однако акцептором всегда является молекула воды.
- Лиазы (синтазы) – катализируют расщепление или образование химических соединений или образование химических связей, при этом образуются или исчезают двойные связи.
- Изомеразы – перемещают группы в пределах одной молекулы.
- Лигазы (синтетазы) – катализируют энергозависимые реакции присоединения и поэтому их действие сопряжено с гидролизом АТФ.
- Оксидоредуктазы – катализируют окислительно-восстановительные реакции.
- Трансферазы – переносят ту или иную функциональную группу от одного субстрата на другой.
- Гидролазы – также участвуют в переносе групп, однако акцептором всегда является молекула воды.
- Лиазы (синтазы) – катализируют расщепление или образование химических соединений или образование химических связей, при этом образуются или исчезают двойные связи.
- Изомеразы – перемещают группы в пределах одной молекулы.
- Лигазы (синтетазы) – катализируют энергозависимые реакции присоединения и поэтому их действие сопряжено с гидролизом АТФ.
Источник