Вторичная структура белка двояка
Вторичная структура белка – это способ укладки полипептидной цепи в более компактную структуру, при которой происходит взаимодействие пептидных групп с образованием между ними водородных связей.
Формирование вторичной структуры вызвано стремлением пептида принять конформацию с наибольшим количеством связей между пептидными группами. Тип вторичной структуры зависит от устойчивости пептидной связи, подвижности связи между центральным атомом углерода и углеродом пептидной группы, размером аминокислотного радикала. Все указанное вкупе с аминокислотной последовательностью впоследствии приведет к строго определенной конфигурации белка.
Выделяют два возможных варианта вторичной структуры: в виде «каната» – α-спираль (α-структура), и в виде «гармошки» – β-складчатый слой (β-структура). В одном белке, как правило, одновременно присутствуют обе структуры, но в разном долевом соотношении. В глобулярных белках преобладает α-спираль, в фибриллярных – β-структура.
Вторичная структура образуется только при участии водородных связей между пептидными группами: атом кислорода одной группы реагирует с атомом водорода второй, одновременно кислород второй пептидной группы связывается с водородом третьей и т.д.
Участие водородных связей в формировании вторичной структуры
Укладка белка в виде α-спирали
α-Спираль
Данная структура является правозакрученной спиралью, образуется при помощи водородных связей между пептидными группами 1-го и 4-го, 4-го и 7-го, 7-го и 10-го и так далее аминокислотных остатков.
Формированию спирали препятствуют пролин и гидроксипролин, которые из-за своей циклической структуры обусловливают «перелом» цепи, т.е. ее принудительный изгиб как, например, в коллагене.
Высота витка спирали составляет 0,54 нм и соответствует высоте 3,6 аминокислотных остатков, 5 полных витков соответствуют 18 аминокислотам и занимают 2,7 нм.
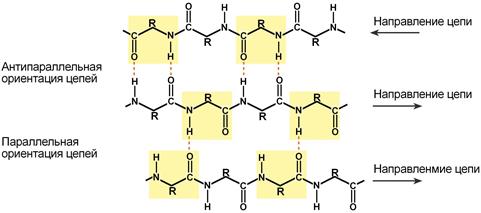
β-Складчатый слой
В этом способе укладки белковая молекула лежит «змейкой», удаленные отрезки цепи оказываются поблизости друг от друга. В результате пептидные группы ранее удаленных аминокислот белковой цепи способны взаимодействовать при помощи водородных связей.
Укладка белка в виде β-складчатого слоя
Под направлением белковой цепи понимают направление от N-конца (N-концевой аминокислоты) к C-концу (С-концевой аминокислоте).
Ориентация реагирующих участков может быть параллельна (когда соседние цепи идут в одном направлении) или антипараллельна (цепи идут в противоположном направлении). Таких взаимодействующих друг с другом участков одного белка может быть от двух до пяти.
Источник
Строение белков. Структуры белков
Название «белки» происходит от способности многих из них при нагревании становиться белыми. Название «протеины» происходит от греческого слова «первый», что указывает на их важное значение в организме. Чем выше уровень организации живых существ, тем разнообразнее состав белков.
Белки образуются из аминокислот, которые соединяются между собой ковалентной – пептидной связью: между карбоксильной группой одной аминокислоты и аминогруппой другой. При взаимодействии двух аминокислот образуется дипептид (из остатков двух аминокислот, от греч. пептос – сваренный). Замена, исключение или перестановка аминокислот в полипептидной цепи вызывает возникновение новых белков. Например, при замене лишь одной аминокислоты (глутамина на валин) возникает тяжелая болезнь – серповидно-клеточная анемия, когда эритроциты имеют другую форму и не могут выполнять свои основные функции (перенос кислорода). При образовании пептидной связи отщепляется молекула воды. В зависимости от количества аминокислотных остатков выделяют:
– олигопептиды (ди-, три-, тетрапептиды и т. п.) – содержат до 20 аминокислотных остатков;
– полипептиды – от 20 до 50 аминокислотных остатков;
– белки – свыше 50, иногда тысячи аминокислотных остатков
По физико-химическим свойствам различают белки гидрофильные и гидрофобные.
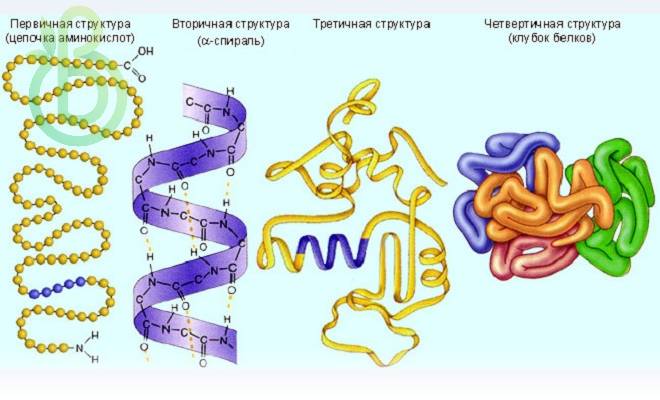
Существуют четыре уровня организации белковой молекулы – равноценные пространственные структуры (конфигурации, конформации) белков: первичная, вторичная, третичная и четвертичная.
Первичная структура
Первичная структура белков является простейшей. Имеет вид полипептидной цепи, где аминокислоты связаны между собой прочной пептидной связью. Определяется качественным и количественным составом аминокислот и их последовательностью.
Вторичная структура
Вторичная структура образована преимущественно водородными связями, которые образовались между атомами водорода NH-группы одного завитка спирали и кислорода СО-группы другого и направлены вдоль спирали или между параллельными складками молекулы белка. Белковая молекула частично или целиком скручена в α-спираль или образует β-складчатую структуру. Например, белки кератина образуют α-спираль. Они входят в состав копыт, рогов, волос, перьев, ногтей, когтей. β-складчатую имеют белки, которые входят в состав шелка. Извне спирали остаются аминокислотные радикалы (R-группы). Водородные связи значительно более слабые, чем ковалентные, но при значительном их количестве образуют довольно прочную структуру.
Функционирование в виде закрученной спирали характерно для некоторых фибриллярных белков – миозин, актин, фибриноген, коллаген и т. п.
Третичная структура
Третичная структура белка. Эта структура постоянна и своеобразна для каждого белка. Она определяется размером, полярностью R-групп, формой и последовательностью аминокислотных остатков. Полипептидная спираль закручивается и укладывается определенным образом. Формирование третичной структуры белка приводит к образованию особой конфигурации белка – глобулы (от лат. globulus – шарик). Его образование обуславливается разными типами нековалентных взаимодействий: гидрофобные, водородные, ионные. Между остатками аминокислоты цистеина возникают дисульфидные мостики.
Гидрофобные связи – это слабые связи между неполярными боковыми цепями, которые возникают в результате взаимного отталкивания молекул растворителя. При этом белок скручивается так, что гидрофобные боковые цепи погружены вглубь молекулы и защищают ее от взаимодействия с водой, а снаружи расположены боковые гидрофильные цепи.
Третичную структуру имеет большинство белков – глобулины, альбумины и т. п.
Четвертичная структура
Четвертичная структура белка. Образуется в результате объединения отдельных полипептидных цепей. В совокупности они составляют функциональную единицу. Типы связей разные: гидрофобные, водородные, электростатические, ионные.
Электростатические связи возникают между электроотрицательными и электроположительными радикалами аминокислотных остатков.
Для одних белков характерно глобулярное размещение субъединиц – это глобулярные белки. Глобулярные белки легко растворяются в воде или растворах солей. К глобулярным белкам принадлежит свыше 1000 известных ферментов. К глобулярным белкам относятся некоторые гормоны, антитела, транспортные белки. Например, сложная молекула гемоглобина (белка эритроцита крови) является глобулярным белком и состоит из четырех макромолекул глобинов: двух α-цепей и двух β-цепей, каждая из которых соединена с гемом, содержащим железо.
Для других белков характерно объединение в спиральные структуры – это фибриллярные (от лат. fibrilla – волоконце) белки. Несколько (от 3 до 7) α–спиралей свиваются вместе, подобно волокнам в кабеле. Фибриллярные белки нерастворимы в воде.
Белки делят на простые и сложные.
Простые (протеины)
Состоят только из остатков аминокислот. К простым белкам относят глобулины, альбумины, глутелины, проламины, протамины, пистоны. Альбумины (например, альбумин сыворотки крови) растворимы в воде, глобулины (например, антитела) нерастворимы в воде, но растворимы в водных растворах некоторых солей (хлорид натрия и т. п.).
Сложные (протеиды)
Включают в состав, кроме остатков аминокислот, соединения другой природы, которые называются простетическою группой. Например, металлопротеиды – это белки, содержащие негеминовое железо или связанные атомами металлов (большинство ферментов), нуклеопротеиды – белки, соединенные с нуклеиновыми кислотами (хромосомы и т. п.), фосфопротеиды –белки, в состав которых входят остатки фосфорной кислоты (белки яичного желтка и т. п.), гликопротеиды –белки в соединении с углеводами (некоторые гормоны, антитела и т. п.), хромопротеиды – белки, содержащий пигменты (миоглобин и т. п.), липопротеиды – белки, содержащие липиды (входят в состав мембран).
Источник
1. 5. 2. Вторичная структура белков
Вторичная структура — регулярно повторяющаяся форма укладки полипептидной цепи в пространстве. Чаще всего в белках встречается 2 вида вторичной структуры: α — спираль и β – складчатая структура.
α – спираль в 1951 году изучена Л. Полингом с помощью рентгеноструктурного метода. Она представляет собой правозакрученную спиральную структуру, в одном витке которой укладывается 3,6 аминокислоты. Шаг спирали (расстояние между соседними витками) составляет 0,54 н.м. α — спираль фиксируется водородными связями, которые замыкаются между пептидными связями, образованными каждой 4-ой аминокислотой. Вторичная α — структура укладывается самопроизвольно и определяется первичной структурой белка. Доля участков, уложенных в спиральную структуру, в различных белках различна. Например, в гемоглобине, миоглобине преобладает α — структурная укладка, которая в 4 раза уменьшает размеры белковой молекулы.
β – структура имеет вид «гармошки» и стабилизируется водородными связями между удалёнными участками одной полипептидной цепи или между несколькими полипептидными цепями. Выделяют параллельные β – структуры, в которых N и С-концы соответствуют друг другу, и антипараллельные структуры. Примером белков, содержащих преимущественно β – структуры, являются фиброин шёлка, иммуноглобулины.
Вторичная структура белков (А — α – спираль, Б — β – структура)
Вторичную структуру изучают методами рентгеноструктурного анализа, исследованием поглощения белком ультрафиолетовых лучей (чем больше доля α – структур, тем больше поглощение).
Вторичная структура белков разрушается при денатурации.
1. 5. 3. Третичная структура белков
Третичная структура — специфическая для каждого белка форма укладки полипептидной цепи в пространстве. Данная структура формируется самопроизвольно и определяется первичной структурой. Третичная структура значительно, в десятки раз увеличивает компактность белка. В формировании третичной структуры участвуют нековалентные связи (гидрофобные, ионные) и ковалентные (дисульфидные) связи, изображённые на рисунке.
Третичная структура определяет биологическую активность и некоторые физико-химические свойства белков. Изменения в третичной структуре белка отражается на его биологической активности.
Методами изучения третичной структуры являются рентгеноструктурный анализ и определение химической доступности отдельных радикалов аминокислот в белке. Третичная структура белка миоглобина впервые была изучена Дж. Кендрью (1957 г.). М. Перутцем (1959 г.) была изучена структура гемоглобина.
В третичную структуру белков входят α — спиральные, β — складчатые структуры, β- петли (в них полипептидная цепь изгибается на 180 0 ) и, так называемый, неупорядоченный клубок. Например, в белке инсулине содержится 57% α — спиральных участков, 6% β- складчатых структур, 10% молекулы уложены в виде β — петлей и 27% молекулы представляют неупорядоченный клубок.
Совокупность первичной, вторичной, третичной структур составляет конформацию белковой молекулы. Прижизненная (нативная) конформация формируется самопроизвольно, и её образование носит название фолдинг. Конформация белков очень не устойчива и формируется при участии особых белков – шаперонов (компаньонов). Шапероны способны связываться с частично денатурированными, находящимися в неустойчивом состоянии белками, и восстанавливать их нативную конформацию. Шапероны классифицируют по их молекулярной массе (60 – 100 кд.). Наиболее изучены Ш-60, Ш-70 и Ш-90. Например, Ш-70 взаимодействуют с белками, богатыми гидрофобными радикалами, защищают их от высокотемпературной денатурации. В целом шапероны экранируют основные белки организма, препятствуют денатурации и способствуют формировании конформации, облегчают транспорт денатурированных белков в лизосомы, участвуют в процессе синтеза белков.
По конформации все белки делятся на три группы:
- фибриллярные белки: коллаген, эластин, фиброин;
- глобулярные белки: гемоглобин, альбумин, глобулин;
- смешанные белки: миозин.
Источник