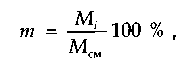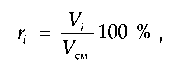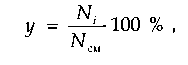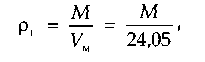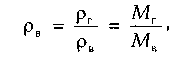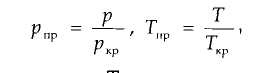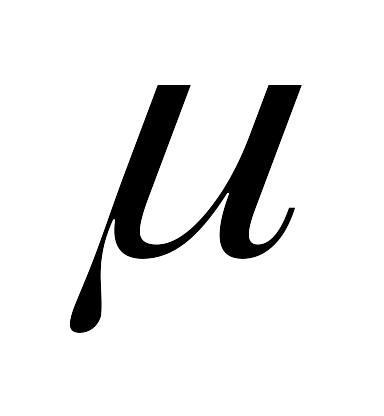1.4. Состав и свойства природного газа
Природный газ представляет собой смесь предельных углеводородов состава СпН2п+2, в которой содержится метан, этан, пропан, бутан и иногда пары более тяжелых углеводородов. Часто в состав природных газов входят азот N2 (до 40 % по объему), углекислота СО2, сероводород H2S и редкие газы.
В газе газовых и газоконденсатных месторождений обычно преобладает метан; его доля достигает 98,8 %; в нефтяном (попутном) газе доля метана намного меньше, однако увеличивается доля более тяжелых углеводородов — этана, пропана и бутана [5, 7, 13, 41].
Состав газовых смесей выражается в виде массовой, объемной или молярной доли компонентов в процентах. Массовая доля в процентах какого-либо компонента газовой смеси представляет собой отношение массы этого компонента к массе всей смеси:
где Мi — масса i-го компонента; Mсм — масса смеси.
Объемная доля (%) какого-либо компонента в смеси газов равна отношению объема компонента к объему всей смеси:
где Vi — объем /-го компонента в смеси; Vсм — объем всей смеси.
Молярная доля компонента определяется аналогично и может быть представлена в виде
где Ni — число молей г-го компонента в смеси; Ncm — суммарное число молей газа в смеси.
Физические свойства природного газа зависят от его состава, но в целом близки к свойствам метана как основного компонента смеси.
Плотность природного газа можно определить взвешиванием или вычислить, зная молекулярную массу смеси М:
где Vm — объем моля газа при стандартных условиях, м 3 .
Обычно рг находится в пределах 0,73— 1,0 кг/м 3 . В расчетах часто используют более удобную величину — относительную плотность Δ так как значение ее практически не зависит от давления и температуры. За величину сравнения принимают плотность воздуха
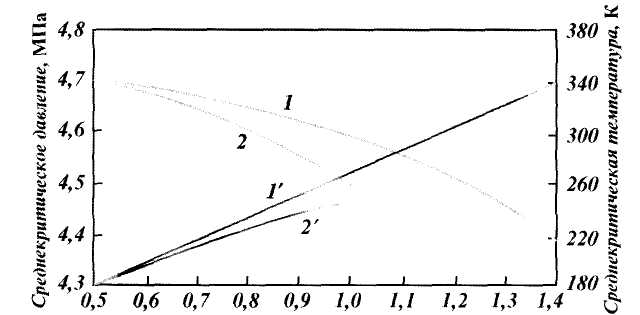
где МГ — масса газа; Мв — масса воздуха.
Относительная плотность газа изменяется от 0,50 до 1,0. Плотность индивидуальных компонентов углеводородных газов (и сероводорода), за исключением метана, больше единицы. При всех расчетах, связанных с движением газа, используется вязкость. Аналитические зависимости вязкости смеси от вязкости входящих в смесь компонентов сложны и имеют недостаточную точность. В связи с этим на практике вязкость определяют по экспериментальным графикам, один из которых приведен на рис. 1.2.
Рис. 1.2. Зависимость вязкости природного газа μ (при Δ = 0,6) от температуры
Состояние газа характеризуется давлением р, температурой Т и объемом V. Соотношение между этими параметрами определяется законами идеальных газов (Бойля — Мариотта, Гей-Люссака и др.), которые имеют чрезвычайно большое
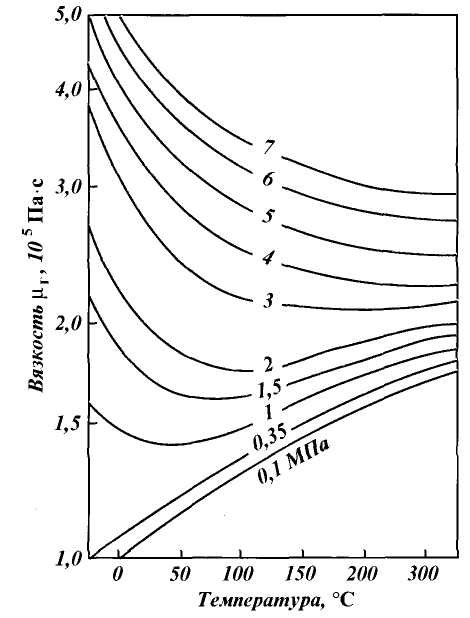
Рис. 1.3. Зависимость коэффициента сжимаемости природного газа от приведенного давления при различных температурах
pV = ZMRT,
где Z — коэффициент сжимаемости; М — масса газа; р — давление; V — объем газа; R — газовая постоянная; Т — абсолютная температура.
Для нефтяных газов значение коэффициента сжимаемости Z можно найти приближенно
Относительная плотность газа
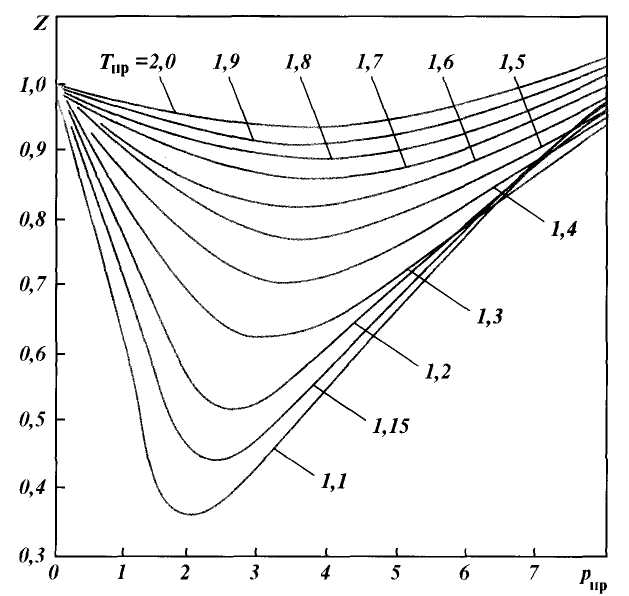
Рис. 1.4. Зависимость среднекритического давления (1, 2) и температуры (1‘ 2′ ) природного газа от относительной плотности:
1, 1‘ — газовое месторождение; 2, 2′ — газоконденсатное месторождение
по графикам Брауна, представленным на рис. 1.3. Коэффициенты сжимаемости Z на этом графике зависят от приведенных давления рпр и температуры Тпр , значения которых можно определить по формулам
где р и Т — соответственно давление и температура газа; ркр и Ткр — критические давления и температура.
Рис. 1.5. Энтальпия природного газа в зависимости от давления и температуры (при относительной плотности газа Δ = 0,6)
газа на конечном участке изменения его давления. Эту величину обычно находят по кривым теплосодержания (рис. 1.5). Зная давление газа и его температуру при одном состоянии, по этим кривым можно найти температуру газа после дросселирования. Для этого от первоначальной точки по линии равного теплосодержания следует переместиться в точку нового значения давления. Температура, соответствующая этой точке, явится искомой величиной. Изменение температуры газа при снижении давления на 0,1 МПа называется коэффициентом Джоуля — Томсона. Эта величина составляет 0,25 — 0,35 °С на 0,1 МПа (1 атм).
Источник
3.4. Физико-химические и теплофизические свойства природных газов
Вязкость — свойство жидкостей и газов, характеризующих сопротивляемость скольжению или сдвигу одной их части относительно другой.
Коэффициент динамической вязкости характеризует силы взаимодействия между молекулами газа, которые преодолеваются при его движении. Динамическая вязкость газа связана с его плотностью т, средней длиной свободного пробега и средней скоростью молекул соотношением
Основной единицей вязкости в системе СИ является паскаль-секунда (Па*с). В нефтепромысловой практике вязкость измеряют в пуазах (П) или сантипуазах (сП). 1сП = 0.01 П= 0.001 Па*с.
Коэффициент кинематической вязкости. В расчетах наряду с абсолютной вязкостью газа применяют кинематическую вязкость 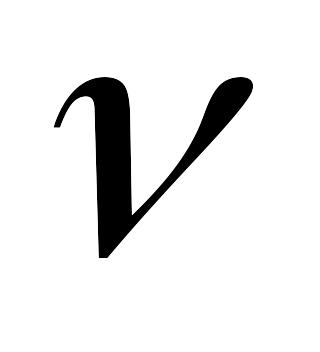
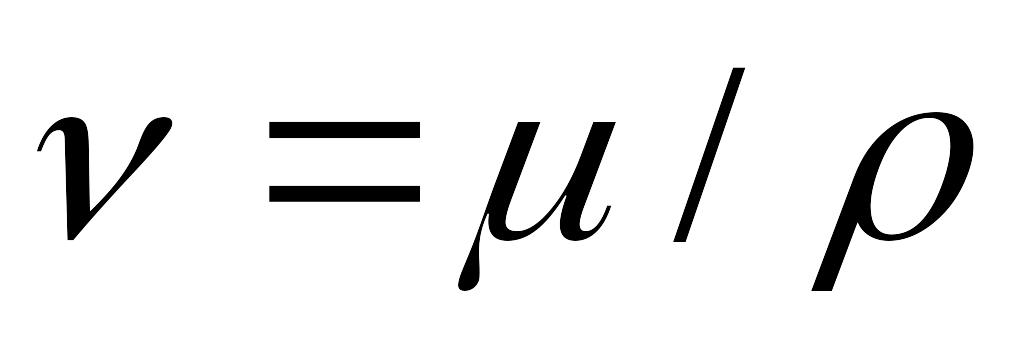
Единицей кинематической вязкости является квадратный метр на секунду (м 2 /с) или квадратный миллиметр на секунду (мм 2 /с). 1 мм 2 /с = 10 -6 м 2 /с.
В нефтепромысловой практике кинематическую вязкость измеряют в Стоксах (Ст) или сантистоксах (сСт). 1 Ст = 10 -4 м 2 /с; 1 сСт = 10 -6 м 2 /с = 1 мм 2 /с.
При пересчетах абсолютной вязкости газа в кинематическую значения плотности или удельного веса берутся при рассматриваемых давлениях и температурах.
Учет влияния на вязкость азота —
Природа вязкости газов и жидкостей. В газах расстояние между молекулами существенно больше радиуса действия молекулярных сил, поэтому вязкость газов – следствие хаотического (теплового) движения молекул, сопровождающее переносом от слоя к слою определённого количества движения, в результате медленные слои ускоряются, а более быстрые замедляются. Работа внешних сил, уравновешивающих вязкое сопротивление и поддерживающее установившееся течение, полностью переходит в теплоту.
В жидкостях, где расстояние между молекулами много меньше, чем в газах, вязкость обусловлена молекулярным взаимодействием, ограничивающим подвижность молекул. В жидкости молекула может проникнуть в соседний слой лишь при образовании в нём полости, достаточной для перескакивания туда молекулы. На образование полости (на «рыхление» жидкости) расходуется так называемая энергия активации вязкого течения.
При больших давлениях (больше 10 – 15 МПА) газы становятся не идеальными, так как средние расстояния между молекулами становятся сравнимыми с радиусом межмолекулярного взаимодействия, и природа вязкости газов становится аналогичной жидкости.
3.4.2. Качественная зависимость вязкости газов и жидкостей от температуры.
В идеальном газе вязкость не зависит от плотности (давления), а определяется величинами средней скорости и длиной свободного пробега молекул. Так как средняя скорость возрастает с повышением температуры (несколько возрастает также и длина свободного пробега), то вязкость газов увеличивается при нагревании (пропорционально корню квадратному от температуры) (рисунок 9). Присутствие неуглеводородных компонентов в газе повышает вязкость природного газа.
В жидкостях энергия активации уменьшается сростом температуры и понижением давления. В этом состоит одна из причин резкого снижения вязкости жидкостей с повышением температуры и роста её при высоких давлениях.
В силу того, что при больших давлениях газы приобретают свойства жидкости, то при давлениях больших 10 – 15 МПа вязкость природных газов падает с ростом температуры (рисунок 9), но само значение вязкости повышается с ростом давления.
Рис. 9. Вязкость природного газа при различных значениях давлениях и температуры
Источник
ХИМИЯ НЕФТИ
Вязкость углеводородных газов и нефтяных паров подчиняется иным, чем для жидкостей, закономерностям. С повышением температуры вязкость газов возрастает. Эта закономерность удовлетворительно описывается формулой Сазерленда:
Для расчета вязкости индивидуальных углеводородных газов применяется формула:
Вязкость газов, нефтяных паров можно определить по графическим зависимостям:
- вязкость газообразных алканов при 1 атм;
Вязкость природных газов известной молекулярной массы или относительной плотности (по воздуху) при атмосферном давлении и заданной температуре может быть определена по кривым, представленным на рисунке.
Как видно из рисунка, с повышением относительной плотности и понижением температуры вязкость газа уменьшается.
Вязкость газов мало зависит от давления в области до 5-6 МПа. При более высоких давлениях она растет и при давлении около 100 МПа увеличивается в 2-3 раза по сравнению с вязкостью при атмосферном давлении. Для определения вязкости при повышенных давлениях пользуются эмпирическими графиками.
Источник