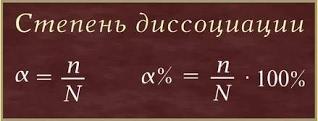- 32. Свойства растворов электролитов, характеристики растворов электролитов: степень электролитической диссоциации. Константа диссоциации. Закон разбавления Оствальда.
- 33. Понятие изотонического коэффициента и формулы расчета коллигативных свойств для электролитов. Связь степени электролитической диссоциация и изотонического коэффициента.
- 34. Ионно-обменные реакции, полные и сокращенные. Направление протекания ионно-обменных реакций.
- 2 Примеры записи реакций ионного обмена
- 35. Электролитическая диссоциация воды, водородный показатель (рН). Расчет водородного показателя.
- 10. Факторы, влияющие на степень
- Степень электролитической диссоциации
- Сильные и слабые электролиты
- Классификация электролитов в зависимости от степени электролитической диссоциации (памятка)
32. Свойства растворов электролитов, характеристики растворов электролитов: степень электролитической диссоциации. Константа диссоциации. Закон разбавления Оствальда.
По величине степени диссоциации все электролиты можно условно разделить на сильные (степень диссоциации которых стремится к единице) и слабые (степень диссоциации которых стремится к нулю).
Сильные электролиты в растворах практически полностью распадаются на ионы, и уравнение диссоциации для таких электролитов принято записывать как необратимый процесс.
К сильным электролитам относят щелочи, все соли, некоторые кислоты (HCl, HNO3, H2S04, НСlO4, HBr, HI, CF3COOH и др.).
Слабые электролиты в растворах диссоциируют очень незначительно, причем этот процесс обратим.
К слабым электролитам относятся многие неорганические (H2S, H2C03, HCN) и почти все органические кислоты. Вода, будучи причиной диссоциации, сама незначительно диссоциирует.
Степень диссоциации зависит как от природы растворённого электролита, так и от концентрации раствора.
Константа диссоциации — вид константы равновесия, которая характеризует склонность объекта диссоциировать (разделяться) обратимым образом на частицы, как, например, когда комплекс распадается на составляющие молекулы, или когда соль диссоциирует в водном растворе на ионы.
Закон разведения Оствальда: степень диссоциации электролита при разбавлении раствора увеличивается
33. Понятие изотонического коэффициента и формулы расчета коллигативных свойств для электролитов. Связь степени электролитической диссоциация и изотонического коэффициента.
Изотонический коэффициент — безразмерный параметр, характеризующий поведение вещества в растворе.
Изотонический коэффициент ί связан со степенью диссоциации электролита αдис соотношением:
ί = 1 + αдис (p — 1) или α = (ί — 1) /( p — 1).
Здесь p — число ионов, на которые распадается молекула электролита (для КСl p= 2, для ВаСl2 и Na2SO4 p = 3 и т.д). Экспериментально найденное значение изотонического коэффициента используют для вычисления степени диссоциации электролита растворе.
34. Ионно-обменные реакции, полные и сокращенные. Направление протекания ионно-обменных реакций.
Реакциями ионного обмена называют реакции между растворами электролитов, в результате которых они обмениваются своими ионами. Реакции ионного обмена протекают до конца (являются практически необратимыми) в тех случаях, если образуются слабый электролит, осадок (нерастворимое или малорастворимое вещество), газ.
2 Примеры записи реакций ионного обмена
Пример 1– В результате реакции образуется нерастворимое вещество
Молекулярное уравнение реакции взаимодействия растворимой соли со щелочью
CuCl2 + 2KOH → 2KCl + Cu(OH)2↓.
Полное ионное уравнение реакции
Cu 2+ + 2Cl – + 2K + + 2OH – → 2K + + 2Cl – + Cu(OH)2↓.
Сокращенное ионное уравнение реакции
Cu 2+ + 2OH – → Cu(OH)2↓.
35. Электролитическая диссоциация воды, водородный показатель (рН). Расчет водородного показателя.
Электролитическая диссоциация — процесс распада электролита на ионы при его растворении или плавлении.
Водородный показатель (рН) величина, характеризующая активность или концентрацию ионов водорода в растворах
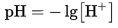
Источник
10. Факторы, влияющие на степень
Рассмотрим более подробно, как зависит степень диссоциации от различных факторов.
Природа электролита – главный фактор, определяющий степень диссоциации. Чем более полярной является химическая связь между атомами или группами атомов в молекуле, тем сильнее растворитель с высоким значением диэлектрической проницаемости препятствует электростатическому взаимодействию ионов противоположного знака в растворе, тем больше степень диссоциации. В том случае, если вещество содержит только ковалентные связи между атомами или группами атомов, то оно не диссоциирует в растворе. Но не всегда вещества с большей ионностью связи сильнее диссоциируют в растворах. Так, для галогеноводородов ионность связи уменьшается от HF к HI, тем не менее степень диссоциации иодоводородной кислоты значительно больше степени диссоциации фтористоводородной кислоты (см. табл. 11). Это можно объяснить тем, что в водном растворе вследствие процесса гидратации меняется характер химической связи между частицами вещества. Протон в воде сильно гидратируется и образует достаточно объёмные ионы гидроксония Н3О + , которые оказывают гораздо меньшее поляризующее действие на ион галогена, чем не гидратированный. В ряду F‾ – Cl‾ – Br‾ – I‾ радиус иона увеличивается, а это приводит к тому, что связь в молекуле HI становится более ионной, чем в HF.
Характеристики галогеноводородов и степень диссоциации их в растворах
Увеличение константы диссоциации в ряду уксусной кислоты и ее хлорзамещенных СН3СООН – СН2ClСООН – СНCl2СООН – СCl3СООН обусловлено оттягиванием электронов от группы ОН электроотрицательным атомом хлора.
Сила бескислородных кислот Hn + Э — n зависит от радиуса иона элемента и его степени окисления, она увеличивается с ростом ионного радиуса и с уменьшением условного заряда иона n.
Сила кислородсодержащих кислот, формула которых имеет общий вид Э +(2 m + n ) Om(ОН)n, зависит как от природы элемента Э, так и от значений m и n. Ввиду большой электроотрицательности атома кислорода он оттягивает электроны от связей O–Н, и поэтому сила кислот увеличивается с ростом числа атомов кислорода m и уменьшением n – числа связей O–Н. Кроме того, она растет с увеличением степени окисления элемента.
О закономерностях изменения силы кислородсодержащих кислот можно судить по значениям первой константы диссоциации этих кислот в водных растворах: Сl(ОН), т. е. НОСl, В(ОН)3, Si(OH)4, Те(ОН)б (m = 0) являются слабыми кислотами (для них K1 < 10 -8 ); NO(OH), т.е. HNO2, SO(OH)2, т.е. Н2SO3, IO(ОН)5, т.е. H5IO6 (m = 1) — значительно сильнее (для них K1 = 10 -5 ÷ 10 -2 ); NO2(OH), т.е. НNО3, SO2(OH)2, т.е. H2SO4 (m = 2) – сильные кислоты.
Природа растворителя. Природа растворителя оказывает существенное влияние на степень диссоциации растворённого вещества. Степень диссоциации в значительной мере зависит от диэлектрической проницаемости растворителя. Чем больше диэлектрическая проницаемость среды, тем больше степень электролитической диссоциации. Это хорошо видно на примере иодида тетраметиламмония, степень диссоциации которого растёт с увеличением диэлектрической проницаемости растворителя (табл. 12).
Замена воды, имеющей диэлектрическую проницаемость 81, на растворитель с меньшей диэлектрической проницаемостью, например, на этиловый спирт (ξ=25), сильно понижает степень диcсоциации. Сильные электролиты в спирте становятся электролитами средней силы, а слабые – практически не диссоциируют. Вследствие высокой диэлектрической проницаемости воды в ней даже при больших концентрациях растворённого вещества маловероятно образование ионных пар. В средах с малой диэлектрической проницаемостью ионные пары образуются легко.
Значения степени диссоциации 0,01 М раствора N + (CH3)4I‾
в различных растворителях
Влияние температуры. Константа диссоциации является характерной величиной для данного электролита и растворителя и зависит лишь от температуры. Для многих электролитов существует достаточно широкий температурный интервал, в котором наблюдается простая зависимость между тепловым эффектом, степенью диссоциации и температурой. Если процесс диссоциации экзотермичен, то с повышением температуры степень диссоциации падает. При эндотермическом процессе – повышение температуры ведёт к увеличению степени диссоциации. Но в общем случае степень электролитической диссоциации сложным образом зависит от температуры (см. рис. 18).
Для многих электролитов константа диссоциации проходит через максимум. Так, степень диссоциации уксусной кислоты максимальна при 25 °С (Кд = 1,75·10 –5 ). Выше и ниже этой температуры степень диссоциации уксусной кислоты меньше ( при 0 °С Кд = 1,65·10 –5 , при 50 °С Кд = 1,62·10 –5 ). В соответствии с принципом Ле Шателье это объясняется переменой знака энтальпии процесса диссоциации, что связано с различным влиянием температуры на гидратацию ионов и нейтральных молекул.
Рис. 18. Зависимость константы
диссоциации некоторых слабых
электролитов в водных растворах
С увеличением концентрации растворов степень электролитической диссоциации уменьшается, так как ионы чаще сталкиваются друг с другом с образованием молекул или ионных пар.
Например, рассмотрим влияние концентрации растворенного вещества на степень диссоциации CH3COOH при 18 °С. (табл. 13)
Зависимость степени электролитической диссоциации и
константы диссоциации уксусной кислоты от ее концентрации
Источник
Степень электролитической диссоциации
Поскольку электролитическая диссоциация — процесс обратимый, то в растворах электролитов наряду с их ионами присутствуют и молекулы. Другими словами, различные электролиты, согласно теории С. Аррениуса, диссоциируют на ионы в различной степени. Полнота распада (сила электролита) характеризуется количественной величиной – степенью диссоциации. Степень диссоциации (α– греческая буква альфа) — это отношение числа молекул, распавшихся на ионы (n), к общему числу растворенных молекул (N):
Степень диссоциации электролита определяется опытным путем и выражается в долях единицы или в процентах. Если α = 0, то диссоциация отсутствует, а если α = 1 или 100%, то электролит полностью распадается на ионы. Если же α = 20%, то это означает, что из 100 молекул данного электролита 20 распалось на ионы. Степень диссоциации зависит от природы электролита и растворителя, от концентрации электролита, температуры. 1. Зависимость степени диссоциации от природы: чем полярнее химическая связь в молекуле электролита и растворителя, тем сильнее выражен процесс диссоциации электролита на ионы и тем выше значение степени диссоциации. 2. Зависимость степени диссоциации от концентрации электролита: с уменьшением концентрации электролита, т.е. при разбавлении его водой, степень диссоциации всегда увеличивается. 3. Зависимость степени диссоциации от температуры: степень диссоциации возрастает при повышении температуры (повышение температуры приводит к увеличению кинетической энергии растворённых частиц, что способствует распаду молекул на ионы).
Сильные и слабые электролиты
В зависимости от степени диссоциации различают электролиты сильные и слабые. Электролиты со степенью диссоциации больше 30% обычно называют сильными, со степенью диссоциации от 3 до 30% — средними, менее 3% — слабыми электролитами.
Классификация электролитов в зависимости от степени электролитической диссоциации (памятка)
| Классификация электролитов | Сильные электролиты | Средние электролиты | Слабые электролиты |
| Значение степени диссоциации (α) | α>30% | 3%≤α≤30% | α |
| Примеры | 1. Растворимые соли; 2. Сильные кислоты (НСl, HBr, HI, НNО3, НClO4, Н2SO4(разб.)); 3. Сильные основания – щёлочи. | H3PO4 H2SO3 | 1. Почти все органические кислоты (CH3COOH, C2H5COOH и др.); 2. Некоторые неорганические кислоты (H2CO3, H2S и др.); 3. Почти все малорастворимые в воде соли, основания и гидроксид аммония (Ca3(PO4)2; Cu(OH)2; Al(OH)3; NH4OH); 4. Вода. |
1.3 Схема электролитической диссоциации электролита с ковалентными связями; роль воды в процессе Следовательно, в результате диссоциации в растворе появляются ионы, которые являются предпосылкой для появления у раствора или расплава такого физического свойства как электропроводимость. Как же происходит процесс растворения?. Разрушение ионной кристаллической решётки происходит под воздействием растворителя, например воды. Полярные молекулы воды настолько снижают силы электростатического притяжения между ионами в кристаллической решётке, что ионы становятся свободными и переходят в раствор. При расплавлении , когда происходит нагревание кристалла, ионы начинают совершать интенсивные колебания в узлах кристаллической решётки, в результате чего она разрушается, образуется расплав, который состоит из ионов. Теорию электролитической диссоциации создал в 1884-1887 гг. шведский химик Аррениус .Эта классическая теория позволила как электропроводимость расплавов и растворов, так и протекание химических реакций в растворах между расплавленными или растворёнными веществами. Схема электролитической диссоциации. 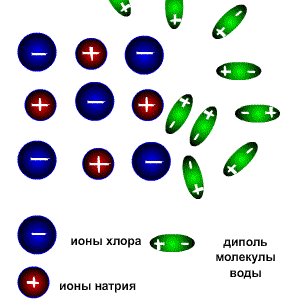
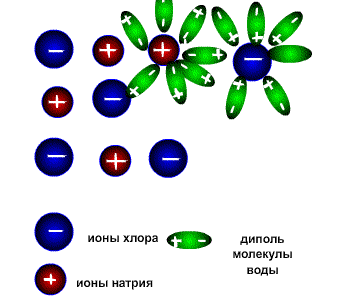
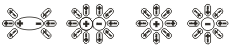
NaCl  Na + + Cl — Na + + Cl — |
Электролитическую диссоциацию вызывает не только вода, но и неводные полярные растворители, такие как Жидкий аммиак и жидкий диоксид серы. Однако именно для воды характерно свойство ослаблять электростатическое притяжение между ионами в решётке выражено особенно ярко. Свободные ионы, оказавшиеся в водном растворе окружаются полярными молекулами воды: вокруг ионов образуется гидратная оболочка, т.е. протекает процесс гидратации.
Источник